川芎嗪对脓毒症急性肾损伤小鼠血管内皮细胞的保护作用
应静 吴晋 姚利峰
急性肾损伤(acute kideny injury,AKI)是脓毒症患者最常见的并发症。据报道,64.4%的脓毒症患者发展为AKI[1],而且脓毒症致AKI患者病死率显著增加,是非脓毒症致AKI及单纯脓毒血症患者的5倍[2-3],目前尚缺乏有效的治疗措施[4]。川芎嗪是从伞形科藁本属植物川芎的根中提取的生物碱,长期用于治疗缺血缺氧性心血管疾病[5]。最近的基础和临床研究表明,川芎嗪具有广泛的药理作用,如抗氧化应激、抗炎、抗凋亡、保护肾脏、抑制内皮细胞的凋亡等[6-10]。但是川芎嗪对脓毒症所致AKI的影响,目前尚未见到相关报道。本研究将川芎嗪用于脓毒症小鼠模型,旨在探讨川芎嗪对脓毒症AKI小鼠血管内皮细胞的保护作用。
1 材料和方法
1.1 材料 SPF级雄性C57BL/6小鼠54只(上海斯莱克实验动物有限责任公司),6~8周龄,体重20~25 g。主要试剂:盐酸川芎嗪(平光制药股份有限公司)。苏木精-伊红(美国SIGMA公司)。一抗Anti-vWF antibody(Proteintech公司)。二抗HRP标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司)。DAB显色试剂盒(北京中杉金桥生物技术有限公司)。主要仪器:数码相机(佳能505D)、电子天平(苏测电子科技有限公司,SC-AC-1200AS型)、超低温冰箱(青岛海尔集团,DW-86L388型)、隔水式恒温培养箱(上海跃进医疗器械有限公司,PYX-DHS500BS-Ⅱ型)、轮转式切片机(LEICA公司,RM2235型)、病理组织漂烘仪(常州市郝思琳仪器设备有限公司,Tec 2500型)。
1.2 方法
1.2.1 分组 将54只小鼠常规适应性饲养1周后,按照随机化区组分为5组:假手术组10只,安慰剂组、川芎嗪低剂量组、川芎嗪中剂量组、川芎嗪高剂量组各11只。
1.2.2 脓毒症模型建立及分组给药 采用盲肠结扎穿刺(cecal ligation and puncture,CLP)手术建立小鼠脓毒症模型。假手术组:只做剖腹关腹,不行CLP。安慰剂组:先予尾静脉注射0.9%氯化钠注射液0.15 ml,预处理30 min后行CLP造模。川芎嗪低、中、高剂量组:根据文献[11-12],分别尾静脉注射不同浓度川芎嗪(10、30、60 mg/kg川芎嗪溶于0.15 ml 0.9%氯化钠注射液中),预处理30 min后CLP造模。
1.3 观察指标 观察5组小鼠造模后6 h、12 h、24 h、3 d存活率。造模后第3天每组存活的小鼠中随机取5只,用代谢笼采集24 h小鼠尿液,然后4%水合氯醛(400 mg/kg)腹腔注射麻醉,通过摘除眼球放血法处死,并眼眶采血1 ml左右。小鼠放血死亡后立即取出肾脏,以蒸馏水反复冲洗除去血污,光镜下拍照。留取左侧肾脏标本,剪一半用以检测肾脏含水量,另一半肾脏冻存。右侧肾脏4%甲醛固定后送病理检查。
1.3.1 肾脏含水量检测 将半个肾脏称其湿重后,置于37℃烘箱烘48 h后称干重,以(湿重-干重)/湿重×100%计算肾脏含水量来判定肾脏的水肿程度。
1.3.2 肾组织病理学检查 将4%甲醛固定的肾脏标本经梯度乙醇脱水、石蜡包埋切片(厚度4 μm),行HE染色,光学显微镜下放大200倍观察肾组织的形态结构以及炎症情况,并进行半定量评分,肾小管上皮有无凋亡、坏死或绒毛减少(1分),肾小管管腔有无扩张(1分),肾间质有无管型(1分)或炎症浸润(1分),肾间质有无充血或肾小球毛细血管瘀血(1分),每有1项加1分,总分为5分,0分代表无明显病变,评分越高则表示肾损伤程度越重。
1.3.3 肾损伤分子1(kidney injury molecule 1,Kim-1)水平的测定 采用ELISA法。将小鼠尿液样本以1 000 r/min离心10 min。取离心后的上清液100 μl添加至ELISA板上,在37℃温育1 h后弃去孔内液体。然后顺序加反应试剂A和B,甩干后加底物溶液90 μl,在37℃避光显色20 min,最后加终止液50 μl。在确保板底无水滴及孔内无气泡,立即用酶标仪于450 nm波长测量各孔的光密度值(OD值)。
1.3.4 内皮细胞损伤标志物血管性血友病因子(von Willebr and Factor,vWF)表达的检测 采用免疫组化法。将4%甲醛固定的肾脏标本经梯度乙醇脱水、石蜡包埋切片(厚度 4 μm)。采用一抗 Anti-vWF antibody(稀释 1∶50,美国Proteintech公司)、二抗HRP标记的山羊抗兔IgG(无稀释,中杉金桥生物技术有限公司),然后用DAB显色试剂盒进行比色检测,在光学显微镜下放大200倍观察并获得图像。染色结果采用半定量分析方法:以染色强度结合阳性细胞数百分比进行评分。染色强度以多数细胞呈现的染色强度并减去背景着色计分:无明显着色为0分,轻微为1分,中度为2分,重度为3分。阳性细胞百分比即每张免疫组化切片选择5个不同的视野(×200)观察:0~5%为 0分,6%~25%为 1分,26%~50%为2分,51%~75%为3分,>75%均为4分。最终分值以阳性细胞百分比与染色强度之和表示,0分为阴性,3分为弱阳性,4~5分为中度阳性,6~7分为强阳性。
2 结果
2.1 5组小鼠存活率的比较 在CLP术后第3天,安慰剂组小鼠的存活率明显低于假手术组(表1),第3天存活率仅为45.5%。川芎嗪预处理可提高小鼠存活率,川芎嗪高剂量组小鼠存活率最高(与假手术组相似)。
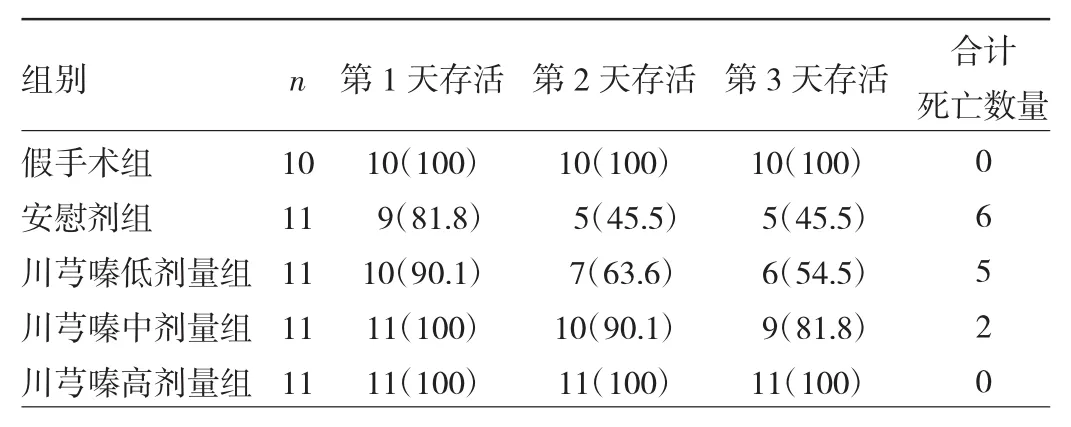
表1 5组小鼠存活率的比较[只(%)]
2.2 5组小鼠肾脏含水量的比较 安慰剂组小鼠肾脏含水量明显高于假手术组(P<0.01)。与安慰剂组相比,经过川芎嗪预处理的小鼠肾脏含水量明显降低(P<0.05)。此外,川芎嗪高剂量组小鼠肾脏含水量降低到与假手术组小鼠相似的水平。见表2。

表2 5组小鼠肾脏含水量的比较(%)
2.3 5组小鼠肾脏病理形态学分析 镜下观察可见,假手术组无明显组织学病变,安慰剂组肾组织损伤最严重,不同的样本中可以发现肾小管内管型及扩张,明显的肾间质炎症,肾小管上皮水肿、凋亡和间质充血及小球毛细血管淤血(图1,插页)。对肾脏的组织学特征进行半定量评分(表3),安慰剂组评分明显高于假手术组(P<0.01)。与安慰剂组相比,川芎嗪中剂量组和高剂量组评分明显降低(均P<0.05)。

图1 5组小鼠肾脏组织病理结果(红色箭头示蛋白管型,蓝色箭头示间质充血或小球毛细血管淤血,黄色箭头示肾小管扩张,HE染色,×200)
2.4 5组小鼠尿液Kim-1水平的比较 安慰剂组尿液Kim-1水平较假手术组明显升高(P<0.01),与安慰剂组相比,川芎嗪低剂量组尿液Kim-1水平无统计学差异,川芎嗪中剂量和高剂量组尿液Kim-1水平显著降低(P<0.05),见表 4。

表3 5组小鼠肾脏病理损伤评分的比较(分)

表4 5组小鼠尿液Kim-1水平的比较(pg/ml)
2.5 5组小鼠vWF表达的比较 镜下观察可知,vWF表达于细胞质中,阳性呈黄棕色(图2,插页)。安慰剂组vWF表达评分明显高于假手术组(P<0.01)。与安慰剂组相比,川芎嗪低、中、高剂量组vWF表达评分明显降低(P<0.05),且随着川芎嗪剂量的增高评分依次降低,高剂量组表达最低,接近假手术组水平,见表5。
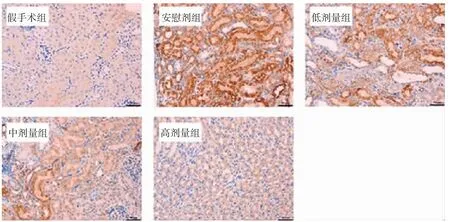
图2 5组小鼠肾脏组织vWF表达的影响(CLP术后3 d,免疫组化检测小鼠肾组织vWF表达,vWF表达于细胞质中,阳性呈黄棕色)

表5 5组小鼠vWF表达的比较(分)
3 讨论
脓毒症以器官功能障碍为特征,长期以来被推测与AKI的发展有关,脓毒症合并AKI是危重患者不良预后的独立危险因素,能够导致患者病死率显著增加[4,13]。研究表明,这种病理改变可以通过外科手术(CLP)来实现,CLP常用于脓毒症实验的医学研究[14]。本研究通过CLP手术成功建立了小鼠脓毒症模型,并产生了严重的肾脏损伤。结果显示,安慰剂组小鼠的存活率明显低于假手术组,第3天存活率仅为45.5%,假手术组为100%。安慰剂组小鼠肾脏含水量明显高于假手术组,肾脏水肿严重,HE染色下可见安慰剂组小鼠肾组织损伤最严重,不同的样本中可以发现肾小管内管型及扩张,明显的肾间质炎症,肾小管上皮水肿、凋亡和间质充血及小球毛细血管瘀血,而假手术组小鼠肾组织无明显病理改变。在脓毒症相关的AKI中,Kim-1是一个重要的急性肾脏损伤标志物[15],尿液Kim-1水平升高可以较早的提示发生了肾小管损伤[16-17]。本研究同样观察到安慰剂组小鼠尿液中Kim-1水平较假手术组有明显增高(P<0.01)。
目前脓毒症造成肾脏损伤机制还不完全明了,但多数研究认为与以下因素有关:炎性介质、凝血功能异常、肾缺血再灌注、内毒素、细胞坏死和细胞凋亡。其中血管内皮细胞的激活与损伤扮演了非常重要的角色。研究表明,脓毒症进展中大量释放的内毒素既能够刺激机体炎症反应的级联放大激活并通过炎症反应来引起内皮细胞损害,也能直接作用于血管内皮,启动细胞凋亡程序引起内皮细胞损伤[18-19]。受损的内皮细胞产生血管扩张因子减少,氧化应激水平明显提高,血管内壁结构完整性被破坏,肾毛细血管肿胀闭塞、通透性增加,导致肾微循环功能障碍,这可能是脓毒症所致AKI发生的重要血流动力学因素[20-21]。vWF是体内止血和血栓形成的主要血浆成分,90%以上的血液循环中vWF是由内皮细胞合成释放的。内皮细胞损伤和功能紊乱后产生vWF增多,导致局部脏器呈现高凝状态,微血栓形成,加重微循环功能障碍。因此vWF可以作为反映内皮细胞损伤的灵敏生物学指标[22]。本研究中,免疫组化显示假手术组小鼠肾组织vWF低表达,安慰剂组小鼠vWF表达明显高于假手术组,也提示脓毒症小鼠肾组织内皮细胞出现明显损伤。因此调整肾血管内皮细胞功能可能为脓毒症相关的AKI患者提供一种潜在的治疗选择。
川芎嗪作为从传统中草药川芎中提取的生物碱,被证实对循环系统和血管内皮系统有广泛的药理作用,已广泛应用于冠心病、缺血性脑血管病、血栓闭塞性血管病、肺动脉高压以及肺心病的治疗。很多研究证实川芎嗪具有肾脏保护功能,川芎嗪可以减轻小鼠和大鼠的肾缺血再灌注损伤[23-24],可以抑制抗癌药物顺铂诱导的大鼠肾小管凋亡[25],还被证实可以抑制阿霉素、庆大霉素诱导的大、小鼠肾小管细胞凋亡[26-28]。但是对脓毒症所致AKI的影响目前尚不清楚。
本研究使用川芎嗪治疗CLP手术诱导的脓毒症AKI小鼠,发现川芎嗪预处理能显著减轻肾脏损伤,保护肾功能,提高脓毒症AKI小鼠生存率。与安慰剂组相比,川芎嗪组小鼠生存率显著提升,川芎嗪高剂量组小鼠3 d存活率达到100%。川芎嗪各剂量组小鼠的肾脏含水量也较安慰剂组明显降低,提示川芎嗪改善了肾脏的水排泄功能,有助于减轻肾功能障碍。小鼠肾组织HE染色后高倍镜下观察可知,假手术组小鼠无明显肾组织学改变,安慰剂组则发生明显的肾组织病理损伤。与安慰剂组相比,川芎嗪组,特别是中剂量组和高剂量组小鼠的肾组织学病理损伤评分明显降低,川芎嗪各剂量组随着川芎嗪剂量增高肾组织损伤逐渐减轻,这表明川芎嗪对脓毒症AKI小鼠有积极的治疗作用。小鼠尿液Kim-1水平变化也提示了川芎嗪对脓毒症AKI小鼠肾脏的保护作用,与安慰剂组相比,川芎嗪中剂量和高剂量组尿液Kim-1水平显著降低。同时发现,vWF表达在安慰剂组小鼠肾组织中显著升高,而在川芎嗪各剂量组则显著降低,且随着川芎嗪预处理剂量的增加依次降低,川芎嗪高剂量组的vWF表达已经降低到接近假手术组的程度,表明川芎嗪能有效减轻脓毒症AKI小鼠肾血管内皮细胞的损伤。川芎嗪保护血管内皮细胞的机制很广泛,有研究认为川芎嗪可能是通过保护超氧化物歧化酶和谷光甘肽过氧化物酶活性,增强内皮细胞的抗氧化能力来保护内皮细胞[29];也有多项细胞实验证实川芎嗪对氧化应激、缺血缺氧引起的内皮细胞凋亡具有抑制作用[30-31]。这些研究为川芎嗪保护血管内皮细胞提供了理论基础。
综上所述,在小鼠的脓毒症所致AKI中,川芎嗪能有效减轻肾脏损伤,保护肾功能,该作用可能与川芎嗪对血管内皮细胞的保护作用有关,需要进一步研究来寻找川芎嗪保护血管内皮细胞,保护脓毒症所致AKI的分子机制。

