两种模型动态对比增强磁共振成像在宫颈癌病理分级中的应用价值
章俞 赵振华 韦明珠 杨立铭 黄亚男 阮雅文 王丽
宫颈癌严重威胁女性健康,最新统计数据表明,宫颈癌是导致20~39岁女性死亡的第二大原因[1]。病理分级是评价宫颈癌恶性生物学行为及预后的重要指标。近年来动态对比增强磁共振成像(DCE-MRI)逐渐在宫颈癌的诊断、分期及放化疗的疗效评价等方面得到应用[2-5]。但宫颈癌DCE-MRI定量分析中,不同计算模型得到的定量参数结果是否有差异,尚存在争议[6]。本研究通过对比Extended Tofts Linear模型和Extended Tofts模型DCE-MRI定量参数在评价宫颈癌病理分级中的效能,探讨两种模型测量参数在宫颈癌病理分级中的应用价值。
1 对象和方法
1.1 对象 回顾绍兴市人民医院2016年1月至2019年10月收治的31例宫颈癌患者,年龄26~70岁,平均56.4岁。纳入标准:(1)经手术病理证实为宫颈癌;(2)术前行DCE-MEI检查;(3)未经抗肿瘤治疗的初治者。排除标准:(1)全身情况不佳,不能耐受 MRI检查;(2)心脏起搏器植入或体内有其他铁磁性金属植入物;(3)MRI图像质量不佳,不能用于分析。病理组织类型鳞癌26例,腺癌4例,神经内分泌癌1例。病理分级低分化17例,中分化5例,高分化9例。本研究经本院医学伦理委员会审批同意,所有患者均知情同意。
1.2 检查方法 采用德国Siemens Verio 3.0 T超导型MR扫描仪和12通道相控阵表面线圈。先行常规平扫,横断面扫描参数为FOV 300 mm×300 mm,层厚6.0 mm,层距0.6 mm,快速自旋回波T1WI序列(TR 720 ms、TE 11 ms)和脂肪抑制 T2WI序列(TR 5 750 ms、TE 79 ms);矢状面扫描参数为FOV 260 mm×260 mm,层厚4.0 mm,层距 0.4 mm,脂肪抑制 T2WI序列(TR 4 500 ms、TE 97 ms)。然后行矢状面多反转角T1WI快速三维容积内插屏气脂肪抑制序列扫描,FOV 280.0 mm×225.6 mm,层厚 5 mm,层距 1 mm,TR 3.41 ms,TE 1.26 ms,反转角5°、10°、15°,各扫 1 期,时间分辨率 6.5 s/期。再行 DCEMRI,采用矢状面T1WI多期扫描快速三维容积内插屏气脂肪抑制序列,反转角10°,时间分辨率6.5 s,并行采集技术采集1次,FOV 282 mm×350 mm,层厚5 mm,层间距 1 mm,TR 3.3 ms,TE 1.2 ms。DCE-MRI共扫描 35个时相,成像时间227.5 s,在第三时相用高压注射器经肘正中静脉注射对比剂钆双胺0.1 mmol/kg,流率3.0 ml/s,注射结束后以相同流率注射0.9%氯化钠注射液20 ml冲洗。
1.3 数据处理和分析 将DCE-MRI图像通过血流动力学软件 Omni Kinetics(GE Healthcare,China)进行图像后处理,髂内动脉取代子宫动脉勾画感兴趣区(ROI),范围约20 mm2,拟合ROI内髂内动脉的对比剂时间-浓度曲线作为子宫的动脉输入函数。利用单输入血流动力学 Extended Tofts Linear模型和Extended Tofts模型计算出31个宫颈癌的定量灌注参数[Ktrans:对比剂从血管(血浆)间隙渗漏到血管外细胞外间隙转运系数;Kep:对比剂从血管外细胞外间隙返回血管(血浆)间隙的速率常数;Ve:血管外细胞外间隙容积分数;Vp:血管(血浆)间隙容积分数]。宫颈癌病灶ROI选择病灶矢状面最大径层面,选取时避开坏死、囊变区,范围86~1 226 mm2,平均376.39 mm2。由1位具有10年盆腔影像诊断经验的放射科医师手动勾画病灶ROI,每组数据重复测量3次,取平均值。
1.4 病理分级 标本用10%多聚甲醛进行固定,组织脱水后,二甲苯透明后常规石蜡包埋,包埋处理完善的蜡块进行连续切片,行HE染色,常规镜下观察。根据宫颈癌的组织学分级Borders修订版分级法,分级系统由细胞异型性、核分裂和角化珠的数量组成,分为低度恶性的高分化宫颈癌、中度恶性的中分化宫颈癌、高度恶性的低分化宫颈癌。
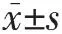
2 结果
2.1 3组不同病理分级宫颈癌患者的年龄及肿瘤体积的比较 不同病理分级宫颈癌患者的年龄及肿瘤体积比较差异均无统计学意义(均P>0.05),见表1。
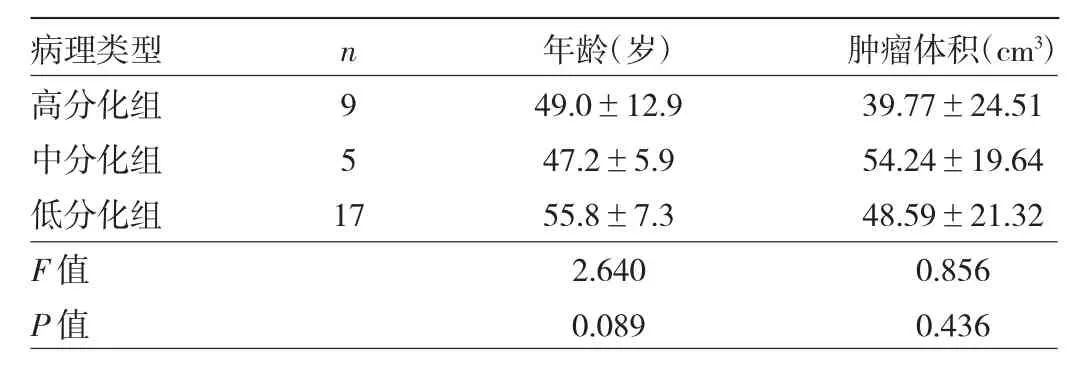
表1 3组不同病理分级宫颈癌患者的年龄及肿瘤体积的比较
2.2 不同分化宫颈癌两种模型DCE-MRI的特征 使用Extended Tofts Linear模型和Extended Tofts模型得到的Ktrans参数彩图均能清晰显示病灶(图1、2,插页)。两种模型均显示高、低分化宫颈癌病灶内部呈不均匀强化,低分化宫颈癌病灶Ktrans整体较高分化病灶高。

图1 45岁宫颈高分化鳞状细胞癌患者(a:子宫MRI增强图;b:用Extended Tofts模型计算得到的Ktrans伪参数图,Ktrans值为0.602 min-1;c:用Extended Tofts Linear模型计算得到的Ktrans伪参数图,Ktrans值为0.574 min-1)
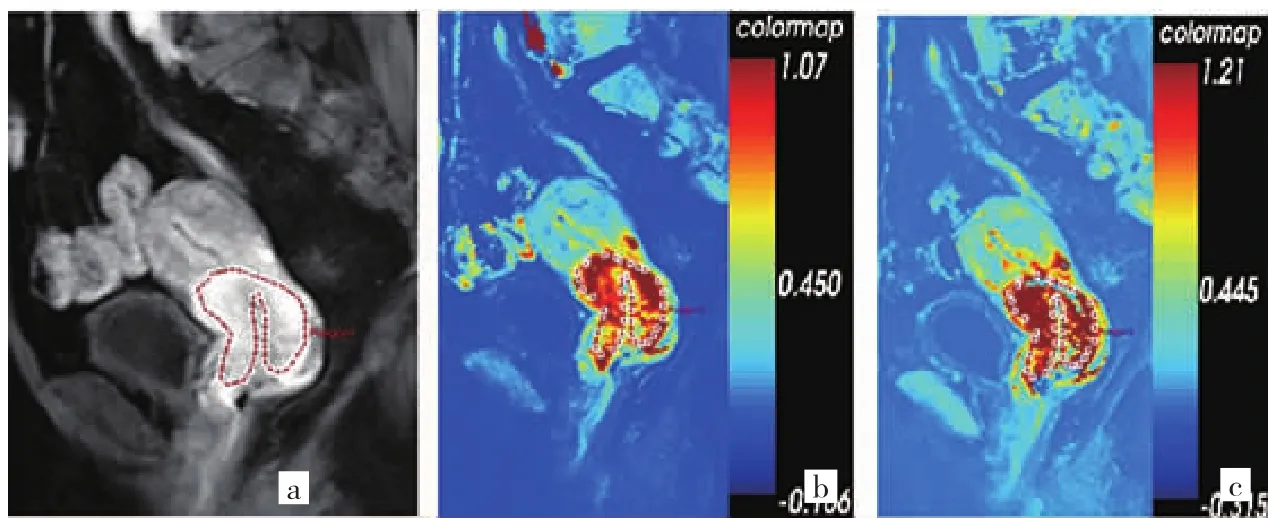
图2 53岁宫颈低分化鳞状细胞癌患者(a:子宫MRI增强图;b:用Extended Tofts模型计算得到的Ktrans伪参数图,Ktrans值为0.976 min-1;c:用Extended Tofts Linear模型计算得到的Ktrans伪参数图,Ktrans值为1.021 min-1)
2.3 高、中、低分化宫颈癌不同模型DCE-MRI定量参数分析结果 在高、低分化组宫颈癌间,Extended Tofts Linear模型和Extended Tofts模型中的Ktrans值差异有统计学意义(P<0.05),高、低分化宫颈癌组间 Kep、Ve、Vp比较差异均无统计学意义(均P>0.05),见表2。而两个模型低分化与中分化、中分化与高分化组之间的Ktrans、Kep、Ve、Vp差异均无统计学意义(均 P >0.05)。Extended Tofts Linear模型中Ktrans鉴别高、低分化宫颈癌的AUC均大于Extended Tofts模型。联合诊断:利用logistic回归分析,求出Extended Tofts Linear模型和Extended Tofts模型Ktrans联合诊断预测概率值,结果显示两个模型联合诊断AUC均大于单个模型,见表3、图3。
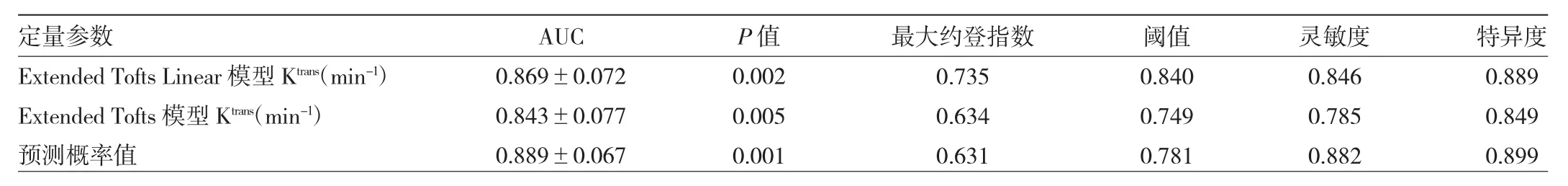
表3 两种不同模型下的DCE-MRI参数对宫颈癌病理分级的效能
3 讨论
DCE-MRI定量分析是主要反映微血管渗透性的功能MRI成像方法,基于血流动力学模型分析、拟合DCE-MRI数据等方法模拟出血管(血浆)内外对比剂的分布情况,从而可直接测量或通过数据拟合获得定量参数[7]。常用的几种模型有双室模型如Extended Tofts模型、Extended Tofts Linear模型、Exchange模型和单室模型如Tofts模型、Patlak模型、Reference Region模型。目前Extended Tofts血流动力学模型较常用于子宫的定量分析[8-9]。

图3 两种模型定量参数Ktrans值及联合诊断鉴别高、低分化宫颈癌的ROC曲线
本研究中,Extended Tofts Linear模型和 Extened Tofts模型中的Ktrans均能鉴别高、低分化宫颈癌,Extended Tofts Linear模型中Ktrans鉴别两组宫颈癌的AUC(0.869)大于 Extened Tofts模型(0.843),说明 Extended Tofts Linear模型对于宫颈癌的病理分级的效能要高于Extended Tofts模型,Extended Tofts Linear模型中的Ktrans诊断灵敏度最高。Extended Tofts Linear和Extended Tofts模型类似,但是在计算中采用了线性方法,因此得到的渗透参数稳定性更高[10]。Ewing等[11]研究表明,模型的非线性特征可能导致不良条件下的估算,影响计算结果的准确性,扩展的Tofts线性模型对这些问题不那么敏感,适用于微血管组织的分析[12]。另有研究表示血流动力学双室模型Extended Tofts Linear具有良好的可重复性,可作为常规渗透处理模型用于临床科研[13]。本研究中,首次将两个模型联合诊断用于鉴别宫颈癌病理分级,诊断效能均优于单个模型,除去操作复杂因素,这种模型联合诊断可以应用于临床指导宫颈癌手术、放化疗方案的制定及预测疗效等。
近年来,DCE-MRI技术逐渐应用于子宫颈癌,有研究表明DCE-MRI定量参数可以区分子宫颈癌组织与正常子宫颈组织,并发现宫颈鳞癌组的Ktrans、Kep、Ve显著高于正常子宫颈组[14],而定量参数在子宫颈癌不同分化程度中是否存在差异的报道较少见。本研究结果表明,高、低分化宫颈癌DCE-MRI定量参数Ktrans差异有统计学意义,Ktrans是对比剂从血管(血浆)间隙渗漏到血管外细胞外间隙转运系数,与组织的血流灌注总量、血管表面积以及血管渗透性相关。Ktrans值升高提示局部血管表面渗透面积大、渗透性高、组织内血流速度加快,对比剂从血液进入肿瘤组织的速度加快、数量增多。Kep是对比剂从血管外细胞外间隙返回血管(血浆)间隙的速率常数,反映血流速度,与血管通透性密切,与组织灌注相关。本研究中虽然高中低分化组间Kep值无统计学差异,但低分化组宫颈癌Ktrans、Kep值较高分化组宫颈癌高,这种差异符合宫颈癌的病理学特征,相比高分化宫颈癌,低分化宫颈癌血管生成密度高、血管成熟度差,因此低分化宫颈癌的渗透性也会更高、组织血流速度加快。有研究显示Ktrans值评价宫颈癌与表皮生长因子(VEGF)、微血管密度(MVD)有良好的相关性[15-16],说明Ktrans值既能反映肿瘤微循环的通透性,也反映了微血管密度和生长速度的改变,进而说明Ktrans值可以用于评价宫颈癌的诊断、鉴别诊断以及治疗疗效。Ve值即血管外细胞外间隙容积分数,反映的是每单位体积组织血管外细胞外间隙的大小,本研究显示Ve值在宫颈癌病理分级中无统计学差异。Ve值在评价肿瘤方面差异较大,部分研究显示Ve可以评估宫颈癌放化疗早期疗效[4,17],部分研究显示没有意义[18]。Tofts[19]认为,Ve值受病变周围水肿影响而导致测量不稳定。Vp反映平均增强血管密度,对灌注血管敏感。部分研究显示,Vp可以提示脊柱骨转移放疗的疗效[20]。本研究显示Ve、Vp在宫颈癌高、中、低分化组间无统计学差异,可能由于研究样本量小,有待进一步大样本研究。
本研究也有一些局限性。第一,纳入研究的病例数相对较少,尤其是中分化宫颈癌病例少,可能对研究结果有一定影响,今后将纳入更多病例进一步研究。第二,定量参数的准确性不仅受血流动力学模型选择的影响,还受到对比剂种类、注射方案,扫描时间分辨率,扫描时间及图像噪声水平的影响。
综上所述,Extended Tofts Linear模型和Extended Tofts模型DCE-MRI得到的定量参数Ktrans在宫颈癌的病理分级中有一定价值,且前者的整体效能优于后者。Extended Tofts Linear模型可能是一种更加适用于宫颈癌DCE-MRI研究的血流动力学模型。同时,两个模型联合用于宫颈癌病理分级的鉴别价值优于单个模型灌注参数的鉴别价值。

