体素内不相干运动扩散加权成像预测脑胶质瘤IDH1基因突变的价值
冯盼盼 王超超 董海波 李亚迪 王洪财 梁良
脑胶质瘤具有高度的侵袭力及增殖能力,是一种发病率高、复发率高、预后差的中枢神经系统恶性肿瘤,仅依赖常规病理分级不能满足临床对脑胶质瘤患者的个性化治疗需求[1-2]。研究认为,高级别脑胶质瘤异柠檬酸脱氢酶-1(isocitrate dehydrogenase-1,IDH1)基因为突变型者其预后明显好于病理分级相同的野生型,甚至也好于低级别野生型,因此,IDH1基因突变可作为脑胶质瘤患者预后相对良好的标志[3-5]。传统的影像形态学分析预测脑胶质瘤IDH1基因突变的价值不大。多数肿瘤组织成像体素内既有扩散也有灌注成分[6]。体素内不相干运动扩散加权成像(IVIM-DWI)可以定量分离扩散和灌注成分,无创地反映肿瘤内部的扩散和灌注信息[7-8]。目前,国内外关于IVIM-DWI预测脑胶质瘤IDH1基因型的研究较少,本研究回顾性分析IDH1突变型与野生型脑胶质瘤患者IVIM-DWI定量参数的差异,探讨其术前预测脑胶质瘤IDH1基因突变的临床应用价值。
1 对象和方法
1.1 对象 回顾分析宁波市医疗中心李惠利医院2016年9月至2020年1月经手术病理证实的55例WHOⅡ~Ⅳ级脑胶质瘤,依据免疫组织化学法检测结果分为IDH1突变组17例和IDH1野生组38例。IDH1突变组男 8例,女 9例,年龄 32~70(48±3)岁。其中星形细胞瘤9例,少突星形细胞瘤3例,少突胶质细胞瘤3例,间变性少突星形细胞瘤1例及间变性星形细胞瘤 1例。IDH1野生组男26例,女12例,年龄25~87(55±2)岁。其中胶质母细胞瘤23例,间变性星形细胞瘤8例,间变性少突星形细胞瘤2例,间变性少突胶质细胞瘤1例及星形细胞瘤4例。纳入标准:(1)MR检查前患者未进行任何治疗;(2)MR检查后2周内手术切除肿瘤,根据WHO 2016分类标准进行病理学诊断;(3)影像资料完整,包括MRI平扫、增强及IVIM-DWI序列。排除标准:(1)术前接受过放疗或化疗;(2)由于头部运动伪影而无法获得MR数据;(3)实体肿瘤成分无法用于分析(<20 mm2)。本研究经本院医学伦理委员会批准,所有患者均签署书面知情同意书。
1.2 方法 采用美国GE Discovery MR750 3.0 T MR扫描仪和头部8通道相控阵线圈(GE Medical Systems)。(1)常规MR平扫:包括横断面液体衰减反转恢复(FLAIR)序列 T1WI,TR 1 850 ms,TE 24 ms,TI 780 ms;基于快速自旋回波(FSE)的刀锋(PROPELLER)序列T2WI:TR 6 656 ms,TE 105 ms。FOV 240 mm×240 mm,矩阵288×224,层厚4 mm,层间距1 mm,扫描层数24层。(2)常规MR增强扫描:注入对比剂钆喷酸葡胺注射液0.2 ml/kg后横断面T1WI序列扫描,参数同平扫序列。(3)IVIM-DWI:采用轴位单次激发自旋平面回波扩散加权成像(SS-EPI-DW),TR 4 500 ms,TE 为最小值,b 值分别设定 0、10、20、30、50、100、150、200、400、800、1 200、2 000、3 000 s/mm2,相应的 NEX 取 2、1、1、1、1、1、1、2、2、3、3、5、6,扫描时间 378 s。FOV240mm×240mm,矩阵 160×160,层厚 4 mm,层间距 1 mm;扫描层数24层。
1.3 图像分析与后处理 图像由美国GE ADW 4.5后处理工作站,Functool MADC软件分析IVIM-DWI,获得伪彩图。由2位神经放射学副主任医师分别沿肿瘤最大实性区域的内边缘采用不规则模型勾画感兴趣区(ROI),结合常规MR图像避开囊性、出血或坏死区域,在同层对侧白质区手动放置一个ROI(约50 mm2),得到肿瘤及对侧白质的表观扩散系数(ADC),使用双指数模型获得真性水分子扩散系数(D)、微循环灌注系数(D*)和灌注分数(f),取平均值。

2 结果
2.1 一致性分析 2位医师测量ADC、D、D*和f值的ICC 分别为 0.935、0.927、0.933和 0.941,一致性良好。2.2IDH1突变组与野生组IVIM-DWI参数比较IDH1突变组ADC、D、f值均高于IDH1野生组(均P<0.05),但D*值在两组中差异无统计学意义(P=0.058)(表1,典型病例见图 1、2,插页)。

表1 IDH1突变组与野生组IVIM-DWI参数的比较

图1 70岁男性左侧额叶间变性少突星形细胞瘤患者,WHOⅢ级,IDH1突变型 [a:T2WI高信号;b:T1WI增强少许不均匀强化;c~f:表观水分子扩散系数(ADC)、真性水分子扩散系数(D)、微循环灌注系数(D*)和灌注分数(f)]
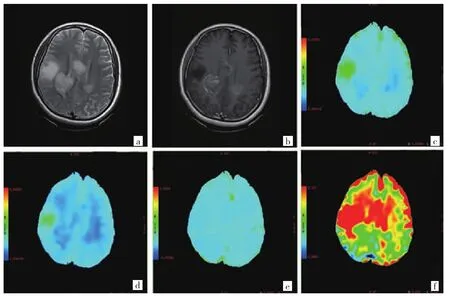
图2 43 岁女性两侧间变性星形细胞瘤患者,WHOⅢ级,IDH1 野生型[a:T2WI高信号;b:T1WI增强不均匀强化;c~f:ADC、D、D* 和 f]
2.3 ROC曲线预测IDH1突变型脑胶质瘤的效能ADC、D、f值的 AUC 分别为 0.793、0.807、0.818,临界值分别为 1.060×10-3mm2/s、0.858×10-3mm2/s、0.282,ADC预测的特异度最高,f的灵敏度最高,D*无显著诊断效能(P=0.057)(表 2,图 3)。

表2 IVIM-DWI定量参数预测脑胶质瘤IDH1基因突变的效能
3 讨论
2016年《WHO中枢神经系统肿瘤分类》颠覆性地改变了脑胶质瘤传统形态学分型方法,第一次以分子分型作为肿瘤分型的核心依据,基因型结合表观型的新分型方法增加了诊断准确性[9-11]。相较于组织学分类,基因分子生物学标志物对确定脑胶质瘤分子亚型和进行个体化治疗及判断临床预后具有重要意义。
IVIM采用双指数模型,从理论上可以将扩散和灌注信息分离,其中,D值和ADC值与水分子扩散相关,f值和D*值与血流灌注相关。众所周知,D值主要反映细胞密度和水分子运动等真实扩散状态。Wang等[6]认为IDH1突变型脑胶质瘤的D值高于野生型,但其研究结果并未达到统计学意义,可能与病例数较小有关。本研究中,IDH1突变型的D值明显高于IDH1野生型,具有统计学意义,鉴别两者的临界值为0.858×10-3mm2/s,AUC为0.807。同时,本研究显示低级别脑胶质瘤的IDH1基因突变率高达78.9%,高级别脑胶质瘤的IDH1基因突变率却仅为5.6%[9-10],而低级别脑胶质瘤的细胞密度和异常增殖能力相对较低[12]。笔者认为,IDH1基因突变型脑胶质瘤的细胞密度较低、异常增殖能力较低,核质比更低,细胞外间隙更大,水分子扩散受限相对较小,故D值较高[13-14]。因此,D值在预测IDH1突变方面有一定价值。

图3 体素内不相干运动扩散加权成像(IVIM-DWI)定量参数鉴别脑胶质瘤IDH1基因突变的ROC曲线
当b值>200 s/mm2,D值与ADC值呈正相关[15]。小样本研究已经提示DWI的最小ADC值可以鉴别IDH1的突变状态[16]。有研究也证实了无论高级别还是低级别脑胶质瘤,IDH1突变型的ADC值均高于IDH1野生型[6]。本研究显示,IDH1突变型的ADC值明显高于野生型,鉴别两者的临界值为1.060×10-3mm2/s,AUC为0.793,预测的特异度最高(0.800)。这表明虽然ADC值包含了一定的灌注信息,但在预测IDH1突变方面仍有一定价值。
IDH1基因突变的脑胶质瘤通过抑制缺氧诱导因子亚单位(HIF-1)的活性途径导致血管生成减少[17]。依据IVIM理论,D*值反映灌注情况,其数值与毛细血管的密度相关。Wang等[6]研究显示仅在高级别脑胶质瘤中,IDH1突变型的D*值较野生型低,而低级别脑胶质瘤中D*值则差异无统计学意义,说明不同级别脑胶质瘤内灌注情况存在差异。本研究中,IDH1突变型脑脑胶质瘤的D*值低于野生型脑胶质瘤,但两组间无统计学差异,除了可能与样变量较少、没有对高低级别脑胶质瘤突变与否的D*值分开研究外,也一定程度提示D*值对预测IDH1基因突变价值不大。Wang等[6]研究表明仅在高级别脑胶质瘤中,IDH1突变型的f值较野生型低,而低级别脑胶质瘤中没有明显差别。本研究中,IDH1突变型脑胶质瘤的f值显著大于IDH1野生型,与Wang等[6]的结论有所差异。笔者认为,与D*值反映毛细血管的密度有所不同,f值是指体素内微循环灌注成分在整个病变组织中的所占比例,由于IDH1突变型脑胶质瘤的细胞增殖程度低、细胞密度相对较小,核质比较低,其扩散成分所占比例相对较低,而微循环灌注成分所占比例相对升高,所以f值升高,而IDH1野生型脑胶质瘤恰好相反[14]。本组中,IDH1突变型脑胶质瘤f值的ROC及灵敏度均最高,表明f值在预测IDH1基因突变方面有重要价值。
IDH1基因突变可改变IDH1与底物亲和力以及代谢的方向,使肿瘤代谢和微观结构发生改变。多项试验表明,IDH1突变可增加肿瘤细胞的放射敏感性[18-19]和化疗敏感性[20-22]。目前的标准治疗方式为手术联合替莫唑胺(TMZ)辅助放化疗等综合治疗。Rohle等[23]研究显示,可穿过血脑屏障的小分子IDH1基因突变特异性抑制剂(AGI-5198)在体内和体外均显示较好的疗效。AGI-5198可反转因IDH1基因突变导致的细胞分化改变并降低 2-羟基戊二酸(2-bydroxyglutarate,2-HG)含量。由于IDH1基因突变改变脑胶质瘤的甲基化谱,对烷化剂化疗药的疗效产生影响[24-25]。因此,IVIM-DWI定量预测脑胶质瘤IDH基因突变不仅可指导临床判断预后,而且有助于治疗方案的选择和靶向药物的研发。本研究也存在一些局限性:首先,病例数较少;其次,研究采用回顾性分析方法,有可能漏掉一些未行IVIMDWI数据采集和分子病理检测的病例;IVIM-DWI的参数选择如不同的b值、TE对结果也有影响;再次,勾画ROI仅为肿瘤增殖活跃区,而未能对肿瘤的异质性进行评价。今后,笔者将采用前瞻性研究方法,纳入不同基因型的脑胶质瘤病例,同时采用“最大值法”、“全瘤分析法”及“瘤周分析法”评价IVIM-DWI对鉴别IDH1基因型的价值。
总之,IVIM-DWI的定量参数ADC、D、f值在术前预测脑胶质瘤IDH1基因突变有重要价值,以f值效能最高。

