鼻咽癌的治疗进展
陈晓钟 黄爽
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种具有明显地域及种族差异的疾病,其中东南亚地区及蒙古人种发病率最高。2018年全球新确诊NPC 129 000例,其中约60 000多例在中国[1]。广东及广西发病率最高,浙江省也是NPC的高发区之一,年发病达3 000例以上,浙江省肿瘤医院年收治1 200例左右。放疗是NPC的主要治疗手段,早期采用单纯放疗,局部晚期采用以放疗为主的综合治疗。随着调强放疗技术的普及和综合治疗的应用,NPC患者的局部控制率达90%以上,5年生存率超过80%[2]。随着生存期的延长,对精准放疗和生活质量的要求显得越来越重要。而高远处失败率的局部晚期和远处转移的NPC成为目前治疗中面临的最大挑战。本院720例NPC调强放疗结果显示,治疗失败的患者中有54.1%为远处转移[3]。此外,约4%~10%的患者初诊时就已出现远处转移,即使接受足疗程的全身治疗,预后仍然较差。随着多种免疫治疗药物的上市和维持治疗的应用,转移性NPC的治疗有了新的选择和治疗模式,疗效也较前提高。本文就放疗、免疫治疗及维持治疗等热点问题对近年来NPC诊疗中的新进展作一述评。
1 放疗
基于光子的放疗技术从常规二维放疗、三维适形发展到可以调控范围和剂量的调强放疗(intensity-modulated radiotherapy,IMRT),精准度得到显著改善。一项纳入3 570例NPC患者的Meta分析发现,调强放疗不仅能够提供更好的局部控制和总生存率,对于放射性颞叶损伤、张口困难等毒副反应发生率也有明显的降低[4]。虽然基于光子的调强放疗仍是目前的主流放疗技术,但近年来质子、碳离子放疗也开始应用于临床。质子、重离子具有独特的Bragg峰,能够将更高剂量集中在肿瘤区域,周围正常组织剂量快速跌落,从而进一步提高疗效和保护正常组织,尤其是应用在局部复发NPC的治疗中。Hu等[5]在2015—2017年用碳离子放疗技术治疗了75例局部复发NPC患者,给予总剂量50~66 GyE(2.0~3.0 GyE/F/d)后1年总生存率为98.1%,局部无复发生存率为86.6%。但值得注意的是该研究中有7例患者(9.3%)发生了黏膜坏死(包括1例致命出血)。虽然质子及碳离子放疗在NPC中具有较好的疗效,但未来仍需要更多的临床数据提供长期的疗效和安全性证据。
尽管放疗技术进步带来了疗效的提高,但放疗成功的关键仍取决于对治疗靶区的精确确定和剂量的准确给予。个体化的精准放疗可以通过功能影像的剂量雕刻实现。剂量雕刻放疗(dose-painting IMRT,DP-IMRT)由Ling等[6]在2000年首先提出的,是指通过功能影像了解肿瘤内部组织分化、代谢等生物学特性的差异,相应地精准调整肿瘤内部剂量给予放疗[7]。此后Chao等[8]发现在头颈部肿瘤的乏氧区域,选择性地提高剂量到80 Gy可以减轻辐射抵抗,达到提高疗效的目的。目前,DPIMRT主要通过18f-氟脱氧葡萄糖正电子发射断层扫描(FDG-PET)和功能性MRI(包括DCE-MRI、DW-MRI、MRS等)等来实现。部分学者在NPC中应用剂量雕刻放疗取得了较好的疗效[9-10]。Liu等[10]收集了213例Ⅲ~Ⅳa期的NPC患者随机进入试验组(PET/CT引导下DPIMRT,101例)和对照组(CT引导下IMRT,112例)。对于T1~2和T3~4的患者,试验组GTV-PET剂量分别提高至DT 75.2 Gy/32 F和77.55 Gy/33 F;而对照组的大体肿瘤区域(PGTV)剂量为 70.4~72.6 Gy/32~33 F。两组的完全缓解(CR)率分别为99%和92.9%(P=0.037),FDG-PET/CT引导的DP-IMRT显著提高了3年的局部无失败生存率(local failure-free survival,LFFS)(98.8%比91.3%,P=0.032)、局部区域无失败生存率(local regional failure-free survival,LRFS)(97.2%比 91.2%,P=0.049)、无远处转移生存率(distant metastasis-free survival,DMFS)(92.9%比 87.4%,P=0.041)和总生存(overall survival,OS)(91.8%比 82.6%,P=0.049),且并未增加毒副反应发生率。2020年ASCO报道的一项前瞻性研究,纳入241例Ⅲ~Ⅳa期NPC患者随机分为A、B组,A组(120例)采用磁共振扩散加权成像(diffusion-weighted magnetic resonance imaging,DWI)引导下的 DP-IMRT,B组(121例)采用常规CT引导的放疗,发现基于DWI的靶区剂量可以增高5 Gy;在24个月的中位随访时间内,A组的2年LRFS(100%比96.4%,P=0.023)、2年 DMFS(97.7%比 90.4%,P=0.004)、2年 DFS(92.8%比86.1%,P=0.005),及 2 年 OS(100%比 96.7%,P=0.005)均显著高于B组。该研究认为,DWI引导的DP-IMRT也是DFS和DMFS的独立预后因素,可以提高局部晚期NPC的疗效且不增加治疗毒性。除了功能MRI及PET/CT外,PET/MR也可以用于DP-IMRT。本院也开展了相关研究,Cao等[11]回顾了21例接受PET-MR检查的NPC患者图像,基于PET/MR,通过聚类分析、深度学习获取的肿瘤代谢相关区域,是NPC放疗剂量雕刻的潜在靶区。目前正在开展大样本的研究。虽然NPC的DPIMRT是非常具有前景的放疗技术,但功能影像的信号强度和治疗剂量之间的依赖关系仍是未知的,还有很多需要解决的有待前瞻性研究来证实。
2 免疫治疗
近年来免疫治疗药物在恶性肿瘤的治疗中取得了突破性进展,抗程序性死亡受体-1(PD-1)免疫治疗已经成为复发转移性头颈鳞癌的标准治疗。对于转移性NPC,虽然吉西他滨联合顺铂(GP)方案已经成为一线治疗选择[12],但治疗疗效仍然欠佳。由于NPC丰富的免疫细胞间质浸润和EBV抗原表达的特性,为免疫治疗提供了良好的治疗靶点。2017年,Keynote-028研究首先报道了帕博利珠单抗在复发转移鼻咽癌(recurrent/metastasis NPC,RM-NPC)中良好的抗肿瘤疗效活性及安全性[13]。此后,多种免疫治疗制剂在转移性NPC中开展了临床研究,包括 NCI-9742[14]、SHR-1210-101[15]等,其研究特点及治疗反应见表1。目前纳入NPC数量最多的Polaris-02研究对190例入组患者采用单药JS001治疗,总反应率(overallresponserate,ORR)为20.5%,疾病控制率(disease control rate,DCR)为 41.6%;中位 OS达17.4个月,达到主要研究终点[16]。其中116例三线及以上治疗的RM-NPC的ORR为21.6%,mDOR高达21.5个月,mOS达15.1个月。4级及5级严重不良事件发生率分别为4.2%和3.7%。基于上述各项临床研究结果,NCCN NPC治疗指南推荐纳武利尤单抗用于复发/转移非角化癌患者,帕博利珠单抗用于程序性死亡受体-1配体(PD-L1)表达阳性的复发/转移患者;而2020 CSCO指南也推荐免疫治疗作为复发转移NPC的二线治疗选择,但以上均为2B类证据,仍需等待上述研究的最终结果公布。
尽管免疫治疗已经成为转移性NPC的治疗新选择,但对于多线治疗失败后的NPC单药治疗的有效率仅20%~30%。因此,多项研究尝试将免疫治疗联合化疗应用于转移性NPC的一线治疗。Fang等[15]卡瑞利珠联合GP方案一线治疗RM-NPC的初期报道中,23例患者ORR高达91%,1年PFS为61%。该研究目前已完成250例入组,结果尚未公布。由于前期抗PD-1抗体良好的抗肿瘤活性和安全性,多项与标准治疗比较的Ⅲ期临床试验均在进行中。Keynote-122(NCT02611960)旨在评估Pembrolizumab单药治疗与研究者选定的最佳方法(包括卡培他滨、吉西他滨或多西他赛)对经治NPC患者的疗效。而另外两个试验(NCT03581786和NCT03924986)拟探索抗PD-1抗体联合GP方案对比标准GP方案的疗效。从部分研究的中期报道推测,免疫治疗联合GP方案化疗是一个具有前景的治疗选择,或可取代GP方案成为新的转移性NPC一线标准方案,但仍需等待最终研究结果提供证据。

表1 目前免疫治疗在NPC中的临床研究汇总
除了抗PD-1单药及联合化疗应用外,多个临床研究也开始探索双药双抗、单药双抗如PD-1与PD-L1、PD-1与CTLA-4等,以及免疫治疗与靶向治疗等组合应用,以期在进一步降低毒性的情况下提高疗效,目前研究均在进行中。这些新的探索将给NPC的后线治疗提供更多新的方向。
3 维持治疗
维持治疗是指一定周期一线治疗后,对至少获得疾病稳定(SD)的患者继续进行特定方案治疗,用药至疾病进展(PD)或不能耐受[17]。传统治疗模式是一线治疗后“观察并等待”,待患者出现PD后再进行二线治疗,此时由于疾病进展导致肿瘤负荷的增加及体能和耐受的下降使部分患者失去了进一步治疗的机会。维持治疗模式则可使更多患者在较好的耐受性及较低的肿瘤负荷状态下接受有效、低毒的持续治疗,延长疾病缓解期,提升疾病控制率。尽管维持治疗已被广泛用于结直肠癌[18]、肺癌[19]等实体肿瘤,但NPC中的应用还缺乏标准。因此部分学者开始探索在标准治疗基础上增加维持治疗的新模式来降低NPC患者的远处失败率,提高无病生存率。
NPC维持治疗常用于两类患者。一类是转移性NPC,尽管GP方案化疗明显改善了转移性NPC的疗效,但中位无进展生存仅有6~10个月,总生存时间仅11~28个月[12]。第二类是高远处转移风险的局部晚期NPC。既往研究中常用的高风险因素主要有:淋巴结>6 cm或伴锁骨上转移,多发淋巴结转移且其中一个≥4 cm,局部晚期伴多发淋巴结;治疗后的EBV-DNA持续阳性等。Cheng等[20]随访了149例局部晚期NPC发现N0~1、N2及 N3亚组 3年 DMFS分别为 92%、84%和 56%(P=0.003)。临床研究中希望通过2~4周期辅助化疗来降低远处转移率,但近年来多个NPC辅助化疗的随机对照研究[16,21]均没有获得预期结果。阴性结果的主要原因可能在于:没有对患者进行筛选分层以及辅助化疗毒性较大,完成率低。
维持治疗通常选用的药物具备有效低毒、简单方便等特点,包括静脉用药,口服用药,靶向及免疫药物维持,可以单独用药或多类药物联合应用。1999年Hong等[22]首次对MAP方案化疗后至少SD的转移性NPC氟尿嘧啶联合亚叶酸钙方案维持至PD,平均维持周期38周,中位PFS和OS为11.6和18.1个月,奠定了氟尿嘧啶类药物维持治疗的基础。2003年Lin等[23]采用顺铂联合5-FU及亚叶酸钙的方案对41例高危NPC患者维持18周;同时选取88例NPC作为观察组。维持与观察组复发率分别为45.5%、71.2%;5年OS为71.6%、28.7%(P<0.0001),维持治疗完成率达88%,远超之前多项Ⅲ期研究中辅助化疗的40%~70%。随着氟尿嘧啶类衍生物的应用,方便、低毒的口服药物被更多人采用。一项关于患者对维持治疗态度的探索性研究显示,口服药物成为患者首选的维持治疗给药模式[24]。因此,为了进一步提高耐受性,2014年Lin等[25]纳入85例放疗后1周EBV-DNA持续阳性的局部晚期NPC,中位随访70个月后,与不维持治疗的患者比较,接受口服优福定维持治疗1年患者的5年OS和MFS明显提高(71.6%比28.7%,P<0.0001;71.9%比 34.6%,P<0.008)。由于 EBV-DNA的监测条件和阈值标准尚未统一,Liu等[26]采用淋巴结大小作为高危标准,入组了403例高危NPC,口服优福定1年对比随访观察,随访72个月,维持组的肿瘤复发明显低于对照组(45.5%比71.2%,P=0.0323);5年OS和MFS明显提高(71.6%比28.7%,P<0.0001和71.9%比 34.6%,P<0.008),毒副反应可耐受。Zhang等[27]对 N3期NPC患者采用S1维持治疗,也获得良好的疗效及耐受。可见,口服氟尿嘧啶衍生物等用于转移性或者高危局部晚期NPC的维持治疗耐受性较好,能明显提高DMFS和OS。但目前研究证据级别不高,仍需前瞻性多中心研究提供更高级别的证据。
除了静脉和口服化疗药物,免疫制剂在单药或联合化疗治疗RM-NPC中也是采用了维持治疗的概念,免疫单药维持至疾病进展或不可耐受。在高危局部晚期NPC治疗中,部分临床试验也开始使用免疫药物进行维持治疗以求降低远处转移率(见表2)。中山大学肿瘤中心的在研临床研究(NCT03427827),拟入组400例高危NPC患者,放化疗后随机接受12周期的PD-1维持或随访观察。另一项Ⅱ~ⅣB期NPC患者放化疗后接受Nivolumab维持11周的研究(NCT03267498)也在进行中,期待未来这些研究结果为免疫制剂在维持治疗中的应用提供新的证据。
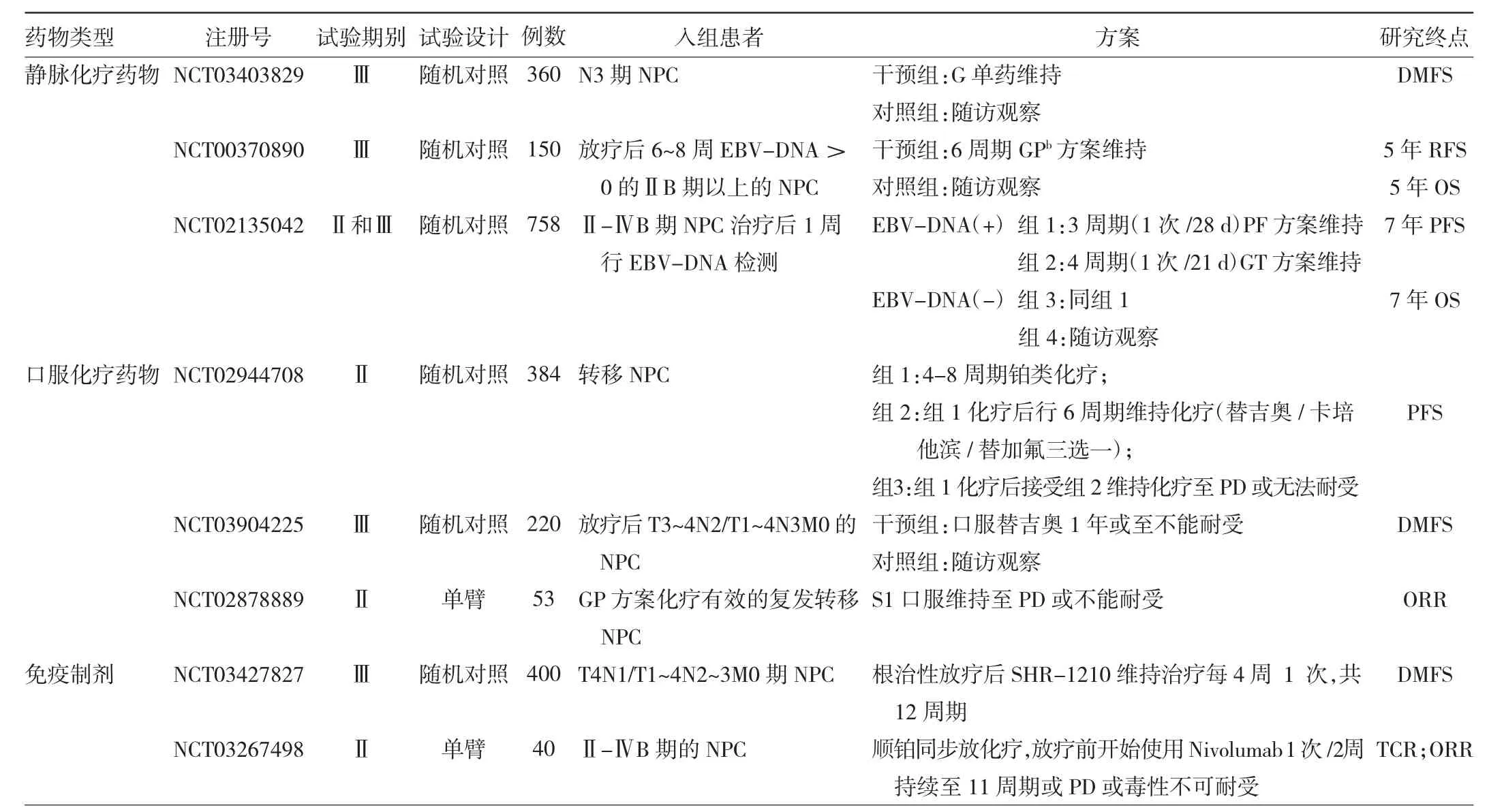
表2 部分注册在研的NPC维持治疗相关临床研究
4 小结与展望
随着放疗技术和设备等进步,NPC的疗效得到了明显提升,放疗逐步进入个体化精准放疗时代。而免疫治疗等新型药物的应用和组合也给转移性和高危局晚期NPC带了新的治疗选择,进一步减少了远处转移的风险。目前多个新药新技术的临床研究仍处在探索时期,但就初步结果来看,这些研究结果势必将改变目前NPC的治疗现状,给临床带来新的治疗格局和治疗标准,也给患者带来新的希望。
(本文由浙江省医学会推荐)

