复方磺胺甲噁唑片人体生物等效性研究
吴蔚,肖珍,张顺芝,曹天然,黄庆,张小敏,鲁萍(长沙市第一医院,长沙 410013)
复方磺胺甲噁唑片属于磺胺类抗菌药物,是磺胺甲噁唑(SMZ)与甲氧苄啶(TMP)的复方制剂,对革兰氏阳性菌、阴性菌均有较好的抗菌作用。SMZ 作用于二氢叶酸合成酶,TMP 作用于叶酸合成代谢,选择性抑制二氢叶酸还原酶,两者合用可使细菌的叶酸代谢受到双重阻断,协同抗菌作用较单药增强,对其耐药的菌株减少[1]。本文旨在研究复方磺胺甲噁唑片在中国健康受试者体内的药动学特征和安全性,并对两种制剂是否生物等效进行评价,为临床用药安全性和有效性提供数据参考[2]。
1 材料
复方磺胺甲噁唑片(受试制剂,规格:含SMZ 0.4 g、TMP 80 mg,批号:2001402,山东新华制药股份有限公司);复方磺胺甲噁唑片(参比制剂,商品名:BACTRIM,规格:含SMZ 0.4 g、TMP 80 mg,批号:7005301,Sun Pharmaceutical Industries Inc);SMZ (批号:100025-201505,纯度:99.6%)、TMP(批号:100031-201606, 纯度:99.8%)对照品(中国食品药品检定研究院);SMZ -d4(SMZ-d4,批号:3147-019A3,纯度:98.9%)和甲氧苄啶-d3(TMP-d3,批号:3066-017B3,纯度:97.2%)对照品(TLC Pharmaceutical Standards)。
LC-20AD 高效液相色谱仪(日本岛津公司);API 4000 质谱系统(AB SCIEX 公司);TGL 16M离心机(长沙英泰仪器有限公司);十万分之一分析天平(赛多利斯SQP/SECURA225D)。
2 方法与结果
2.1 受试者选择
共入组32 名健康志愿者,男性26 例、女性6 例。年龄18 ~36 岁,体质量45.4 ~ 80.7 kg,体质量指数(BMI)19.2 ~24.9 kg·m-2。每个受试者进行两周期试验,洗脱期7 d。试验方案通过长沙市第一医院临床试验伦理委员会的批准,编号:20200331CSSY00101。受试者均签署知情同意书。
入选标准:①年龄≥18周岁,体质量男性≥50 kg,女性≥45 kg,BMI 在19.0 ~26.0 kg·m-2;② 所有受试者经生命体征、心电图及各项实验室检查无异常或为不具有临床意义的异常,无神经系统、心血管系统、内分泌系统、泌尿系统、免疫系统、消化系统、呼吸系统等明确病史。
排除标准:① 既往或目前任何临床严重疾病者或能干扰试验结果的任何其他疾病;② 有药物、食物或其他物质过敏史;③ 试验前14 d 服用任何药物者;④ 试验前30 d 使用干扰药物代谢的药物者;⑤ 嗜烟嗜酒者;⑥ 近3 个月内献血或作为受试者被采样者;⑦ 肌酐清除率≤80 mL·min-2者[3]。
2.2 试验过程
采用随机、开放、自身交叉、双周期、单次给药试验设计。每周期在空腹状态下口服受试制剂或参比制剂1 片。受试者于给药前1 d 入住病房,给药前禁食10 h 以上,药物使用240 mL 温开水送服。给药前、后1 h 禁水。分别于每周期给药前(0 h)及给药后0.25、0.5、0.75、1、1.5、2、2.5、3、3.5、4、5、6、8、12、24、36、48 h 采集静脉血各4 mL 置于肝素钠抗凝采血管中。全血样品采集后60 min 内开始离心,2000 g 离心10 min,2 h 内储存于(-70±10)℃冰箱保存。
2.3 血药浓度的测定
2.3.1 色谱条件 色谱柱:Ultimate UPLC Polar RP(3.0 mm×100 mm,1.8 μm),预柱:ACE 3 μm C182.1 mm GUARD CART,流动相:A 为5 mmol·L-1甲酸铵水溶液,B 为乙腈,洗脱条件:0 ~3 min,40%A[4-5];进样量:2.0 μL;流速:0.4 mL·min-1。
2.3.2 质谱条件 电喷雾离子源;正离子模式;监测离子对:m/z254.2 →m/z156.2(SMZ),m/z258.2 →m/z160.2(内标SMZ-d4),监测离子对:m/z291.1 →m/z123.2(TMP),m/z294.1 →m/z123.1(内标TMP-d3);离子喷雾电压:4500 V;去簇电压:SMZ 78.0 V,SMZ-d4 70.0 V,TMP 115.0 V,TMP-d3 90.0 V;碰撞能量:SMZ 30.0 V,SMZ-d4 17.0 V,TMP 30.0 V,TMP-d3 28.0 V;气帘气:30 psi;离子源温度:450℃。
2.3.3 血浆样品处理 移取血浆样品50 μL 于1.5 mL 深孔96 孔板中,加入内标溶液20 μL,再加入乙腈400 μL,涡旋振荡15 min,离心 15 min(5℃、2480 g),移取上清液 50 μL 于另一洁净96 孔板中,向所有样本加入50%乙腈200 μL,涡旋振荡 3 min,离心 10 min(5℃、2480 g),取上清液2.0 μL 进行分析。
2.3.4 专属性 将空白血浆、加入对照品的血浆样本及受试者服药后血浆样本按“2.3.3”项下方法处理并进样分析,色谱图见图1,表明方法专属性良好。

图1 典型色谱图Fig 1 Typical multiple reaction monitoring chromatograms
2.3.5 标准曲线与定量限 取新配制的标准曲线样本(SMZ:0.50、1.00、2.00、4.00、10.00、20.00、40.00、50.00 μg·mL-1,TMP:0.02、0.05、0.10、0.20、0.40、1.00、1.80、2.00 μg·mL-1)按“2.3.1”项下条件分析,分别以质量浓度为横坐标,各自峰面积与内标峰面积的比值为纵坐标,进行加权回归,权重因子 1/χ2,得标准曲线分别为YSMZ=2.56X-0.003 46,R2=0.9974,YTMP=2.31X- 0.004 12,R2=0.9976。SMZ、TMP 定量限分别为0.5 μg·mL-1、0.02 μg·mL-1。
2.3.6 精密度与回收率 配制低、中、高(SMZ:1.50、5.00、35.00 μg·mL-1,TMP:0.06、0.20、1.50 μg·mL-1)3 个质量浓度的质控样本,每个质量浓度平行制备6 份,连续测定3 个批次,计算日内、日间精密度及回收率。结果SMZ 和TMP 的日内精密度RSD在-3.1%~5.4%,日间精密度RSD在0.060%~3.7%;平均回收率在97.7%~108.3%,对应的RSD均小于5%。
2.3.7 基质效应 分别取 6 个不同批次的空白人血浆,每个批次配制一份,按“2.3.3”项下方法处理后进样分析,结果SMZ 高、中、低质控水平样品的内标归一化的基质效应因子变异分别为0.98%、0.98%、2.00%。TMP 高、中、低质控水平样品的内标归一化的基质效应因子变异分别为2.15%、2.13%、2.17%。内标和待测物均无基质效应。
2.3.8 稳定性 考察全血样品分别在室温放置 0 h 和 27 h,在-20℃冰箱存放17 d,-80℃冰箱中存放33 d,在-20 ℃ 冻融5 次,在-80 ℃冻融5 次,白光室温放置 2 h,在自动进样器(5℃,避光)中放置 81 h 的稳定性。结果SMZ、TMP 质量浓度的RSD均<9.3%,说明血浆样品在上述条件下稳定性。
2.4 统计学处理
使用Phoenix WinNonlin 软件8.2 版本的非房室模型(NCA)计算各受试者的药动学参数Cmax、AUC0~t、AUC0~∞、t1/2、tmax实测值采用非参数Wilcoxon 法进行统计处理。Cmax和AUC经对数转换后进行多因素方差分析(ANOVA)、双单侧t检验和90%置信区间分析,并进行等效性比较,等效区间设定为80.00%~125.00%。
2.5 血药浓度-时间曲线
受试者空腹单次口服磺胺甲噁唑片受试制剂(T)与参比制剂(R)后SMZ 与TMP 的平均血药浓度-时间图见图2。两组健康受试者血药浓度-时间曲线的变化趋势基本一致。
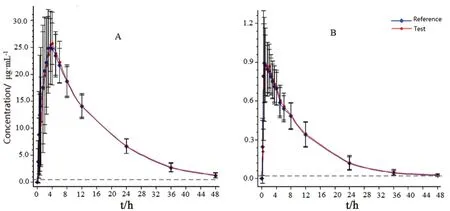
图2 空腹条件下口服复方磺胺甲噁唑片受试制剂(T)与参比制剂(R)后SMZ(A)、TMP(B)的平均血药浓度-时间曲线Fig 2 Mean plasma concentration-time curve of SMZ(A)and TMP(B)after single oral administration of test and reference drugs under fasting
2.6 生物等效性评价
受试制剂/参比制剂中SMZ 的几何均值比为94.97%(91.37%~98.72%),其90%置信区间分别为100.17%(98.34%~102.03%),100.36%(98.41% ~102.35%);TMP 的Cmax、AUC0~t、AUC0~∞为103.34%(96.79%~110.34%),102.49%(99.04%~106.07%),102.02%(98.76%~105.38%)。两者几何均值比的90%CI均落在80.00%~125.00%,表明复方磺胺甲噁唑片受试制剂和参比制剂在空腹给药时具有生物等效性(见表1)。
表1 受试者单次口服复方磺胺甲噁唑片受试制剂和参比制剂后SMZ 和TMP 的主要药动学参数( ±s)Tab 1 Main pharmacokinetic parameters of SMZ and TMP after single oral administration of test or reference drugs of sulfamethoxazole ( ±s)
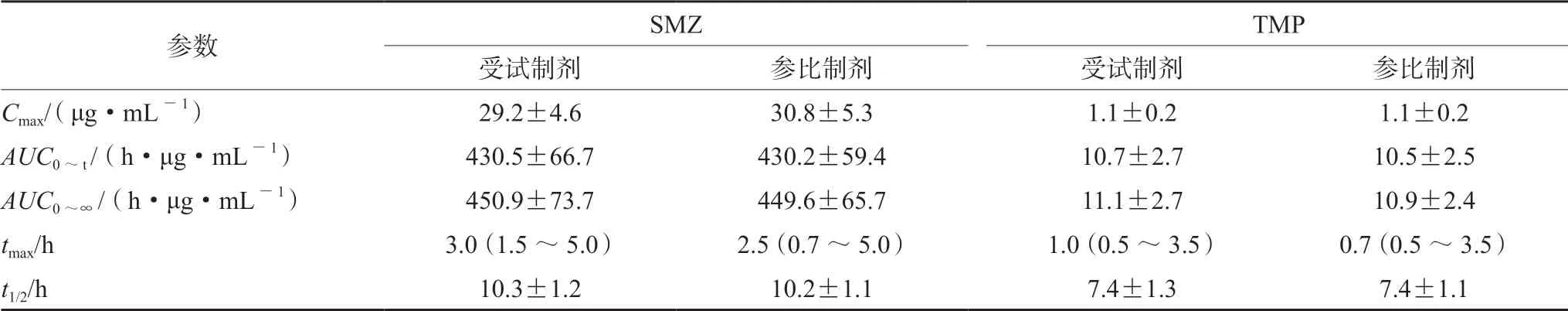
表1 受试者单次口服复方磺胺甲噁唑片受试制剂和参比制剂后SMZ 和TMP 的主要药动学参数( ±s)Tab 1 Main pharmacokinetic parameters of SMZ and TMP after single oral administration of test or reference drugs of sulfamethoxazole ( ±s)
参数SMZTMP受试制剂参比制剂受试制剂参比制剂Cmax/ (μg·mL-1)29.2±4.630.8±5.31.1±0.21.1±0.2 AUC0 ~t /(h·μg·mL-1)430.5±66.7430.2±59.410.7±2.710.5±2.5 AUC0 ~∞/(h·μg·mL-1)450.9±73.7449.6±65.711.1±2.710.9±2.4 tmax/h3.0(1.5 ~5.0)2.5(0.7 ~5.0)1.0(0.5 ~3.5)0.7(0.5 ~3.5)t1/2/h10.3±1.210.2±1.17.4±1.37.4±1.1
2.7 安全性评价
本次试验共有20 例受试者发生30 例次不良事件(含第一周期12 号受试者服药前发生的1 例次不良事件),其中受试制剂共11 例发生17 例次不良事件,参比制剂共9例发生12例次不良事件,除1例严重程度为中度(12号受试者给药前晕针),其余均为轻度,以尿胆红素升高、三酰甘油升高为主。除1 例受试者三酰甘油升高转归为失访外,其他均为恢复。受试制剂和参比制剂不良事件发生情况总体相似,未出现严重不良事件,所有受试者生命体征平稳,对两种药物的耐受性良好。
3 讨论
根据NMPA 发布的《关于可豁免或简化人体生物等效性(BE)试验品种》通告要求,复方磺胺甲噁唑片(SMZ 0.4 g,TMP 80 mg)可豁免餐后生物等效性研究[6]。因此本文仅进行了空腹研究。复方磺胺甲噁唑片口服后迅速吸收,TMP 和SMZ 均在1 ~4 h 达血药峰浓度,且t1/2均为8 ~10 h,故本研究在4 h 前设计了10 个采血点,采血到48 h。
本研究共有3 例受试者脱落:12 号受试者第一周期给药前因为晕针未给药退出研究,20 号受试者在第一周期洗脱期随访抽烟符合入住排除标准脱落,8 号受试者第二周期服药前因血压低退出。31 例受试者纳入全分析集、安全数据集、PK 浓度数据集和PK 参数分析集;31 例受试者纳入BE 分析集。
4 总结
复方磺胺甲噁唑片是治疗和预防卡氏肺孢子菌肺炎最有效的首选药物,也是国内治疗弓形虫感染的首选用药,对国产的该品种进行生物等效性研究确保质量、疗效与原研药一致具有重大意义。根据NMPA 发布的《关于可豁免或简化人体生物等效性(BE)试验品种》通告要求,复方磺胺甲噁唑片(SMZ 0.4 g,TMP 80 mg)可豁免餐后BE 研究[6],因此本文仅进行了空腹研究。
根据既往研究,复方磺胺甲噁唑片口服后迅速吸收,TMP 和SMZ 均在1 ~4 h 达血药峰浓度,且t1/2均为8 ~10 h。故本研究在0 ~4 h 设计了10 个采血点,采血到48 h。复方磺胺甲噁唑过敏反应较为常见[7],本研究在筛选受试者时对本品或其他药物、食物或过敏体质者均进行了排除,给药后4 h 内对受试者进行了重点监护。同时,该品种在用药期间需足量饮水以防结晶尿和结石的形成[8],本研究对受试者饮水也进行了重点管控。
本研究共有3 例受试者脱落:31 例受试者纳入全分析集、安全数据集、PK 浓度数据集和PK参数分析集;31 例受试者纳入BE 分析集。综合以上数据分析,受试制剂和参比制剂在安全性方面未见明显差异,受试制剂和参比制剂在空腹给药时具有生物等效性。

