稻曲病病菌Zn2(Ⅱ)Cys6型转录因子UvZC1基因的克隆及功能分析
俞咪娜,于俊杰,曹慧娟,潘夏艳,宋天巧,刘永锋




摘要:为明确Zn2(Ⅱ)Cys6型转录因子UvZC1在稻曲病病菌中的功能,利用CRISPR-Cas9结合同源片段双交换的方法,诱导野生型菌株Jt209发生UvZC1基因缺失突变。结果显示,与Jt209相比,UvZC1基因缺失突变体的生长速率和分生孢子量均显著下降,且突变体中部分与稻曲病病菌其他产分生孢子相关基因表达量发生变化;此外,该基因的缺失导致突变体对十二烷基硫酸钠(SDS)更敏感,而对氧化胁迫的耐受性增强;在稻曲病病菌接种水稻后24 h、48 h的侵染早期,UvZC1基因的表达量明显上升,但基因缺失突变体接种水稻后形成的稻曲球数量与野生型之间没有差异。综上所述,UvZC1基因参与稻曲病病菌营养生长、分生孢子产生和侵染水稻过程,还与稻曲病病菌细胞壁的完整性和响应氧化胁迫相关。
关键词:稻曲病病菌;Zn2(Ⅱ)Cys6转录因子UvZC1;基因敲除;基因功能;致病性
中图分类号:S511.01文献标识码:A文章编号:1000-4440(2021)06-1400-09
Clone and functional research of Zn2(Ⅱ) Cys6 transcription factor UvZC1 gene in Ustilaginoidea virens
YU Mi-na,YU Jun-jie,CAO Hui-juan,PAN Xia-yan,SONG Tian-qiao,LIU Yong-feng
(Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract:In order to clarify the function of Zn2(Ⅱ) Cys6 transcription factor UvZC1 in Ustilaginoidea virens, gene deletion mutation was carried out by the CRISPR-Cas9-based homologous recombination system. Compared with the wild-type strain Jt209, the growth rate and conidia production of △UvZC1 mutants were significantly decreased, and the expression levels of genes related to the sporulation of U. virens were also changed. In addition, the UvZC1 deletion mutants showed more sensitivity to sodium dodecyl sulfate (SDS), and the tolerance to oxidative stress was enhanced. At the early stage of infection (24 h and 48 h after inoculation), the expression of UvZC1 gene increased significantly. However, no significant difference in the number of rice false smut balls between the wild type and the △UvZC1 mutants was found. Overall, UvZC1 gene has roles in regulating hyphal growth, conidiation, cell wall integrity and oxidative stress response in U. virens. Furthermore, UvZC1 gene is also involved in the infection process of U. virens.
Key words:Ustilaginoidea virens;Zn2(Ⅱ)Cys6 transcription factor UvZC1;gene knocking-out;gene function;pathogenicity
稻曲病(Rice false smut)是由稻曲病病菌[Ustilaginoidea virens (Cooke) Tak.]侵染引起的一种世界性水稻穗部病害,在世界各水稻主产区均有发生。近年来,稻曲病在中国逐渐成为水稻的主要病害之一,年平均发病面积达3.06×106hm2,造成水稻年减产1.586×108 kg,尤其在长江中下游地区,稻曲病重发的水稻种植面积占水稻总种植面积的19%~40%[1]。稻曲病的发生会影响谷粒的营养运输和正常发育,造成空秕率升高、千粒质量下降[2-3];而稻曲球中含有的稻曲菌素更能抑制微管蛋白的组装,并干扰细胞骨架形成,引起人畜病变[4-5]。深入研究稻曲病病菌致病相关基因功能,对解析稻曲病病菌致病机制、选择防治策略具有重要意义。
转录因子是一类调控基因转录起始的重要蛋白质,稻曲病病菌转录因子UvHOX2的基因敲除突变体菌株不产生厚垣孢子,且分生孢子产量下降,致病力减弱[6]。转录因子UvCmo1、UvHog1参与稻曲病病菌响应非生物胁迫、致病等多个重要生物學过程[7-8]。Zn2(Ⅱ)Cys6型转录因子是子囊菌中最大的一类转录因子,其结构中包含1个CX2CX6CX5-12-CX2CX6-8C基序,可以与2个锌离子结合,该类蛋白质只存在于真菌界[9]。Zhang等[10]用稻曲病病菌接种水稻孕穗期的穗部,在转录组水平分析接种的水稻穗部发现,编码Zn2(Ⅱ)Cys6型转录因子1(Ustilaginoidea virens Zn2Cys6 transcription factors 1, KDB18664)的UvZC基因在侵染早期的表达量显著升高,据此推测,该基因与稻曲病病菌侵染相关。目前UvZC1基因在稻曲病病菌中的生物学功能尚不明确,本研究通过分析该基因敲除突变体菌株的表型,对稻曲病病菌中UvZC1基因的功能进行解析,以期为稻曲病病菌致病机制研究提供理论基础。
1材料与方法
1.1供试材料
Jt209菌株分离自2018年从江苏金坛田间采集的稻曲病病株标样,经单孢纯化和测序鉴定为稻曲病病菌后保存[11]。供试水稻品种为稻曲病感病品种两优培九。在田间用Jt209菌株接种两优培九后表现出强致病力。敲除载体pCas9-gRNA由南京农业大学张海峰教授惠赠,回补载体pKO1-Neo由笔者所在实验室保存。稻曲病病菌用马铃薯蔗糖琼脂(PSA)培养基活化和培养,YT培养基用于稻曲病病菌生物学特性的观察分析[8,12]。稻曲病病菌的培养条件为28 ℃、避光。
1.2稻曲病病菌UvZC1基因的克隆与分析
将新活化的Jt209菌株在YT培养液中摇动培养5 d,过滤并收集菌丝。用十六烷基三甲基溴化铵(CTAB)法提取Jt209总基因组;用RNA提取试剂盒(Bioteke,PR1202)提取Jt209总RNA,用反转录试剂盒(TaKaRa,RR047)将RNA反转录成cDNA。参考稻曲病病菌Uv8b菌株的全基因组序列,设计UvZC1基因的全长扩增引物UvZC1 F、UvZC1 R,以Jt209基因组和cDNA为模板,通过PCR扩增分别获得UvZC1基因及cDNA全长序列并测序。将序列在美国国家生物技术信息中心(NCBI)网站上进行BLAST同源比对,用CDART进行基因编码蛋白的结构域分析,用MEGA 7構建系统进化树。
1.3稻曲病病菌UvZC1基因敲除和回补突变体的获得
通过1F/1R引物对、2F/2R引物对对Jt209基因组进行扩增,分别获得964 bp UvZC1基因上游片段和998 bp下游片段;用引物对hyg1.4F/hyg1.4R从质粒pSK044中扩增获得潮霉素抗性基因(HPH)片段,通过多片段重组酶(C113-02)连接获得基因敲除载体pMD19T-HPH-UvZC1。CRISPR载体构建和稻曲病病菌原生质体转化参考Liang等[13]的方法。经潮霉素抗性初筛获得转化子,通过RT-UvZC1 F/RT-UvZC1 R、hyg1.4F/yzR和hyg1.4R/yzF特异性引物对扩增转化子基因组进行再次扩增,并对扩增片段进行测序和序列比对。利用地高辛标记的Southern杂交方法对UvZC1基因敲除突变体菌株的基因组DNA进行分析,Jt209和突变体基因组DNA的提取参照方法1.2进行;探针的制备采用hyg1.4F/hyg1.4R引物对经PCR扩增获得的HPH基因片段;利用Xho I单酶切基因组DNA,按照Roche DIG-High Prime DNA Labeling and Detection Starter Kit I试剂盒的说明书进行Southern杂交,明确UvZC1基因敲除突变体菌株中HPH基因的插入拷贝数。
为了获得基因回补突变体,用引物对CF/CR扩增Jt209基因组,获得包含基因上游1.9 kb的片段、基因全长和基因下游0.5 kb的片段,连接获得回补载体pKO1-Neo-UvZC1,测序正确后,用农杆菌介导的稻曲病病菌转化方法将目的基因转化至UvZC1基因敲除突变体菌株上[11],用遗传霉素G418筛选转化子,再用RT-UvZC1 F/RT-UvZC1 R引物对进行转化子中UvZC1基因表达量的测定,筛选回补菌株。所用引物序列见表1。
1.4稻曲病病菌生物学表型的测定
将稻曲病病菌菌株在PSA培养基上培养15 d后,在菌落生长边缘处取菌碟(直径为5 mm),用于生物学表型的测定。每个菌设3个重复,每个试验重复3次。
1.4.1菌丝生长速率的测定将菌碟接种至YTA培养基上,于28 ℃避光培养12 d后观察菌落形态,测量菌落直径。
1.4.2菌丝对非生物胁迫的响应试验分别将菌碟接种至含0.3 mol/L NaCl、0.3 mol/L KCl、0.8 mol/L D-山梨醇(Sorbitol)、70 μg/ml 刚果红(Congo Red)、0.005% 十二烷基硫酸钠(SDS)和3 mmol/L H2O2的YTA培养基上,28 ℃避光培养12 d后测量菌落直径。
1.4.3分生孢子产生量的测定取菌碟后将其接至含有50 ml YTS培养液的100 ml三角瓶中,每瓶接种5粒菌碟,于28 ℃、160 r/min摇动培养7 d,用血球计数板统计分生孢子数量。
1.5致病力的测定
稻曲病病菌致病力的检测参考张君成等[13]的方法,将摇动培养7 d的培养液作为接种体(分生孢子含量为1 ml 1×106个)。在两优培九孕穗期(破口前5~7 d),用注射器将菌液注入穗苞,每个菌株接种12穗,每穗接种1 ml接种体。接种28 d后调查每穗稻曲球数,重复3次。
1.6UvZC1基因表达的测定
1.6.1分生孢子不同萌发阶段UvZC1基因的表达用单层Miracloth(Calbiochem,La Jolla CA,USA)过滤摇动培养5 d的稻曲病病菌YT培养液,收集分生孢子。分生孢子用无菌水洗涤后,稀释至终含量为1 ml 1×106个,取40 μl孢子液并将其涂布于铺在YTA培养基上的玻璃纸上,于28 ℃避光培养,分别于涂布培养后12 h、18 h、24 h、48 h和72 h取样,以收集的未涂布的分生孢子作为对照。提取样品RNA,用于测定UvZC1基因在孢子不同萌发阶段的表达量,基因的相对表达量通过荧光定量反应(qPCR)分析获得(TaKaRa,RR820)。qPCR反应在QuantStudio 3荧光定量PCR仪(Thermo Fisher)中完成。以α-tubulin-1作为内参基因,基因表达量的计算参照2-△△Ct方法。3次重复。
1.6.2H2O2胁迫下UvZC1基因的表达收集分生孢子,按照终含量为1ml 1×106个接种至YT培养液中,避光摇动培养2 d后,加入终浓度为3 mmol/L的H2O2继续摇动培养,分别于处理后0.5 h、1.0 h收集菌丝,以处理前收集的菌丝为对照。按照方法1.6.1的基因表达量检测方法分析菌丝用H2O2处理后的UvZC1基因表达情况。
1.6.3接种水稻后侵染初期UvZC1基因的表达参照方法1.5用Jt209菌株接种两优培九,分别于接种后24 h、48 h取接种的稻穗,以接种前收集的菌丝为对照。参照方法1.6.1提取接种稻穗的RNA,用荧光定量方法分析UvZC1在2个侵染时间点的表达情况。
1.7其他产分生孢子相关基因在UvZC1基因敲除突变体菌株中表达量的测定
各取5粒Jt209和UvZC1敲除突变体菌碟,分别接种至含有50 ml YTS培养液的100 ml三角瓶中,28 ℃、160 r/min避光摇动培养5 d后,收集菌丝用于RNA提取。按照1.6.1的方法分析其他产分生孢子相关基因在UvZC1基因敲除突变体菌株中的表达情况。每个反应设3个重复,同时本试验重复3次。被检测的其他产分生孢子相关基因及其引物见表2。
2结果与分析
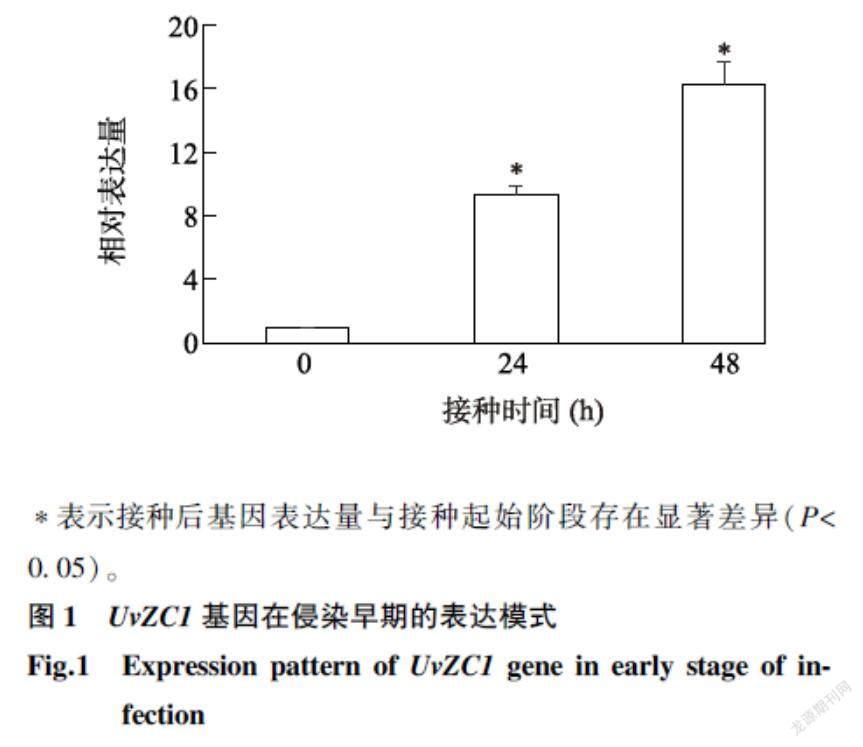
2.1UvZC1基因在稻曲病病菌侵染早期的表达模式
由图1可以看出,UvZC1基因在Jt209接种两优培九24 h和48 h后均有表达,且基因表达量在接种后随着接种时间的延长显著上升,接种24 h、48 h时分别为接种起始阶段的9.1倍、16.2倍,表明该基因参与稻曲病病菌早期侵染水稻的过程。
2.2稻曲病病菌UvZC1基因的克隆与序列分析
序列分析结果显示,UvZC1基因全長1 458 bp,不含内含子,编码485个氨基酸。UvZC1的预测编码蛋白质含有1个GAL4(smart00066)基序和1个Fungal_TF_MHR(cl23766)基序,与其他Zn(Ⅱ)2Cys6型转录因子相似。蛋白质同源性比较结果显示,UvZC1与金龟子绿僵菌(Metarhizium anisopliae)、大孢绿僵菌(Metarhizium majus)等子囊菌的Zn(Ⅱ)2Cys6型转录因子的相似度超过65%,与其他丝状真菌Zn(Ⅱ)2Cys6蛋白的相似度也为50%左右(图2)。因此确定UvZC1基因编码的蛋白质属于Zn(Ⅱ)2Cys6型转录因子。
A:UvZC1与其他真菌中Zn(Ⅱ)2Cys6转录因子(括号内数值表示UvZC1与其他蛋白质同源比较的identity值)的系统发育树分析;B:UvZC1与其他真菌中Zn(Ⅱ)2Cys6转录因子的蛋白质结构分析。
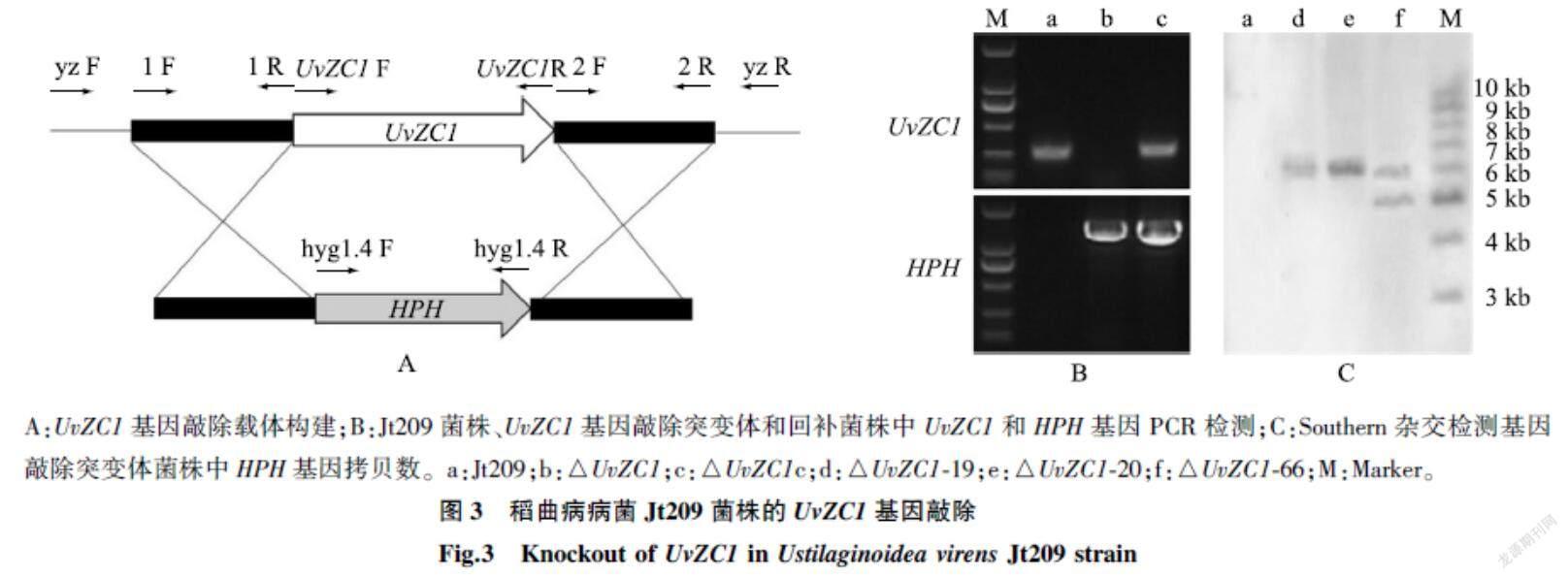
2.3UvZC1基因敲除和回补突变体的获得
以野生型菌株Jt209为对照,经抗性筛选、特异性引物PCR鉴定和Southern杂交分析,共获得2个基因敲除突变体菌株(△UvZC1-19和△UvZC1-20)。再以敲除突变体菌株△UvZC1-19为初始菌株,回补UvZC1基因,获得2个基因回补菌株(UvZC1 c-1和UvZC1 c-2)。用RT-UvZC1 F/RT-UvZC1 R扩增Jt209、敲除突变体和回补菌株的cDNA,发现UvZC1在Jt209和回补菌株中表达,而在敲除突变体菌株中不表达。用HPH基因特异性引物hyg1.4 R/hyg1.4 F只能从敲除突变体和回补菌株的基因组中扩增到目的片段,而在Jt209基因组中不能扩增到目的片段(图3)。上述结果表明,敲除突变体菌株中的UvZC1基因已经被潮霉素抗性基因成功替换,回补菌株中的UvZC1基因得到了回补。
A:UvZC1基因敲除载体构建;B:Jt209菌株、UvZC1基因敲除突变体和回补菌株中UvZC1和HPH基因PCR检测;C:Southern杂交检测基因敲除突变体菌株中HPH基因拷贝数。a:Jt209;b:△UvZC1;c:△UvZC1c;d:△UvZC1-19;e:△UvZC1-20;f:△UvZC1-66;M:Marker。
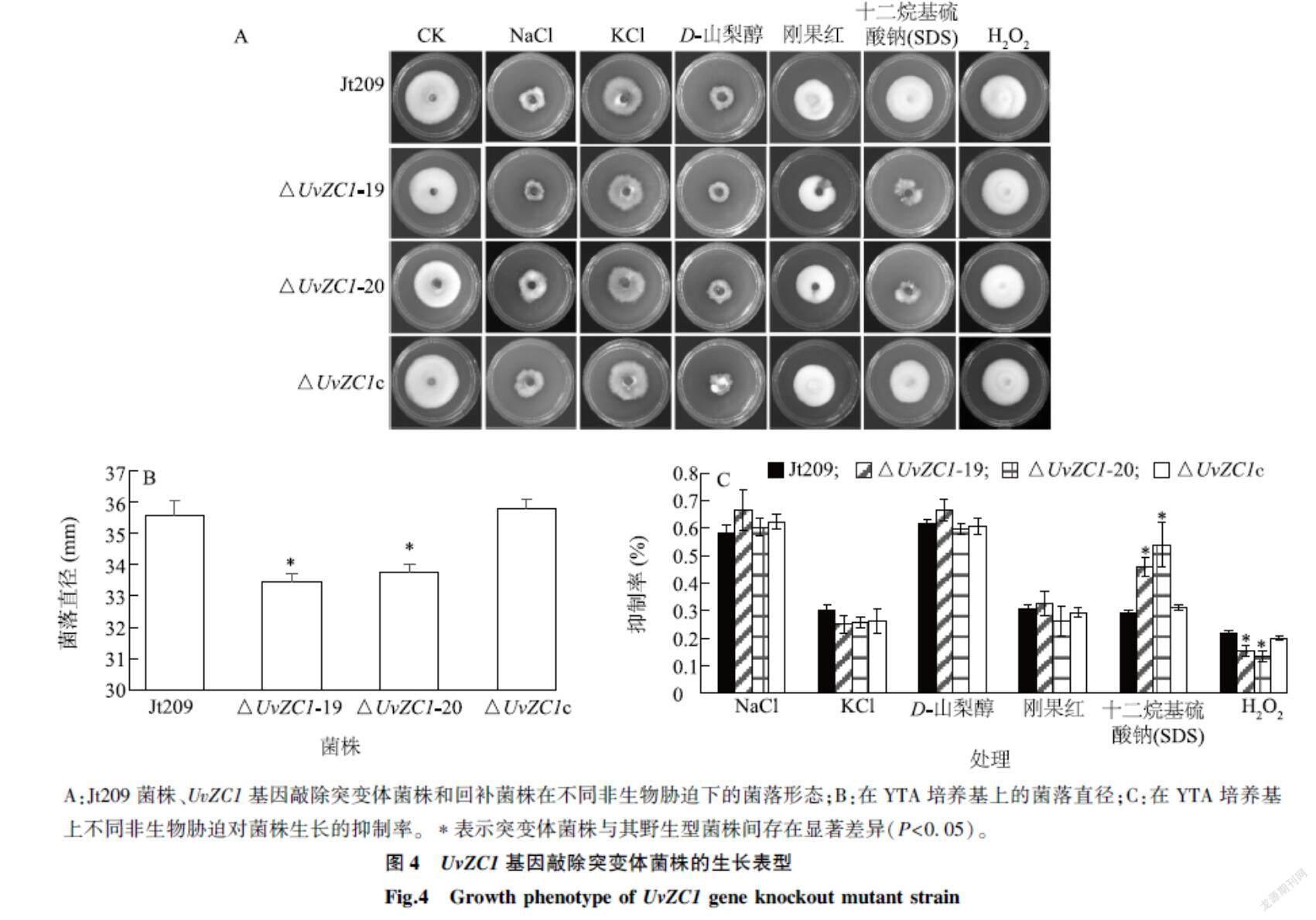
2.4UvZC1基因对稻曲病病菌生长的影响
由图4A、图4B可以看出,在YTA培养基上,△UvZC1-19、△UvZC1-20的菌落直径分别为(33.44±0.25) mm、(33.75±0.27) mm,与Jt209的(35.55±0.46) mm和回补菌株的(35.77±0.32) mm相比显著下降,但各菌落间的形态没有明显差异,表明UvZC1基因敲除会影响稻曲病病菌的生长速率,但不影响菌落形态。
由图4C可以看出,在0.3 mol/L NaCl、0.3 mol/L KCl、0.8 mol/L D-山梨醇和70 μg/ml 刚果红等非生物胁迫下,Jt209、UvZC1基因敲除突变体菌株和回补菌株在生长抑制效果上没有显著差异,然而0.005% SDS对UvZC1基因敲除突变体菌株的抑制率明显高于Jt209菌株和回补菌株,表明UvZC1基因参与调节稻曲病病菌细胞壁的完整性。
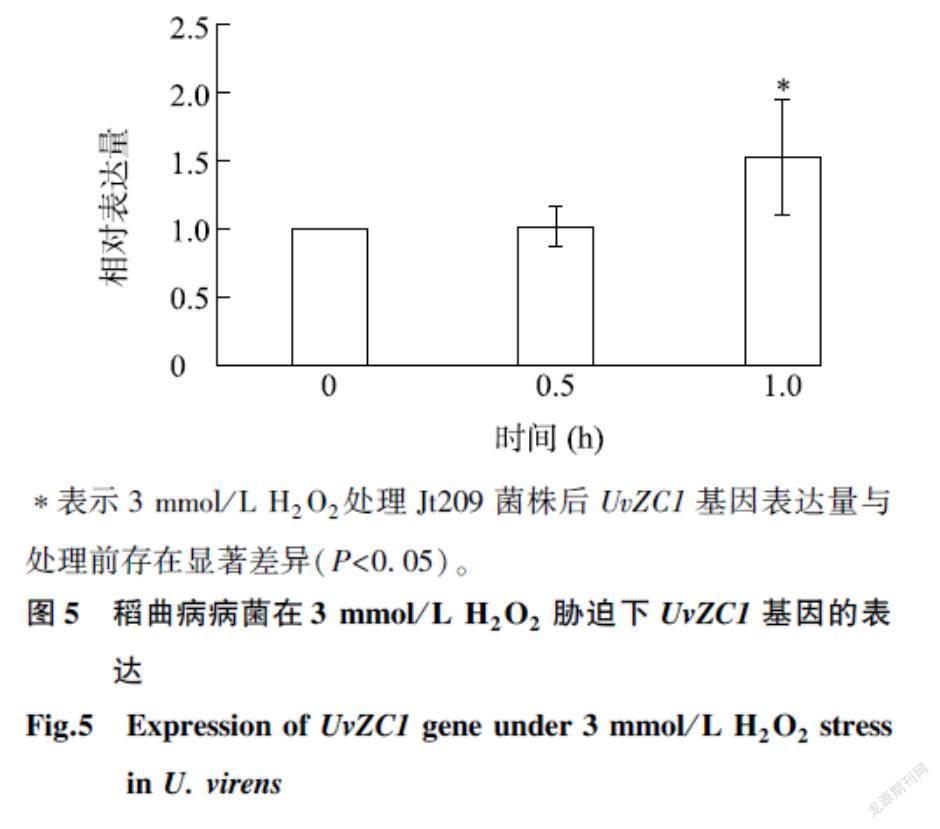
2.5UvZC1基因对稻曲病病菌响应氧化胁迫的影响
分析Jt209、UvZC1基因敲除突变体菌株和回补菌株在含3 mmol/L H2O2培养基上的生长抑制率发现,UvZC1基因敲除突变体对氧化胁迫的耐受性高于Jt209菌株和回补菌株(图4A、图4C);而Jt209菌株中UvZC1基因的表达量在3 mmol/L H2O2处理1.0 h时显著上升(图5),表明UvZC1可能参与调控稻曲病病菌响应氧化胁迫的过程。
2.6UvZC1基因对稻曲病病菌产分生孢子的影响
由图6A可以看出,Jt209、UvZC1基因敲除突变体菌株和回补菌株摇动培养产生的分生孢子在形态、大小、萌发率等方面没有显著差异,但UvZC1基因敲除突变体菌株△UvZC1-19和△UvZC1-20产分生孢子数量较Jt209分别减少91.1%和89.4%。
由图6B可以看出,进一步分析UvZC1在稻曲病病菌分生孢子萌发和菌丝生长、分生孢子产生等不同阶段的基因表达情况发现,UvZC1在孢子萌发产生芽管及芽管伸长(萌发时间18 h)、菌丝伸长(萌发时间24 h)阶段的表达量与分生孢子时期没有显著差异;随着萌发的菌丝顶端新分生孢子的产生(萌发时间48 h、72 h),UvZC1相对表达量与分生孢子时期相比逐渐上升,表明UvZC1参与了稻曲病病菌产分生孢子的过程。
此外,检测已报道的稻曲病病菌产分生孢子其他相关基因的表达量发现,与Jt209相比,UvZC1基因敲除突变体菌株中UvAC1、UvSLT2基因的相对表达量显著上升,UvCDC2、UvCom1和UvHog1基因的相对表达量显著下降,UvBI-1基因的相对表达量变化不显著(图6C)。上述结果表明,UvZC1可能通过调节稻曲病病菌多个产分子孢子相关基因,从而参与调控稻曲病病菌分生孢子的产生。
A:Jt209菌株、UvZC1基因敲除突变体菌株和回补菌株在不同非生物胁迫下的菌落形态;B:在YTA培养基上的菌落直径;C:在YTA培养基上不同非生物胁迫对菌株生长的抑制率。
2.7UvZC1基因对稻曲病病菌致病性的影响
田间接种试验结果显示,Jt209、UvZC1基因敲除突变体菌株和回补菌株在接种稻穗上产生的稻曲球数量无显著差异,稻曲球形态也无明显差异(图7),表明UvZC1基因不影响稻曲球的产生。
3讨论
本研究从稻曲病病菌中克隆到UvZC1基因,其编码蛋白质与其他真菌中的Zn(Ⅱ)2Cys6型转录因子在序列和结构域上有很高的相似性,均具有包含6个半胱氨酸的GAL4基序,可以结合2个锌离子,表明UvZC1蛋白是典型的Zn(Ⅱ)2Cys6型转录因子[9]。Zn(Ⅱ)2Cys6转录因子为仅存于真菌中的锌簇蛋白,在酿酒酵母(Saccharomyces cerevisiae)中,含Zn(Ⅱ)2Cys6基序的Moc3蛋白可以与其他蛋白质互作,参与调控酵母有性生殖和DNA完整性[17-18]。在丝状真菌中,这类蛋白质参与真菌菌丝生长、产分生孢子、致病力及对不良环境的响应等过程,具有多种调节功能,但在不同真菌中的功能存在差异[19-24]。
A:不同菌株的产孢量;B:UvZC1基因在分生孢子不同萌发阶段的表达量;C:UvZC1基因敲除突变体菌株中稻曲病病菌其他产分生孢子相关基因表达量。*表示在突变体菌株与野生型菌株间存在显著差异(P<0.05)。
A:接种后稻穗产稻曲球症状;B:每穗平均稻曲球数。
稻曲病病菌UvZC1基因敲除突变体菌株与野生型菌株相比,菌丝生长速度减慢,产分生孢子量减少,表明UvZC1基因参与了稻曲病病菌生长和产分生孢子过程。真菌产分生孢子是多基因参与的过程,在稻曲病病菌中,已有报道显示,编码腺苷酸环化酶(UvAc1)、蛋白激酶(UvSLT2和UvCDC2)、转录因子(UvCOM1和UvHOG1)、效应因子(UvBI-1)等蛋白质的基因敲除均导致稻曲病病菌的产分生孢子量下降[7-8,13-14,16]。本研究发现,UvZC1基因正调控基因UvAc1和UvSLT2的表达,负调控基因UvCDC2、UvCom1和UvHog1的表达,可见稻曲病病菌产分生孢子也是多基因参与的过程,UvZC1作为转录因子参与调节多个稻曲病病菌产分生孢子相关基因的表达。此外,UvZC1基因敲除突变体菌株对由NaCl、KCl和Sorbitol等引起的盐胁迫和渗透压胁迫的响应与野生型没有显著差异,表明UvZC1不参与调节稻曲病病菌对盐胁迫和渗透压胁迫的响应[11]。刚果红通过阻止细胞壁葡聚糖链之间的横向作用来影响细胞壁的完整性,而SDS能使细胞壁变脆弱,从而裂解细胞。UvZC1基因敲除突变体菌株对SDS的耐受性降低,表明UvZC1参与调控稻曲病病菌细胞壁的完整性,但不影响稻曲病病菌细胞壁葡聚糖链之间的互作。
病原菌侵染寄主植物时会诱导其产生一系列防卫反应来抵御病原菌的侵染[25-26],活性氧是侵染早期寄主的重要防卫反应物质之一[27]。本研究中,H2O2可以誘导稻曲病病菌UvZC1基因的表达,同时UvZC1敲除突变体菌株对H2O2的耐受性较野生型增强,表明UvZC1蛋白参与稻曲病病菌响应氧化胁迫的过程。通过检测侵染阶段UvZC1基因的表达量发现,UvZC1基因表达量在接种后24 h和48 h即侵染早期显著上升。然而Jt209、UvZC1敲除突变体菌株和回补菌株在水稻上产生的稻曲球数量和形态没有明显差异,说明该基因不影响稻曲病病菌稻曲球的产生。可能由于从稻曲病病菌基因组中已经预测到90多个C6转录因子[1],它们之间存在功能冗余现象,即在UvZC1缺失时,稻曲病病菌的其他C6转录因子基因能够部分替代UvZC1行使功能,导致最终表现为致病力无明显改变[28-29]。综上所述,UvZC1参与了稻曲病病菌生长、分生孢子产生、响应氧化胁迫和细胞壁完整性建成、侵染水稻等过程,这对认识稻曲病病菌Zn(Ⅱ)2Cys6型转录因子功能具有重要意义。
参考文献:
[1]SUN W X, FAN J, FANG A F, et al. Ustilaginoidea virens: insights into an emerging rice pathogen[J]. Annual Review of Phytopathology, 2020, 58: 363-385.
[2]FAN J, YANG J, WANG Y Q, et al. Current understanding on Villosiclava virens, a unique flower-infecting fungus causing rice false smut disease[J]. Molecular Plant Pathology, 2016, 17(9): 1321-1330.
[3]李小娟,刘二明,肖启明,等. 水稻对稻曲病抗性的分级及相应级别的产量损失[J]. 湖南农业大学学报(自然科学版),2011, 37(3):275-279.
[4]MENG J J, GU G, DANG P Q, et al. Sorbicillinoids from the fungus Ustilaginoidea virens and their phytotoxic, cytotoxic, and antimicrobial activities[J]. Frontiers in Chemistry, 2019, 7: 435.
[5]LI Y J, WANG M, LIU Z H, et al. Towards understanding the biosynthetic pathway for ustilaginoidin mycotoxins in Ustilaginoidea virens[J]. Environmental Microbiology, 2019, 21(8): 2629-2643.
[6]YU J J, YU M N, SONG T Q, et al. A homeobox transcription factor UvHOX2 regulates chlamydospore formation, conidiogenesis, and pathogenicity in Ustilaginoidea virens[J]. Frontiers in Microbiology, 2019, 10: 1071.
[7]CHEN X, HAI D, TANG J, et al. UvCom1 is an important regulator required for development and infection in the rice false smut fungus Ustilaginoidea virens[J]. Phytopathology, 2020, 110(2): 483-493.
[8]ZHENG D W, WANG Y, HAN Y, et al. UvHOG1 is important for hyphal growth and stress responses in the rice false smut fungus Ustilaginoidea virens[J]. Scientific Reports, 2016, 6: 24824.
[9]MACPHERSON S, LAROCHELLE M, TURCOTTE B. A fungal family of transcriptional regulators: the zinc cluster proteins[J]. Microbiology and Molecular Biology Reviews, 2006, 70(3):583-604.
[10]ZHANG Y, ZHANG K, FANG A, et al. Specific adaptation of Ustilaginoidea virens in occupying host florets revealed by comparative and functional genomics[J]. Nature Communications, 2014, 5: 3849.
[11]YU M N, YU J J, HU J K, et al. Identification of pathogenicity-related genes in the rice pathogen Ustilaginoidea virens through random insertional mutagenesis[J]. Fungal Genetics and Biology, 2015, 76: 10-19.
[12]张君成,陈志谊,张炳欣,等. 稻曲病的接种技术研究[J]. 植物病理學报, 2004, 34(5): 463-467.
[13]LIANG Y F, HAN Y, WANG C F, et al. Targeted deletion of the USTA and UvSLT2 genes efficiently in Ustilaginoidea virens with the CRISPR-Cas9 system[J]. Frontiers in Plant Science, 2018, 9: 699.
[14]GUO W W, GAO Y X, YU Z M, et al. The adenylate cyclase UvAc1 and phosphodiesterase UvPdeH control the intracellular cAMP level, development, and pathogenicity of the rice false smut fungus Ustilaginoidea virens[J]. Fungal Genetics and Biology, 2019, 129: 65-73.
[15]TANG J T, BAI J, CHEN X Y, et al. Two protein kinases UvPmk1 and UvCDC2 with significant functions in conidiation, stress response and pathogenicity of rice false smut fungus Ustilaginoidea virens[J]. Current Genetics, 2020, 66(10): 409-420.
[16]XIE S L, WANG Y F, WEI W, et al. The Bax inhibitor UvBI-1, a negative regulator of mycelial growth and conidiation, mediates stress response and is critical for pathogenicity of the rice false smut fungus Ustilaginoidea virens[J]. Current Genetics, 2019, 65(5): 1185-1197.
[17]GOLDAR M M, JEONG H T, TANAKA K, et al. Moc3, a novel Zn finger type protein involved in sexual development, ascus formation, and stress response of Schizosaccharomyces pombe[J]. Current Genetics, 2005, 48(6): 345-355.
[18]CAMPBELL R N, LEVERNTZ M K, RYAN L A, et al. Metabolic control of transcription: paradigms and lessons from Schizosaccharomyces cerevisiae[J]. Biochemical Journal, 2008, 414(2): 177-187.
[19]LU J P, CAO H J, ZHANG L L, et al. Systematic analysis of Zn2Cys6 transcription factors required for development and pathogenicity by high-throughput gene knockout in the rice blast fungus[J]. PLoS Pathogens, 2014, 10(10): e1004432.
[20]HAGIWARA D, MIURA D, SHIMIZU K, et al. A novel Zn2Cys6 transcription factor AtrR plays a key role in an azole resistance mechanism of Aspergillus fumigatus by co-regulating cyp51A and cdr1B expressions[J]. PLoS Pathogens, 2016, 13(1): e1006096.
[21]SON H, SEO Y S, MIN K, et al. A phenome-based functional analysis of transcription factors in the cereal head blight fungus Fusarium graminearum[J]. PLoS Pathogens, 2011, 7(10): e1002310.
[22]LONG N B, ORASCH T, ZHANG S Z, et al. The Zn2Cys6-type transcription factor LeuB cross-links regulation of leucine biosynthesis and iron acquisition in Aspergillus fumigatus[J]. PLoS Genetics, 2018, 14(10): e1007762.
[23]ZHAO C Z, WAALWIJK C, DE WIT P J G M, et al. EBR1, a novel Zn2Cys6 transcription factor, affects virulence and apical dominance of the hyphal tip in Fusarium graminearum[J]. Molecular Plant-Microbe Interactions, 2011, 24(12):1407-1418.
[24]GARG A, GOLDGUR Y, SCHWER B, et al. Distinctive structural basis for DNA recognition by the fission yeast Zn2Cys6 transcription factor Pho7 and its role in phosphate homeostasis[J]. Nucleic Acids Research, 2018, 46(21): 11262-11273.
[25]羅丽芬,江冰冰,邓琳梅,等. 三七根系分泌物中几种成分对根腐病原菌生长的影响[J].南方农业学报,2020,51(12):2952-2961.
[26]刘一贤,蔡志英,施玉萍,等. 辣木果腐病病原菌兰生炭疽菌(Colletotrichum chlorophyti)生物学特性及其防治药剂室内毒力测定[J].江苏农业科学,2019,47(20):133-137.
[27]RHEE S G. H2O2, a necessary evil for cell signaling[J]. Science, 2006, 312(5782): 1882-1883.
[28]WAGNER A. Genetic redundancy caused by gene duplications and its evolution in networks of transcriptional regulators [J]. Biological Cybernetics, 1996, 74(6):557-567.
[29]WAGNER A. Redundant gene functions and natural selection[J]. Journal of Evolutionary Biology, 1999, 12(1):2646-2658.
(责任编辑:徐艳)
收稿日期:2021-02-18
基金项目:江苏省自然科学基金项目(BK20180296);国家自然科学基金项目(31401700)
作者简介:俞咪娜(1985-),女,浙江杭州人,硕士,副研究员,主要研究方向为水稻真菌病害致病机制等。(E-mail)zjpsyu@163.com
通讯作者:刘永锋,(E-mail)liuyf@jaas.ac.cn

