水稻白化转绿突变体al14的表型分析及基因定位
胡婷婷,何弯弯,王友霜,王健康,丁成伟,郭荣良,吴玉玲,赵轶鹏

摘要:本研究从徐稻3号群体中获得1个可稳定遗传的白化转绿自然突变体al14,与野生型相比,突变体al14出苗后白化,三叶期后转绿,白化叶的叶绿素含量显著降低。整个生育期除抽穗期和株高外,其他农艺性状和野生型无显著差异。经透射电镜观察,白化叶片中大部分叶绿体发育异常,类囊体膜数量变少,片层结构松散;遗传分析结果表明,该白化转绿突变性状由1对隐形核基因控制。利用突变体al14/9311的F2群体中白化表现明显个体精细定位,最终将突变基因al14定位到第1染色体短臂标记al14-3和al14-10之间,物理距离为100.5 kb。测序发现突变体在该区间内编码线粒体底物ADP/ATP转运子的基因Os01g0265200终止密码子前插入了18 bp碱基,编码氨基酸发生改变。结合叶绿体发育、叶绿素合成等相关基因的实时荧光定量PCR结果和表型,推测该基因可能调控幼苗叶绿体发育。
关键词:水稻;白化转绿突变体;叶绿体发育;线粒体ADP/ATP转运子
中图分类号:S511文献标识码:A文章编号:1000-4440(2021)06-1361-09
Phenotypic analysis and gene mapping of a green-revertible albino mutant al14 in rice
HU Ting-ting,HE Wan-wan,WANG You-shuang,WANG Jian-kang,DING Cheng-wei,GUO Rong-liang,WU Yu-ling,ZHAO Yi-peng
(Xuzhou Institute of Agricultural Sciences of the Xuhuai District of Jiangsu Province, Xuzhou 221121, China)
Abstract:In this study, a green-revertible albino mutant al14 was obtained from Xudao 3 population. Compared with wild type, mutant al14 exhibited albinotic leaves at seedling stage and the leaves gradually turned green after three-leaf stage, and the chlorophyll content of albinotic leaves decreased significantly. Except plant height and heading date, there was no significant difference in other agronomic traits between wild type and al14 mutant. With a transmission electron microscopy, defective chloroplasts with less thylakoid were observed in albinotic leaves of al14 mutant, and the lamellar structure was loose. The results of genetic analysis indicated that the phenotype of a114 was controlled by a pair of recessive nuclear gene. The gene al14 was mapped to a 100.5 kb region between the InDel markers al14-3 and al14-10 on chromosome 1. The gene Os01g0265200 encoding mitochondrial ADP/ATP transporter was identified as a candidate gene based on a 18 bp insertion in the front of termination codon, this insertion resulted in altered transcription. Combined with the results of real-time fluorescence quantitative PCR and phenotype of genes associated with chloroplast development and chlorophyll biosynthesis, it is speculated that al14 may be the key gene for regulating chloroplast development at early seedling stage.
Key words:rice;green-revertible albino mutant;chloroplast development;mitochondrial ADP/ATP transporter
綠色植物有机物的合成、能量的转化和储存主要通过叶绿体的光合作用来实现[1]。叶色变异大多伴随叶绿体的发育异常、叶绿素合成分解代谢紊乱,影响生物产量。水稻中的叶色突变大部分为无意义的突变[2],突变后生物量降低,生育期延迟,性状退化,品质和产量也未能得到提升[3]。但是,随着功能基因组学和生物信息学的发展,叶色突变体为研究植物的叶绿体发育[4]、光合作用[5]、核质信号转导[6]、光形态建成[7]等提供了优异材料,同时叶色突变体容易被识别,也可用于作物的新品种选育[8-10]。
水稻的白化突变多在苗期就可识别,根据对生长发育的影响,可分为白化转绿和白化致死2种类型,其来源十分广泛,人工诱变、组织培养和自发突变均可产生白化突变。目前水稻中已有大量白化突变体被报道,这些材料的发现推动了植物的光合作用和核、质功能基因组等方面的研究。已有研究结果表明,白化转绿突变体v1、v2、v3、st1和tsv都对温度敏感,V1编码RNA结合蛋白NUS1,冷胁迫条件下该蛋白质积累增多,调节叶绿体RNA的转录,并在早期叶绿体发育过程中促进质体遗传系统的建立[11]。V2编码鸟苷酸激酶,参与叶绿体分化通路中的质核信号转导或(和)质体翻译,低温下质体翻译被严重抑制[12];V3和ST1分别编码核糖核酸还原酶的大亚基、小亚基,基因突变后,核糖核酸还原酶的活性下降,叶绿体DNA复制受损,低温下尤其显著[13]。低温下,TSV通过和PEP转录复合物亚基OsTrxZ互作,保护幼苗早期叶绿体发育[14]。alr是一个白叶矮化突变体,基因ALR编码1个dCMP脱氨酶(OsDCD),参与并维持细胞中的DNA损伤修复并调控细胞周期[15]。naal1是1个窄叶白化突变体,NAAL1可调节H3K4和H3K27的甲基化并参与调节叶片形态发生,此外该基因参与植物生长素合成、转运及信号传导[16]。asl2、alm1和las1均为幼苗白化死亡突变体,其叶绿体发育都存在缺陷。ASL2编码叶绿体50S核糖体蛋白,该蛋白质对水稻叶绿体的发育至关重要[17],ALM1编码1个铁超氧化物歧化酶,和TSV一样,也能与OsTrxz互作形成复合物,参与叶绿体的合成,影响植物的光合作用[18];LAS1突变后影响叶绿体基因的编辑效率,编码的LAS1蛋白能在体内与MORF蛋白互作,影响叶绿体核糖体的发育,在叶绿体的发育中起着极为重要的作用[19]。除了这些幼苗白化突变体外,还有一些特殊的白化突变体被鉴别,如持续阴雨天下使植株由绿苗转白的突变体abci8,该突变基因OsABCI8/OsABCI7编码1个保守的ATP结合盒转运蛋白,参与水稻中铁等过渡金属元素的转运、叶绿体发育与叶绿素合成[20],同时能调节细胞内活性氧稳态,维持类囊体膜的完整与稳定[21];wltt是1个使植株移栽后叶色转白条纹的突变体,移栽后新生叶片中的大部分叶肉细胞不含叶绿体,色素含量显著降低,光合速率下降[22]。
本实验室从徐稻3号的群体中发现1株能稳定遗传的自然突变体al14,al14出苗后白化,三叶期后转绿,整个生育期除抽穗期和株高外,其他农艺性状和野生型相比无显著差异。遗传分析结果表明,该白化转绿突变性状由1对隐形核基因控制。通过精细定位将控制白化转绿性状基因al14定位到第1染色体标记al14-3和al14-10之间,物理距离为100.5 kb,测序发现突变体该区间内编码线粒体ADP/ATP转运子基因Os01g0265200发生了插入突变,导致编码的氨基酸发生改变。荧光实时定量PCR分析结果表明,该基因的突变影响了叶绿体发育、光合系统形成相关基因的表达。这些结果为进一步开展叶色标记育种和高光效分子育种提供了理论依据。
1材料与方法
1.1试验材料与田间试验
al14来源于徐稻3号群体的1个自然突变,经过连续多代自交,al14的白化转绿表型在江苏和海南都能稳定遗传。野生型和突变体正季种植于徐州现代农业试验示范基地,5月上旬播种,四叶期移栽,单本栽插, 移栽密度25 cm×15 cm,设置3个重复,每个重复种植80株。分别在出苗后3 d、6 d、12 d观察表型并测定色素含量。成熟期分别调查野生型和突变体中长势一致的30个单株,调查其株高、有效穗、千粒质量、结实率、穗长等农艺形状,取平均值,利用统计软件SPSS进行t检验分析。
1.2色素含量测定
分别取出苗后6 d、12 d、18 d长势一致的野生型和突变体完全展开叶,参照Wu等[23]的方法测定叶片单位鲜质量的色素含量:取新鲜叶片去掉两端和中脉,剪碎,称量约0.01克样品,加入5毫升95%的乙醇提取色素,避光浸提24~48 h,期间多次摇晃 至叶片色素完全析出,12 000 r/min下离心5 min,取上清液用分光光度计测定665 nm、649 nm和470 nm下的吸光值,计算色素含量,5次重复。
1.3叶绿体超微结构观察
取出苗后8 d的野生型和al14相同部位长宽约为1~2 mm的叶片,抽真空固定于戊二醛溶液(体积分数为2.5%,pH为7.2)中6 h,磷酸缓冲液冲洗后在1%的锇酸中固定4 h,随后用体积分数梯度为30%~80%的乙醇溶液脱水,包埋、聚合。修块、切片及醋酸铀染色后置于透射电镜下观察叶绿体超微结构。
1.4总RNA的提取及Real-time PCR
用RNA提取试剂盒(货号DP432,天根生化科技有限公司产品)提取出苗后8 d的野生型和突變体叶片的总RNA。反转录采用大连宝生物公司的反转录试剂盒(PrimeScript Reverse Transcriptase kit)进行,内参基因为Actin1(Os03g0729800)。PCR反应体系为20.0 μl:1.6 μl cDNA,10.0 μl SYBR Premix Ex Taq II (2×),正反引物各0.8 μl (10 μmol/L),6.8 μl ddH2O补齐。反应仪器为ABI PRISM 7900HT,参考Livak等[24]的方法分析Real-time PCR试验结果。3次重复。
1.5突变性状的遗传分析和遗传群体构建
配制al14和徐稻3号的正反交组合,F2群体种植于徐州现代农业试验示范基地,出苗8 d后分别统计F2群体中正常表型和白化表型单株数,计算分离比,进行卡方测验和遗传分析。
配制al14和9311杂交组合,单株收种。正季种植F2群体,出苗后8 d标记白化表型明显的个体,三叶一心时提取DNA进行基因初定位和精细定位。
1.6突变基因定位
采用CTAB(十六烷基三甲基溴化铵)法提取DNA。挑出覆盖全基因组且多态性良好、均匀分布在水稻12条染色体上的InDel标记148对,用F2白化表现明显个体进行连锁分析和基因精细定位。参照Shi等[25] 的方法进行PCR扩增,8%聚丙烯酰胺凝胶电泳检测扩增产物,银染显色,拍照读取结果。用10个F2白化表现明显个体筛选全部为al14带型的分子标记确定连锁位点,用92个白化表现明显单株验证该位置。增加定位群体,在包含目标基因的区间内设计多态性标记进行精细定位。根据http://ricevarmap.ncpgr.cn/提供的9311和日本晴间的Indel差异位点及引物设计工具开发引物,比对结合位点,筛选多态性后用于精细定位。
2结果与分析
2.1突变体al14的表型
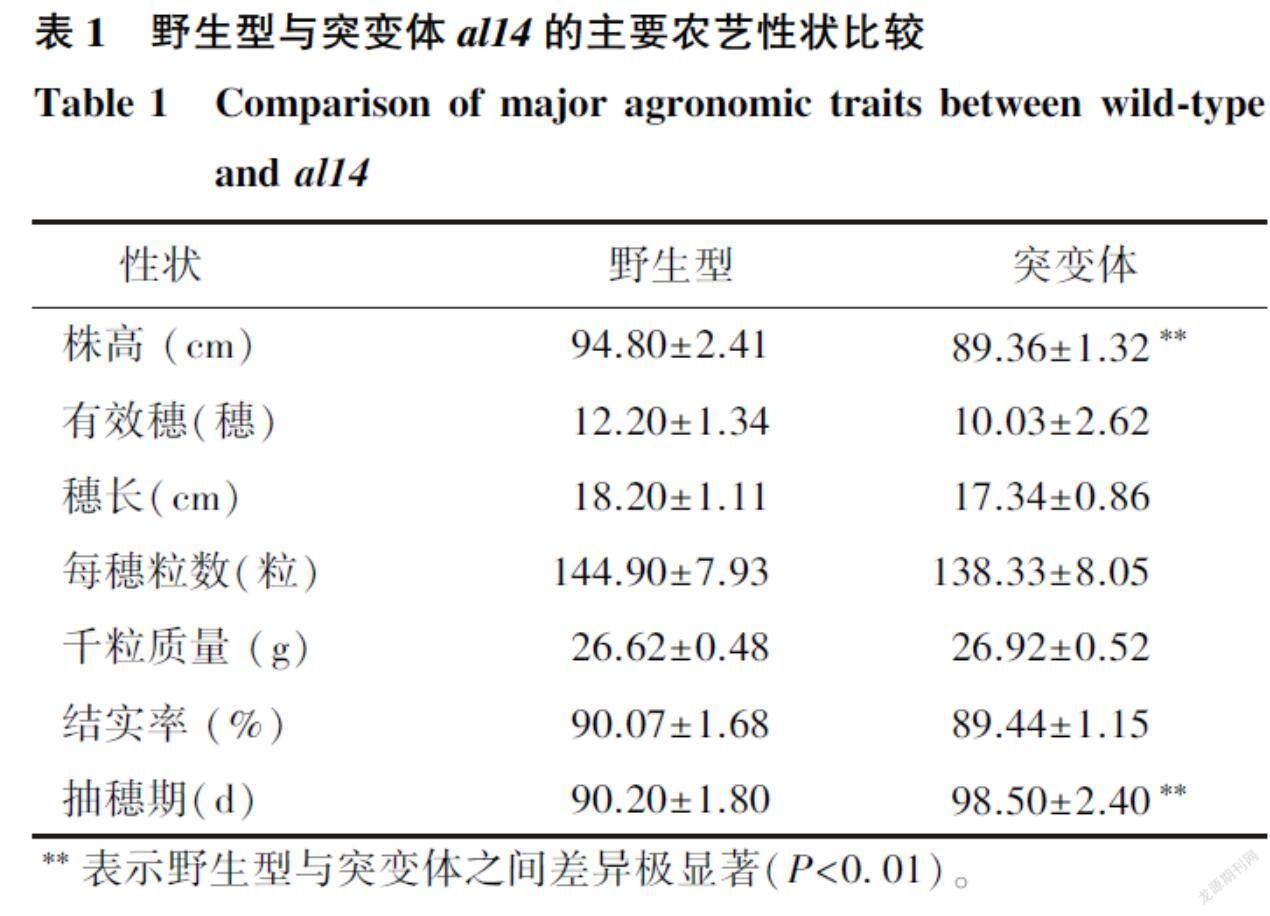
al14是1个自然突变体,与野生型相比,突变体在出苗后就出现白化表型,三叶期后逐渐转绿(图1)。除白化表型外,抽穗前突变体生長发育和野生型基本一致,但抽穗后整体发育迟缓,al14的株高极显著降低,抽穗期偏迟,有效穗数、穗长、每穗粒数、千粒质量与野生型相比无明显变化(表1)。
A:出苗后3 d;B:出苗后6 d;C:出苗后12 d;D:成熟期。
2.2野生型徐稻3号和突变体al14的色素含量
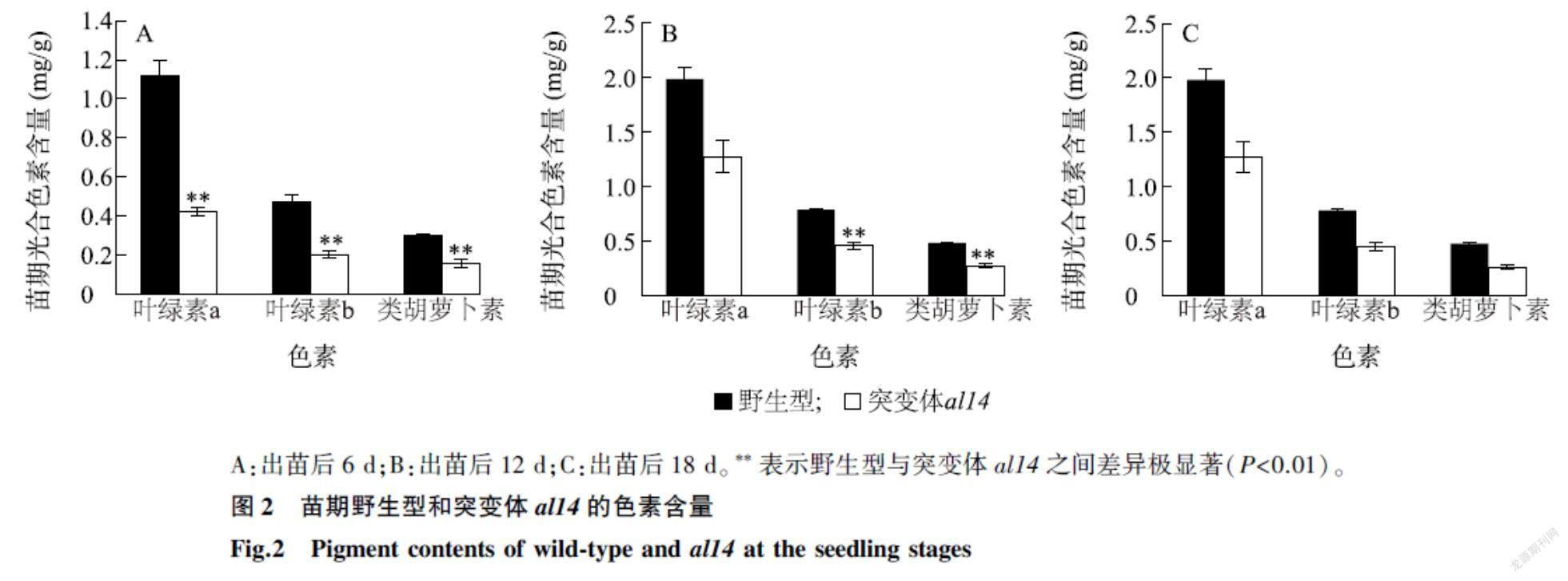
研究结果表明,色素含量的改变会引起叶片颜色的改变,为了进一步验证,我们分别测定了出苗后6 d、12 d和18 d野生型和突变体新出叶片的色素含量。结果表明,与野生型相比,出苗后6 d、12 d,突变体al14叶片中的叶绿素a、叶绿素b和类胡萝卜素的含量都极显著降低 (图2A、图2B);出苗后18 d,突变体al14的叶片完全转绿,转绿后的色素含量与野生型无显著差异(图2C)。这表明色素含量的改变导致了突变体al14的白化表型。
A:出苗后6 d;B:出苗后12 d;C:出苗后18 d。**表示野生型与突变体al14之间差异极显著(P<0.01)。
2.3叶绿体超微结构
类嚢体膜是叶绿素合成的场所,为进一步探明突变体al14在亚细胞水平上的叶绿体发育情况,明确叶片白化形成的原因,我们观察了野生型和突变体al14出苗后8 d和18 d新出叶片叶绿体的超微结构。结果表明,野生型的叶绿体结构完整,类囊体膜数量丰富,片层结构堆积规则,且致密清晰;叶绿体也含有连续闭合完整膜(图3A、图3B)。突变体al14白化叶片中,极少数细胞中的叶绿体正常发育,但大部分细胞中的叶绿体出现不连续的空泡状结构,内容物混沌,类囊体膜数量变少,片层结构松散,叶绿体双层膜结构发育不全(图3C、图3D)。转绿后突变体al14的叶绿体结构恢复正常,基粒片层结构丰富,排列有序(图3E、图3F)。
2.4突变体al14中叶绿素合成途径相关基因的表达
白化叶片中,色素含量发生了变化,因此我们利用实时荧光定量技术分析了叶绿素合成途径相关基因的表达水平。与野生型相比,突变体中的HEMA(编码谷氨酸-tRNA还原酶)、CHLM(编码镁离子原卟啉Ⅸ甲基转移酶)表达量极显著下调(图4),CHLH(编码镁螯合酶H亚基)、CHLG(编码叶绿素合成酶)表达量极显著上调;HEMB(编码5-氨基酮戊酸脱水酶)、HEMC(编码原脱氨酶)、HEME(编码尿卟啉原Ⅲ脱羧酶)、CAO(编码叶绿素a氧化酶)以及CHLI(编码螯合酶I亚基)的表达量无显著差异。
2.5突变体al14中光合系统和叶绿体发育相关途径基因的表达
叶绿体发育异常往往会改变绿色植物光合系统和叶绿体发育相关途径基因的表达,为探明突变体al14早期的白化叶片中相关基因的表达量是否发生了改变,我们利用qRT-PCR分析了相关基因的表达(图5)。结果显示,突变体al14中编码光系统Ⅰ、光系统Ⅱ蛋白质复合物的psaA、psaB、psbA,以及编码捕光叶绿素a/b结合基因Cab2的表达量均极显著低于野生型;但编码NADH脱氢酶的基因ndhB和ndhD以及编码转运RNA聚合酶的基因rpoB的表达量没有明显变化。
A、B:野生型出苗后8 d叶绿体超微结构;C、D:突变体al14出苗后8 d叶绿体超微结构;E、F :转绿后al14叶绿体超微结构。A、C标尺为2 μm,B标尺为1 μm,D、E图标尺为500 nm, 图F标尺为200 nm。
HEMA:谷氨酸-tRNA还原酶基因;HEMB:5-氨基酮戊酸脱水酶基因;HEMC:原脱氨酶基因;HEME:尿卟啉原Ⅲ脱羧酶基因;CHLI:螯合酶I亚基基因;CHLD:镁离子螯合酶D亚基基因;CHLM:镁离子原卟啉Ⅸ甲基转移酶基因;CHLH:镁螯合酶H亚基基因;CHLG:叶绿素合成酶基因;CAO:叶绿素a氧化酶基因。**表示同一基因表达量野生型与突变体al14之间差异显著(P<0.01)。
psaA:编码光系统Ⅰ(PSⅠ)合成亚基的基因;psaB:编码光系统Ⅰ(PSⅠ) 合成亚基的基因;psbA:编码光系统Ⅱ(PSⅡ)核心复合物的基因;ndhB:编码NADH脱氢酶ndh家族的基因;ndhD:编码NADH脱氢酶ndh家族的基因;rpoB:编码转运RNA聚合酶rpo家族的基因;rpoA:编码RNA聚合酶rpo家族的基因;Cab2:编码捕光叶绿素a/b结合蛋白的基因;Cab1:编码捕光叶绿素a/b结合蛋白的基因。**表示野生型与突变体al14之间差异极显著(P<0.01);*表示野生型与突变体al14之间差异显著(P<0.05)。
2.6突变性状的遗传分析
为了确定突变性状的遗传特征,我们配制了徐稻3号和突变体al14的正反交组合。F1植株叶色正常,自交获得的F2群体出现分离,正常的绿色植株与白化转绿植株数比值符合3∶1的分离比(表2)。这表明突变体al14的白化转绿表型由1对隐性核基因控制。
2.7突变性状的基因定位
将突变体al14与9311杂交,自交一代后种植F2群体,分离出的1 845个白化转绿单株作为定位群体。通过连锁分析和增加极端个体验证,基因初步定位在第1号染色体上在分子标记I1-4与I1-5之间 (图6A)。开发新引物(表3)进一步精细定位,基因最终被定位在标记al14-3和al14-10之间,两者距离为100.5 kb (图6B、图6C)。利用RAP-DB数据库预测区间内的基因,此区间内含有9个候选基因(表4)。
2.8候选基因测序
设计引物,扩增标记al14-3和al14-10区间内所有基因的基因组序列,发现突变体编码线粒体底物ADP/ATP转运子的基因Os01g0265200终止密码子前插入了18 bp的碱基,序列为GTCGACGGATCCAATCTC,编码缬氨酸、天冬氨酸、甘氨酸、丝氨酸、天冬氨酸、亮氨酸6个氨基酸,终止密码子也由TAA变为TAG(图6)。分别将野生型和突变体al14中的al14编码的蛋白质氨基酸序列输入swissmodel (http://swissmodel.expasy.org/workspace) 網站预测蛋白质的3D结构模型和保守结构域,结果显示,AL14蛋白包含1个线粒体ADP/ATP转运子结构域,保守氨基酸位置为第104~362位。该基因是OsPAPST1的1个新的等位基因,该基因的突变导致了突变体al14的白化转绿表型。
3讨论
水稻中编码线粒体底物ADP/ATP转运子的基因Os01g0265200全基因组长3 905 bp,CDS长1 146 bp, 编码381个氨基酸,包含有1个线粒体ADP/ATP转运子保守结构域。本试验精细定位到的al14和前人报道的OsPAPST1是等位基因,编码3′-磷酸腺苷5′-磷酰硫酸转运蛋白(PAPST1),但突变体来源和突变位点不同。突变体papst1来源于日本晴(Nipponbare) 的EMS诱变,该基因在第289位碱基出现1个点突变,G变为A,导致氨基酸也由第97位的丙氨酸(Ala)变成苏氨酸(Thr)[6];突变体al14来源于徐稻3号的自然突变,终止密码子前插入了18个碱基,终止密码子也由TAA变为TAG。OsPAPST1和al14的突变都改变了氨基酸序列,2个突变体均表现出早期白化转绿,株高显著降低的表型。突变体papst1整个生育期植株均比野生型矮,突变体al14表现为抽穗后植株生长缓慢,生育期延迟,但有效穗数,穗长、每穗粒数、千粒质量、结实率与野生型无显著差异。
植物的光合作用离不开叶绿体[26-28],突变体al14白化叶中的叶绿体发育存在缺陷,类囊体膜片层结构变少,出现不连续的空泡状结构,双层膜结构发育不全,转绿前色素含量显著低于野生型。以往研究的白化突变体大多也呈现叶绿体发育缺陷表型[15,17-19,22],但是程度不同,突变体wltt中大部分叶肉细胞中观察不到叶绿体,突变体al14白化叶片中的叶绿体结构异常,而突变体alr中叶绿体数量变少,即使叶片转绿依然有少量很小、不完全发育的叶绿体[15],突变体al14叶片转绿后叶绿体结构恢复正常。
RT-PCR结果显示,突变体al14中叶绿体发育和光系统相关基因psaA、psaB、psbA、rpoA、Cab1和Cab2的表达量都显著下调。rpoA、rpoB是叶绿体内编码RNA聚合酶核心亚基的基因,RNA聚合酶参与mRNA转录,rpo+突变体植株色素含量降低,类囊体发育缺陷,植株白化[29],推测由于OsPAPST1/al14基因的突变导致rpoA、rpoB等编码光合系统、叶绿体发育部分的基因表达量下调,引起叶绿体发育缺陷。已有研究结果表明,叶绿体发育受核质基因组协同调控,当质体发育和代谢状态发生改变的时候,质体基因组反馈调节细胞核基因的转录和翻译[30-31]。wsl2是1个苗早期叶片呈现白条纹,五叶期后转绿的突变体,与突变体al14相似,叶绿体发育异常,一些与叶绿素合成、叶绿体发育和光合系统有关的基因在mRNA水平上显著下降。突变体wsl2中质核逆行信号受阻,突变基因编码MCF家族的ATP转运蛋白OsBT1-3在调节叶绿体发育中起重要作用[30]。黄绿叶突变体ygl8中,叶绿体形态异常,发育迟缓,基质中出现嗜锇体,YGL8编码MgPME环化酶的催化亚基,该基因突变后,部分参与叶绿素合成基因的表达量发生改变,也被认为是影响了叶绿体中质-核的逆行信号[31],从而引起叶色突变的原因。PAPST1同时定位于线粒体外膜和叶绿体外膜,研究认为PAPST1更多的充当了PAPS转运子的功能,在质核之间起到逆行信号的作用[6]。本研究中也发现编码Mg2+螯合酶H亚基的基因CHLH表达量显著上调,该基因与ChlD和OsChlI在水稻中分别编码Mg2+螯合酶的H、D和I亚基[32-33],共同催化Mg-原卟啉IX的形成,而原卟啉IX作为血红素生物合成的中间产物影响着四吡咯的生物合成。当四吡咯代谢平衡被打破后,叶绿素合成速率也会发生改变,引起叶色变化[34]。推测OsPAPST1/al14突变后,白化苗中叶绿素合成代谢紊乱导致部分前体物质含量发生改变,产生质-核的逆行信号,改变相关核基因的表达,使叶绿体尽可能地适应叶绿素代谢的缺陷[35]。但是al14突变位点不在其保守结构域,编码多肽的C端增加了6个氨基酸,这几个氨基酸是否改变了PAPST1的构象,怎样影响了其作为3′-磷酸腺苷5′-磷酰硫酸(PAPS)转运蛋白的功能,同时是否也承担了ADP/ATP的转运功能,并在该调控网络中如何起作用,还需要通过挖掘互作蛋白,进一步进行功能验证。另外,突变体al14是一个稳定且易于鉴别的常规粳稻叶色突变体,怎样将该叶色标记导入到不育系中,根据叶色差异不育系自交种,鉴定杂种的纯度,节省劳力,提高产量,也需要进一步实践。
参考文献:
[1]MORITA R, SATO Y, MASUDA Y, et al. Defect innon-yellow coloring 3, an a/b hydrolase-fold family protein, causes a stay-green phenotype during leaf senescence in rice.[J] Plant Journal, 2009, 59: 940-952.
[2]何冰,刘玲珑,张文伟,等. 植物叶色突变体[J]. 植物生理學通讯. 2006,42(1):1-9.
[3]王中豪,贺彦,张晓波,等. 水稻白化转绿和穗顶端退化突变体vpa1的遗传分析和基因定位[J]. 中国水稻科学, 2021, 35(1): 19-26.
[4]TAKEUCHI R, KIMURA S, SAOTOME A, et al. Biochemical properties of a plastidial DNA polymerase of rice[J]. Plant Molecular Biology,2007, 64(5): 601-611.
[5]DOGRA V, DUAN J, LEE K P, et al. Impaired PSII proteostasis triggers a UPR-like response in the var2 mutant of Arabidopsis[J]. Journal of Experimental Botany,2019, 70(12): 3075-3088.
[6]XU J, YANG J, WU Z, et al. Identification of a dual-targeted protein belonging to the mitochondrial carrier family that is required for early leaf development in rice[J]. Plant Physiology,2013, 161(4): 2036-2048.
[7]MOCHIZUKI N, BRUSSLAN J A, LARKIN R, et al. Arabidopsis genomes uncoupled 5 (GUN5) mutant reveals the involvement of Mg-chelatase H subunit in plastid-to-nucleus signal transduction[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(4): 2053-2058.
[8]SU N, HU M L, WU D X, et al. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J]. Plant Physiology, 2012, 159(1): 227-238.
[9]LV Q, XU J, WU P. Ospapst1, a useful mutant for identifying seed purity and authenticity in hybrid rice[J]. Plant Signaling & Behavior,2013, 8(7): e24819.
[10]THANGAPANDIAN R, BOOPATHI N M, YUVARAJA A. Transient albino and revertible to green (TARGreen) rice mutant: simple, affordable and beneficial novel tag for rapid genetic purity testing in rice (Oryza sativa L.)[J]. Genetic Resources and Crop Evolution, 2020, 67:1949-1955.
[11]KUSUMI K, SAKATA C, NAKAMURA T, et al. Plastid protein NUS1 is essential for build the genetic system for early chloroplast development under cold stress conditions[J]. Plant Journal for Cell and Molecular Biology, 2011,68(6):1039-1050.
[12]SUGIMOTO H, KUSUMI K, TOZAWA Y, et al. The virescent-2 mutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation[J]. Plant and Cell Physiology,2004, 45(8): 985-996.
[13]YOO S C, CHO S H, SUGIMOTO H, et al. Rice Virescent3 and Stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development[J]. Plant Physiology, 2009, 150(1): 388-401.
[14]SUN J, ZHENG T, YU J, et al. TSV, a putative plastidic oxidoreductase, protects rice chloroplasts from cold stress during development by interacting with plastidic thioredoxin Z[J]. The New Phytologist, 2017,251(1):240-255.
[15]NIU M, WANG Y, WANG C, et al. ALR encoding dCMP deaminase is critical for DNA damage repair, cell cycle progression and plant development in rice[J]. Journal of Experimental Botany,2017, 68(21/22): 5773-5786.
[16]XU J, WANG L, ZHOU M Y, et al. Narrow albino leaf 1 is allelic to CHR729, regulates leaf morphogenesis and development by affecting auxin metabolism in rice[J]. Plant Growth Regulation, 2017, 82(1): 175-186.
[17]LIN D, JIANG Q, ZHENG K, et al.Mutation of the rice ASL2 gene encoding plastid ribosomal protein L21 causes chloroplast developmental defects and seedling death[J]. Plant Biology, 2015, 17(3): 599-607.
[18]WANG W Y, DENG C, AI P F, et al. ALM1, encoding a Fe-superoxide dismutase, is critical for rice chloroplast biogenesis and drought stress response[J]. The Crop Journal, 2020,9(5):1018-1029.
[19]LIU X, CAO P H, HUANG Q Q, et al. Disruption of a rice Chloroplast-Targeted gene OsHMBPP causes a seedling-lethal albino phenotype[J]. Rice,2020, 13(1):51-62.
[20] ZENG X Y, TANG R, GUO H R,et al. A naturally occurring conditional albino mutant in rice caused by defects in the plastid-localized OsABCI8 transporter[J]. Plant Molecular Biology, 2017, 94(1/2): 137-148.
[21]HE Y, SHI Y F, ZHANG X B, et al. The OsABCI7 transporter interacts with OsHCF222 to stabilize the thylakoid membrane in rice[J]. Plant Physiology, 2020, 184(1): 283-299.
[22]林添資,孙立亭,龚红兵,等.一个水稻低温移栽白条纹突变体wltt的鉴定和基因定位[J].中国水稻科学, 2019, 33(1): 1-11.
[23]WU Z M, ZHANG X, HE B, et al. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis[J]. Plant Physiology, 2007, 145(1): 29-40.
[24]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001, 25(4): 402-408.
[25]SHI Y, CHEN J, LIU W, et al. Genetic analysis and gene mapping of a new rolled-leaf mutant in rice (Oryza sativa L.) [J]. Science China Life Sciences, 2009, 52(9): 885-890.
[26]李君,娄运生,马莉,等. 夜间增温和水分管理耦合对水稻叶片光合作用和荧光特性的影响[J]. 江苏农业学报, 2019,35(3):506-513.
[27]郝正刚,王志恒,魏玉清,等. 外源钙镉处理对甜高粱幼苗叶片光合作用的影响[J]. 江苏农业科学,2019,47(19):75-80.
[28]王锐洁,刘筱,杨淑君,等.氮沉降背景下遮阴对虎耳草生长和光合作用的影响[J].南方农业学报,2019,50(2):330-337.
[29]SANTIS-MACIOSSEK G D, KOFER W, BOCK A, et al. Targeted disruption of the plastid RNA polymerase genes rpoA, B and C1: Molecular biology biochemistry and ultrastructure[J]. Plant Journal, 1999, 18:477-489.
[30]LYU J, WANG Y, LIU L, et al. A putative plastidial adenine nucleotide transporter, BRITTLE1-3, plays an essential role in regulating chloroplast development in rice (Oryza sativa L.) [J]. Journal of Plant Biology,2017, 60(5): 493-505.
[31]KONG W, YU X, CHEN H, et al. The catalytic subunit of magnesium-protoporphyrin IX monomethyl ester cyclase forms a chloroplast complex to regulate chlorophyll biosynthesis in rice[J]. Plant Molecular Biology,2016, 92(1/2): 177-191.
[32]JUNG K H, HUR J, RYU C H, et al. Characterization of a rice chlorophyll-deficient mutant using the T-DNA gene-trap system[J]. Plant & Cell Physiology, 2003, 44: 463-472.
[33]ZHANG H, LI J, YOO J H, et al. Rice Chlorina-1 and Chlorina-9 encode ChlD and ChlI subunits of Mg-chelatase, a key enzyme for chlorophyll synthesis and chloroplast development[J]. Plant Molecular Biology,2006, 62: 325-337.
[34]TADINI L. Molecular and physiological dissection of GUN1 chloroplast-to-nucleus retrograde signaling[M]. Berlin,Germany:Springer,2013.
[35]TERRYM J, SMITH A G. A model for tetrapyrrole synthesis as the primary mechanism for plastid-to-nucleus signaling during chloroplast biogenesis[J]. Frontiers in Plant Science,2013, 4: 14.
(責任编辑:陈海霞)
收稿日期:2021-03-24
基金项目:江苏省重点研发(现代农业)项目(BE2021359);国家水稻产业技术体系项目(CARS-01-59);徐州市重点研发项目(KC20041、KC18238);徐州市农业科学院科研基金项目(XM2019002)
作者简介:胡婷婷(1980-),女,土家族,湖北宜昌人,博士,副研究员,主要从事水稻遗传育种。(E-mail)htt713@163.com

