噻虫嗪胁迫对水稻内生细菌群落结构和多样性的影响
黄博闻,崔凯,余向阳,葛静
摘要:为揭示噻虫嗪对水稻内生细菌群落的影响,采用Illumina HiSeq高通量测序技术对室内盆栽的水稻根、茎、叶内生细菌进行16S rRNA测序。获得用于分析的686 889条优质序列和265个操作分类单元(OTU)。通过α多样性分析发现,土壤噻虫嗪处理对根中内生细菌群落多样性影响显著,对茎、叶影响不明显。在属水平上对代表性OTU进行注释,发现水稻各器官中内生细菌组成受噻虫嗪的影响明显,表明噻虫嗪对水稻内生细菌组成结构影响显著。水稻各器官中内生细菌群落组成与噻虫嗪残留浓度有一定相关性,在水稻茎、叶中,相比于低施用量噻虫嗪处理,内生菌群落在高施用量噻虫嗪处理下改变更明显。
关键词:新烟碱杀虫剂;噻虫嗪胁迫;水稻内生细菌;高通量测序
中图分类号:X592文献标识码:A文章编号:1000-4440(2021)06-1370-08
Effects of thiamethoxam stress on the community composition and diversity of endophytic bacteria in rice
HUANG Bo-wen1,CUI Kai2,YU Xiang-yang1,2,GE Jing1,2
(1.School of Environmental and Safety Engineering, Jiangsu University, Zhenjiang 212013, China;2.Jiangsu Key Laboratory for Food Quality and Safety-State Key Laboratory Cultivation Base, Ministry of Science and Technology, Nanjing 210014, China)
Abstract: The effects of thiamethoxam stress on endophytic bacterial communities in roots, stems and leaves of rice were studied by Illumina Hiseq high-throughput sequencing technology with indoor pot culture and soil addition treatment. High quality sequences and operational taxons (OTUs) were 686 889 and 265, respectively. The results of α diversity index showed that thiamethoxam had a significant effect on the structure and diversity of endophytic bacterial community in rice roots, but had no significant effect on the diversity of endophytic bacterial community in rice stems and leaves. The representative OTUs were annotated at the genus level. It was found that the composition of endophytic bacteria in rice organs was significantly affected by thiamethoxam, and which was in correlation with the residual level of thiamethoxam. The changes of endophytic bacterial community under the treatment with high application rate of thiamethoxam were more obvious than those under the treatment with low application rate of thiamethoxam in the stems and leaves of rice.
Key words:neonicotinoids;thiamethoxam stress;rice endophytic bacteria;high-throughput sequencing
內生细菌指可以在植物内部组织中定殖的,不会造成任何直接的、明显的负面影响的细菌[1]。内生细菌具有修复污染、促生抗病[2]等功效,对内生细菌合理使用能够实现农业中减肥、减药、修复土壤环境的目的。内生细菌存在于植物的各个部分,目前已发现其存在于植物的根、茎、叶、胚、种子等器官组织的细胞或细胞间隙中,在植物的根瘤中也存在内生细菌[3]。内生细菌群落分布与组成易受环境、温度、土壤类型等因素影响而产生差异[4]。Hameed等[5]发现外源污染物在水稻体内累积后会影响其器官中内生菌群落组成。Ge等[6]研究发现,土壤中塑化剂在青菜体内富集后显著改变了其原有内生菌群落组成。Eevers等[7]发现2,2-双(4-氯苯基)-1,1-二氯乙烯(DDE)污染增加了西葫芦内生菌的数量和多样性,其中寡养单胞菌(Stenotrophomonas sp.)和鞘氨醇单胞菌(Sphingomonas sp.)在DDE污染情况下丰度显著高于对照,而假单胞菌(Pseudomonas sp.)则相反。
近年来,新烟碱类杀虫剂已经成为世界第一大杀虫剂,其中噻虫嗪和吡虫啉作为第二代新烟碱类杀虫剂的代表在农业生产中被广泛使用。新烟碱类杀虫剂具有内吸性,更容易被植物吸收富集[8]。谭颖等[9]从北京市场购买的49种蔬菜样品中检出7种新烟碱类农药,其中吡虫啉、啶虫脒和噻虫嗪检出率100%,新烟碱类农药在果蔬中的残留存在一定食品安全隐患。新烟碱类农药在植物中的富集还对植物的内生菌群落造成影响,崔凯等[10]发现水稻内生真菌群落多样性受噻虫嗪刺激而明显升高。关于噻虫嗪对水稻内生细菌群落的影响尚无报道,本试验采用室内盆栽试验,研究噻虫嗪对水稻内生细菌群落组成和多样性的影响,以期为新烟碱类农药微生态风险评估提供相关数据支持。
1材料与方法
1.1试剂与药品
试验药品:噻虫嗪原药,含量97.9%,济南绿霸化工有限公司生产;氯化钠(AR),西陇化工有限公司生产;色谱乙腈,德国默克公司生产;石墨化碳黑(GCB),青岛天泽生物有限公司生产;次氯酸钠(AR),天茂化工有限公司生产;95%乙醇,南京寿德生物有限公司生产。
1.2供试材料
土壤采自江苏省农业科学院试验田,晾干后锤碎,过20目筛并去除杂质备用。组成(归一化):有机质0.03;淤泥0.50;黏土0.21;含沙0.26。
土壤处理:玻璃盆中加入1 kg过筛细土,玻璃烧杯中加入100 ml丙酮溶解噻虫嗪原药,倒入土中用玻璃棒搅拌均匀,置于通风橱待丙酮挥发12 h。施用量设为:田间推荐用量(FR,1 mg/kg);10倍推荐量(10×FR,10 mg/kg);空白(CK)加100 ml丙酮。平行处理3次。
水稻品种为南粳9108(由江苏省农业科学院粮食作物研究所提供)。30 ℃水稻浸种1 h,30 ℃培养箱暗光催芽3 d。待种子出芽后将其转至噻虫嗪污染土中。每盆种植20株,置于人工温室,定期补充水分和肥料。
1.3样品收集与表面消毒
自种植日起至收获共60 d。每个处理随机取样3~5株水稻。用剪刀将水稻分为根、茎、叶3部分并立即进行表面消毒,方法参照文献[5],即75%酒精浸没样品60 s,1%次氯酸钠浸没样品120 s,每次弃去溶液后无菌水润洗3次。最后一次灭菌水涂布平板,验证灭菌效果。样品经液氮冷冻存于-80 ℃冰箱。
1.4DNA提取与扩增
Plant Genom-ic DNA Kit试剂盒提取样品总DNA,1%琼脂糖电泳检测纯度,Qubit2.0 Flurometer荧光定量仪检测DNA样品浓度。取10 ng DNA模板,采用V3-4区通用引物对目的区域进行扩增,对扩增出的目的片段进行富集,并加入特异index序列。
1.5文库构建、测序及生物信息学分析
用Illumina TruSeqTM DNA Sample Preparation Kit试剂盒构建文库,采用Qubit2.0初步定量文库浓度,文库符合预期后进行实时荧光定量核酸扩增检测(qPCR),对文库的有效浓度准确定量,检测合格的文库采用HiSeq在北京安诺优达科技有限公司测序。过滤后高质量序列进行PEAR[11]算法拼接、QIIME分析[12-13],包括分类操作单元(OTUs)提取、聚类分析、Alpha多样性分析[14-15]。使用SPSS 25统计分析,origin2019b、CAD2008制作图表。
1.6样品前处理
按照文献[16]的方法,取1.0 g冻干样品,加4 ml乙腈,机械匀浆20 min 后加1.0 g 氯化钠,涡旋30 s,5 000 r/min离心5 min。取2 ml上清液,加50 mg GCB涡旋2 min,取1 ml上清液过0.22 μm 滤膜待测。
1.7仪器
Agilent 1200液相色谱,色谱柱Agilent ZORBAX SB-C18(4.6 mm×250.0 mm,5 μm),流动相乙腈∶水=30∶70(体积比),流速0.6 ml/min,柱温25 ℃,进样量10 μl,检测波长255 nm。
2结果与分析
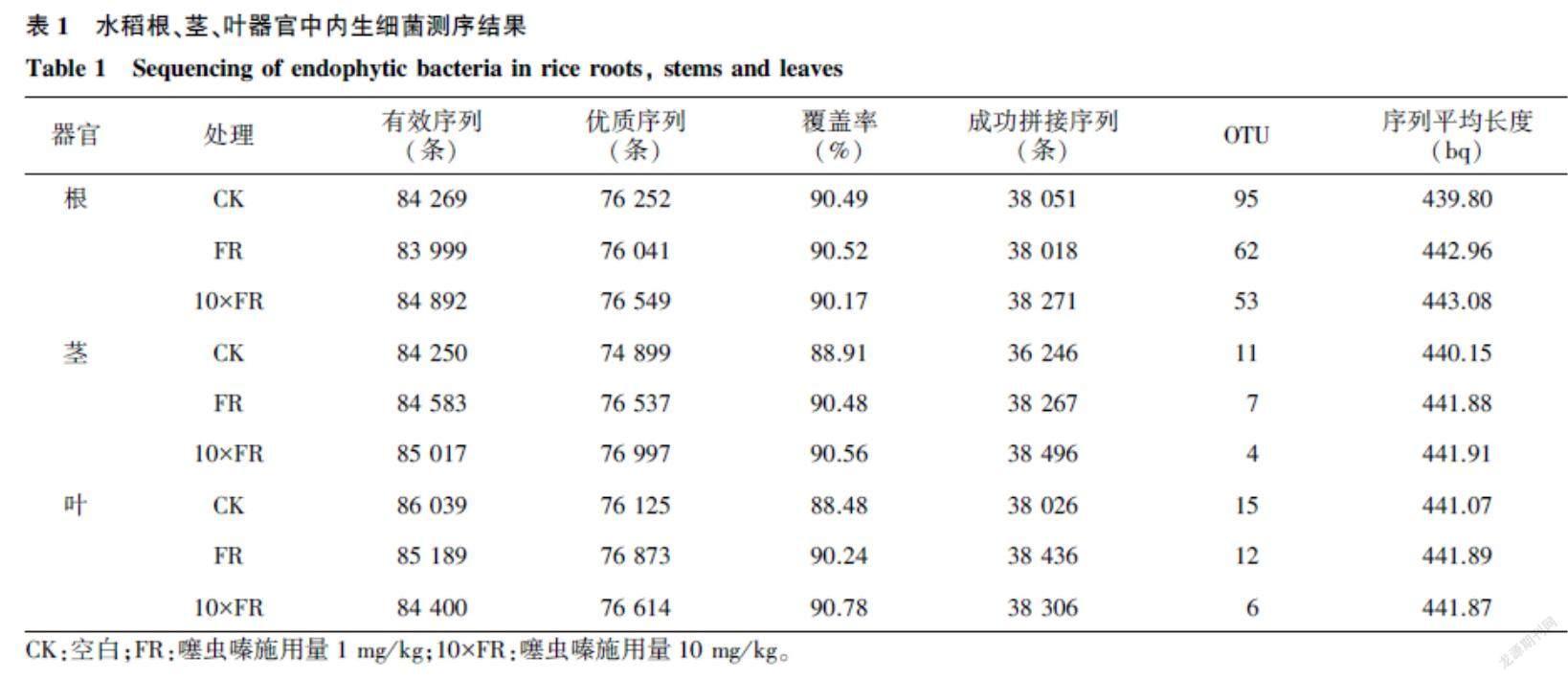
2.1水稻根、茎、叶器官中内生细菌测序结果
样品测序共获得有效序列762 638条,纯化后共686 889条,成功拼接序列342 117条。对相似度>97%序列分类后得到根、茎、叶OTU数量分别为253、22、33(表1)。从分类水平可知,相同处理水稻根部OTU数量明显高于叶和茎;相同部位,随着噻虫嗪施用量增加,OTU数量开始递减。
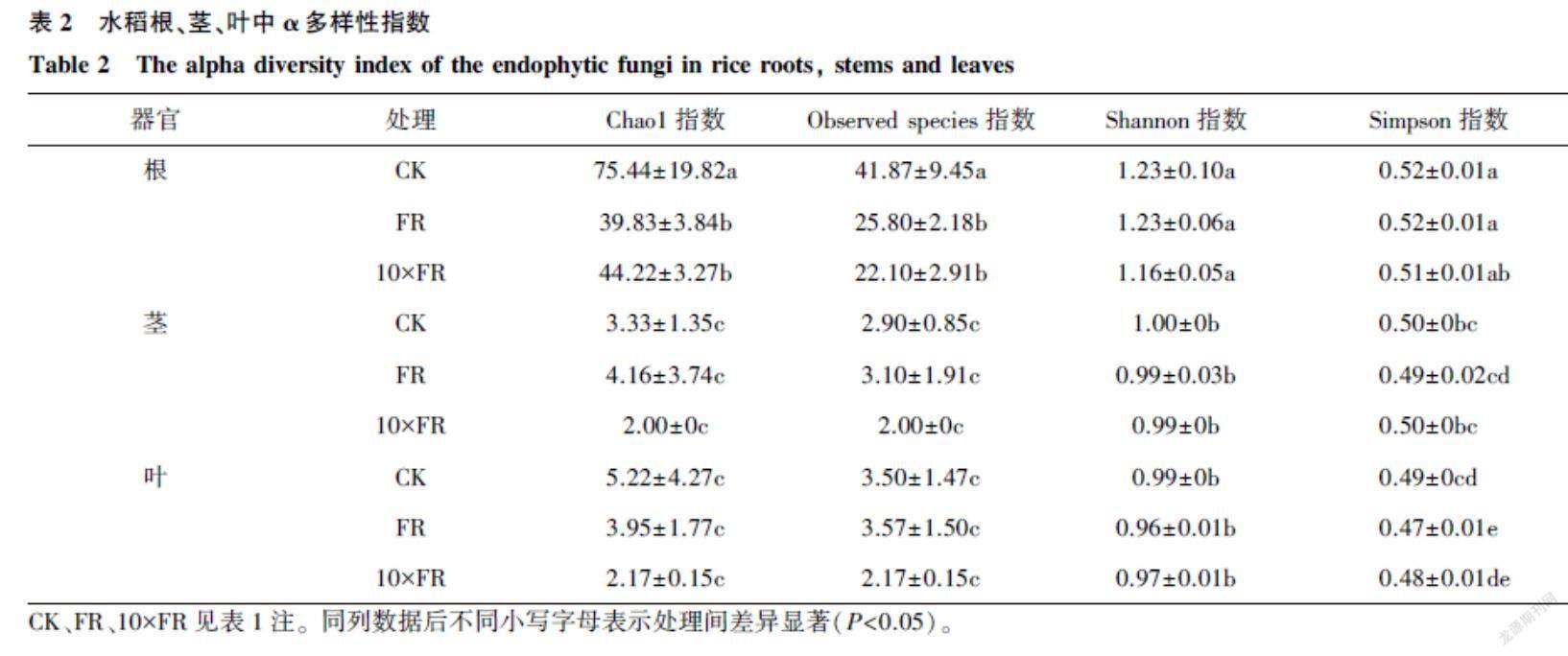
2.2噻虫嗪对水稻不同器官内生细菌多样性的影响
Chao1、Observed species指数越大,菌群丰度越高。Shannon指数越大,Simpson指数越低,群落多样性越高。表2显示,水稻根部噻虫嗪处理组菌群丰度指数均明显小于CK,茎部菌群多样性较CK无明显差异,叶中仅FR处理Simpson指数显著低于CK。可见,土壤噻虫嗪处理对水稻根部内生细菌群落多样性影响明显,难以对水稻地上部产生影响。
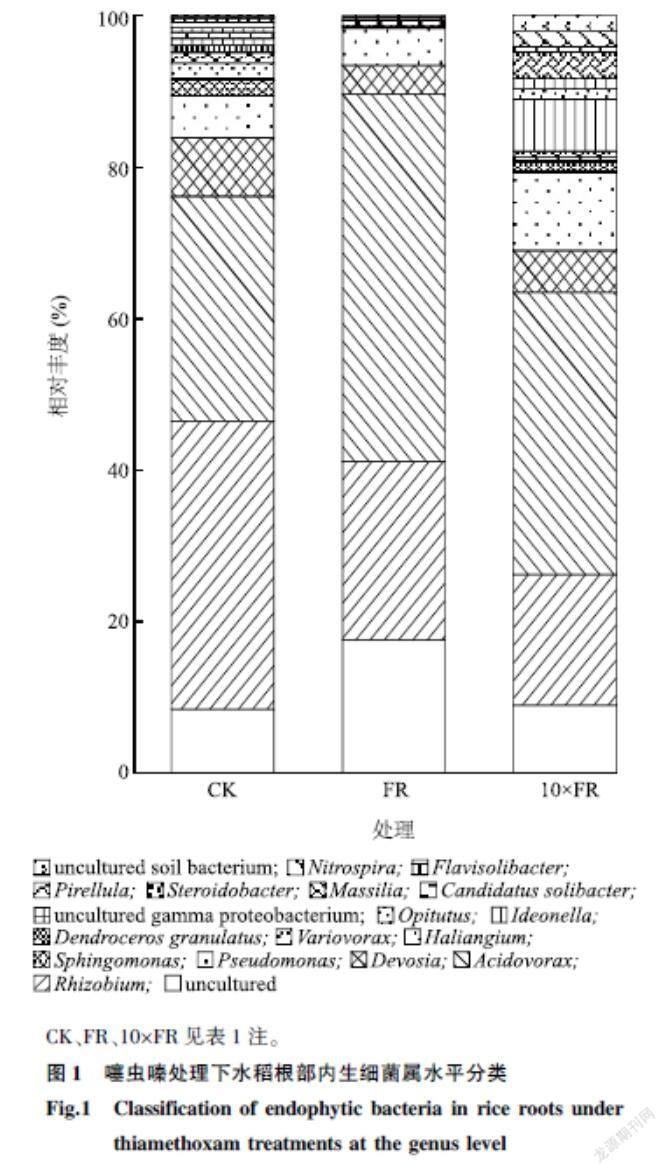
2.3噻虫嗪对水稻不同器官内生细菌组成的影响
由图1可知,在水稻根部,对照的优势菌属为Rhizobium(38.07%)、Acidovorax(29.63%),其次为Devosia(7.68%)、Pseudomonas(5.57%)。FR处理的水稻根部优势菌属为Acidovorax(48.51%)、Rhizobium(23.59%),其次為Pseudomonas(4.86%)、Devosia(3.85%)。10×FR处理的水稻根部优势菌属为Acidovorax(37.28%)、Rhizobium(17.28%)、Pseudomonas(10.35%),其次为Ideonella(6.92%)、Devosia(5.52%)、Massilia(3.43%)。随着土壤中噻虫嗪施用量的升高, Rhizobium、Haliangium 的相对丰度逐渐下降,其中Rhizobium降幅最明显,由CK的38.07%降至10×FR处理的17.28%;而Pseudomonas、Ideonella、Massilia的相对丰度在10×FR处理中显著提升。Acidovorax作为3种处理共有优势菌属,其相对丰度在施加噻虫嗪后呈现先升高后降低的趋势,可见该菌属受噻虫嗪影响较大。
由图2可知,在水稻茎中,对照的优势菌属为Dendroceros granulatus(24.92%)、Sphingomonas(11.91%)。FR处理的水稻茎中优势菌属为Pseudomonas(88.89%),其次为Rhizobium(11.11%)。10×FR处理的水稻茎中优势内生菌属已与CK无相关性,可能是受高施用量噻虫嗪影响。不同处理水稻茎中菌属展现了明显偏好性。Dendroceros granulatus和Sphingomonas仅在CK中检出,可见这2种菌属对土壤中噻虫嗪敏感。Pseudomonas和Rhizobium仅在FR处理中检出,特别是Pseudomonas相对丰度高达88.89%,为各部位中最高,可能是低施用量噻虫嗪能够促进其生长,且茎为其最适生长区域。
由图3可知,在水稻叶部,对照的优势菌属是Dendroceros granulatus(13.29%),其次是Pseudomonas(6.69%)、Candidatus Solibacter(6.69%)、Bryobacter(6.60%)。FR处理的水稻叶中优势菌属为Pseudomonas(87.94%)、Rhizobium(10.34%)。10×FR处理的水稻叶中内生细菌属已与CK无相关性。叶中菌属分布呈现多样性。Dendroceros granulatus仅在CK的水稻根、茎、叶中检出。Pseudomonas相对丰度由CK中6.69%升至FR处理中87.94%,在10×FR处理中未检出,这与在茎中结果一致,表明低施用量噻虫嗪能够促进该菌属生长,而高施用量噻虫嗪对其生长有抑制。Candidatus solibacter、Bryobacter仅在CK的叶中分布,这表明该2个菌属可能来源于水稻种子,并且对噻虫嗪胁迫较为敏感。Rhizobium在CK的水稻植株中未检出,在FR处理的水稻茎、叶中均有检出,而在10×FR处理的水稻植株中未检出,推测Rhizobium可能携带降解噻虫嗪基因或者可以促进植物降解噻虫嗪,因此在施用一定量噻虫嗪时可以在植物体内增殖。
表3直观反映了不同处理中主要内生细菌属在水稻不同部位分布情况。通过对比水稻根、茎、叶中内生菌属分布,能找到一些仅在特定部位存在且对噻虫嗪施用量具有特异敏感性的菌属。如Flavisolibacter、Nitrospira仅在噻虫嗪处理的水稻根部检出,特别是Nitrospira仅在10×FR处理中检出。Steroidobacter、Pirellula 仅在CK的根部检出,Bryobacter仅在CK的叶中检出,它们均对噻虫嗪极为敏感,一旦受到噻虫嗪胁迫,便无法生存。除此以外,从图4中我们也能发现各部位存在一些共有菌属,其中部分细菌能够在水稻各个部位存在且可在噻虫嗪影响下生存。Rhizobium、Pseudomonas在水稻根、茎、叶中均有分布,然而其在不同部位对噻虫嗪的响应存在显著差异,特别是Pseudomonas,其在茎、叶FR处理中相对丰度均高于80%,远高于CK,特别是茎中达88.89%,而在根部截然相反,说明该菌属在茎与叶中生长最适宜,这可能与噻虫嗪在水稻不同部位残留浓度有关,或是茎部有利于该菌属通过分泌次级代谢物或相关酶[17]以适应在噻虫嗪低施用量下处理植株中生长,甚至能够以噻虫嗪为碳源。
3讨论
水稻中内生细菌多样性与物种数量受噻虫嗪胁迫发生改变,在水稻不同器官中存在差异。土壤中噻虫嗪的施加主要改变了水稻根部内生细菌群落多样性,使根部菌群丰度明显下降,而对茎、叶中内生细菌群落多样性影响有限。从OTU分布情况看,水稻各器官内生细菌物种数量均随土壤中噻虫嗪施用量升高而下降。
从属水平看,水稻中内生细菌在不同器官中的分布存在明显差异。产生差异的原因在于水稻对内生菌属具有选择性,一些内生细菌属仅能存活于特定器官,即便存在于不同部位,其相对丰度也存在显著区别[18-19]。而根、茎、叶对内生菌的选择又与其所具有功能密不可分,一些具有促生、耐胁迫功能的内生菌属则可广泛存在于这些部位。比如Rhizobium具有与植物共生固氮的功能,其在增加土壤营养元素循环的同时,还能改善植物对营养元素的吸收,从而促进植物生长[20]。接种了Rhizobium beguminosarum bv phaseoli的水稻栽于温室中,其生物量和单产都显著增加[21]。再如Pseudomonas,已有大量文献报导该菌属中一些内生菌具有促生作用[22],还能够产生表面活性剂或者分泌胞外酶应对苯酚、毒死蜱等污染物[23],同时该菌属也是常见的烃类污染物降解菌[24],可以有效应对外来胁迫。同样,我们发现Candidatus solibacter仅在根与叶中分布,该菌属主要参与氮循环[25],具有固氮与有机质分解功能[26],而根与叶又是水稻参与氮循环主要场所,分别适宜该菌属参与硝化、反硝化和光合作用利用有机质[27]。Sphingomonas仅在根、茎中检出,该菌属具有促进植株从根际吸收营养[28]、降解莠去津[29]等功能,其在水稻中的分布从地下根部到地上茎部呈逐渐升高的趋势,可有效促进营养物质向上传导。Massilia能產生多种次级代谢产物和酶,且具有溶磷、降解菲和耐受重金属等多种功能[30]。Haliangium属于黏细菌,已有研究结果表明,黏细菌能抑制稻瘟病病菌和枯萎病病菌等多种植物病原菌[31-32]。根据试验结果推断,噻虫嗪的使用可能会导致水稻中对其敏感的有益菌减少,例如使一些具有疾病抗性与降解特性的细菌丰度下降。
噻虫嗪处理改变了水稻器官中内生细菌属的分布。随着噻虫嗪施用量增加,一些菌属相对丰度开始显著提升,如根部的Ideonella,该菌属能降解大分子有机物聚己内酯[33]及固氮[34],其在对照中丰度仅有0.91%,而在10×FR处理中达6.92%,具有作为潜在降解噻虫嗪内生菌的可能;而Rhizobium相对丰度则呈现逐渐递减趋势,相关文献也显示其主要参与固氮作用而少有分解有机污染物的功能。值得注意的是,一些菌属在对照中未检出,但出现在FR、10×FR处理中,其相对丰度逐渐升高,如Flavisolibacter,该菌属主要存在于土壤,参与土壤氮循环[35],其相对丰度的提高说明水稻为应对噻虫嗪胁迫从土壤环境中招募内生菌,因此在水稻根部大量富集,进一步说明该菌属对高浓度噻虫嗪存在抗性且可能作为潜在的噻虫嗪降解菌。也有菌属在低浓度噻虫嗪影响下相对丰度升高,高浓度下降低,如Acidovorax作为优势菌属在不同处理的根部存在,茎、叶中未检出,其在 FR处理中相对丰度升高而在10×FR中下降,说明低浓度噻虫嗪可能刺激该菌属生长,有报道提到该菌属具有降解杀草丹[36]、多环芳烃[37]、萘[38]等功能。
水稻器官中噻虫嗪残留能够改变其内生细菌群组成。噻虫嗪在水稻各器官的含量由高到低依次为茎>根>叶,各部位残留与土壤中残留浓度呈正相关关系。在根部,10×FR处理与FR处理对内生细菌属分布的影响不显著,说明在属水平上,水稻根部内生菌群受噻虫嗪施用量变化影响不明显;而在茎、叶中则相反,高施用量噻虫嗪处理的内生细菌属与低施用量处理的内生细菌属完全不同,内生菌群落发生了明显改变。
本研究采用Illumina HiSeq高通量测序技术[39-40]首次分析了水稻不同器官中内生细菌群落在噻虫嗪胁迫下的组成和多样性变化。结果表明,噻虫嗪对水稻不同器官中内生细菌群落都有影响,且噻虫嗪施用量与水稻器官中内生细菌群落受到的影响程度呈正相关关系。该研究结果可以为具有噻虫嗪耐受性与降解特性内生细菌的分离鉴定提供指导,同时也可为噻虫嗪生态风险评估提供参考。
参考文献:
[1]MITTER B, BRADER G, PFAFFENBICHLER N, et al. Next generation microbiome applications for crop production ——limitations and the need of knowledge-based solutions [J]. Current Opinion in Microbiology, 2019, 49: 59-65.
[2]ULLAH A, FAHAD S, MUNIS F H. Phytoremediation of heavy metals assisted by plant growth promoting (PGP) bacteria: A review [J]. Environmental and Experimental Botany, 2015, 117: 28-40.
[3]姚领爱,胡之璧,王莉莉,等. 植物内生菌与宿主关系研究进展 [J]. 生态环境学报, 2010, 19(7): 1750-1754.
[4]毛光瑞,翟梅枝,史冠昭,等. 陕西不同生境核桃内生真菌多样性 [J]. 微生物学通报, 2016, 43(6): 1262-1273.
[5]HAMEED A, YEH M W, HSIEH Y T, et al. Diversity and functional characterization of bacterial endophytes dwelling in various rice ( Oryza sativa L.) tissues, and their seed-borne dissemination into rhizosphere under gnotobiotic P-stress [J]. Plant and Soil, 2015, 394(1): 177-197.
[6]GE J, CHENG J, LI Y, et al. Effects of dibutyl phthalate contamination on physiology, phytohormone homeostasis, rhizospheric and endophytic bacterial communities of Brassica rapa var. chinensis [J]. Environmental Research, 2020, 189(4): 109953.
[7]EEVERS N, HAWTHORNE J R, WHITE J C, et al. Exposure of Cucurbita pepo to DDE-contamination alters the endophytic community: A cultivation dependent vs a cultivation independent approach [J]. Environmental Pollution, 2016, 209: 147-154.
[8]李進,张军高,刘鹏飞,等. 4种种衣剂防治棉花苗期主要病虫害效果及经济效益比较 [J]. 植物保护, 2021, 47(1): 241-247.
[9]谭颖,张琪,赵成,等. 蔬菜水果中的新烟碱类农药残留量与人群摄食暴露健康风险评价 [J]. 生态毒理学报, 2016, 11(6): 67-81.
[10]崔凯,葛静,柴阳阳,等. 噻虫嗪对水稻内生真菌群落组成的影响 [J]. 江苏农业学报, 2017, 33(4): 802-808.
[11]ZHANG J, KASSIAN K, TOM F, et al. PEAR: a fast and accurate Illumina Paired-End reAd mergeR [J]. Bioinformatics, 2014, 30(5): 614-620.
[12]GREGORY C J, JUSTIN K, JESSE S, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010, 7(5): 335-336.
[13]JIYOUNG A, RASHMI S, ZHIHENG P, et al. Human gut microbiome and risk for colorectal cancer [J]. Journal of the National Cancer Institute, 2013, 105(24): 1907-1911.
[14]KNIGHT R. PyNAST: a flexible tool for aligning sequences to a template alignment [J]. Bioinformatics, 2010, 26(2): 266-267.
[15]LANGILLE M, ZANEVELD J, CAPORASO J G, et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences [J]. Nature Biotechnology, 2013, 31(9): 814-821.
[16]龙玲,李勇,严煌倩,等. 小松菜对土壤中4种新烟碱类杀虫剂的吸收转运差异 [J]. 江苏农业科学, 2018, 46(7): 205-208.
[17]宋茂鹏,马现永,邓盾,等. 假单胞菌胞外酶降解黄曲霉毒素B-1的酶学性质 [J]. 微生物学通报, 2021, 48(1): 46-56.
[18]TIAN X L, CAO L X, TAN H M, et al. Study on the communities of endophytic fungi and endophytic actinomycetes from rice and their antipathogenic activities in vitro [J]. World Journal of Microbiology & Biotechnology, 2004, 20(3): 303-309.
[19]张晨智. 健康香蕉内生菌群落形成特征及其应用 [D]. 南京:南京农业大学, 2018.
[20]王雅娜,刘洪伟,崔冠慧,等. 高通量测序分析胡萝卜连作与轮作土壤细菌多样性 [J]. 基因组学与应用生物学, 2020, 39(5): 2111-2117.
[21]SINGH R K, MISHRA R, JAISWAL H K, et al. Isolation and identification of natural endophytic rhizobia from rice ( Oryza sativa L.) through rDNA PCR-RFLP and sequence analysis [J]. Current Microbiology, 2006, 52(5): 345-349.
[22]杨亚茹,茆少星,闫淑珍,等. 内生菌荧光假单胞菌DLJ1和蜡状芽胞杆菌SZ5对南方根结线虫胁迫下辣椒植株抗性与产量品质的影响 [J]. 植物保护, 2020, 46(6): 96-102.
[23]王卫强,崔静,吴尚书,等. 石油烃降解菌Pseudomonas sp.及其生物表面活性剂对原油处理效果分析 [J]. 石油学报, 2020, 36(5): 1039-1046.
[24]李争艳,徐智明,李岩,等. 高粱根际微生物研究进展 [J]. 草学, 2021, 4(2): 7-14.
[25]苟永刚. 应用DNA-SIP研究甘蔗//大豆间作系统参与氮素循环核心功能微生物多样性 [D]. 广州:华南农业大学, 2018.
[26]伏云珍,马琨,李倩,等. 马铃薯、玉米间作对土壤细菌多样性的影响 [J]. 中国生态农业学报(中英文), 2020, 28(11): 1715-1725.
[27]徐胜光,高召华,林丽,等. 氮素形态和光照强度对水稻表土及根际N2O排放的影响 [J]. 植物营养与肥料学报, 2016, 22(5): 1319-1328.
[28]李忠奎,丁亚茹,周应刚,等. 不同前作对植烟土壤養分含量、酶活性及细菌群落结构的影响 [J]. 云南农业大学学报(自然科学), 2020, 35(4): 708-716.
[29]王平平. 改性生物炭对莠去津和烟嘧磺隆的吸附机理及环境行为影响研究 [D]. 北京:中国农业科学院, 2020.
[30]杨恩东,崔丹曦,汪维云. 马赛菌属细菌研究进展 [J]. 微生物学通报, 2019, 46(6): 1537-1548.
[31]肖蓉,文也,唐少军,等. 土壤样品中黏细菌的分离鉴定及其生物活性检测 [J]. 微生物学报, 2014, 54(12): 1429-1437.
[32]LI Z, YE X, LIU M, et al. A novel outer membrane β-1,6-glucanase is deployed in the predation of fungi by myxobacteria [J]. The ISME Journal, 2019, 13(9): 1-13.
[33]张璐璐. 基于有机缓释碳源的反硝化生物滤池对污水深度脱氮效果研究 [D]. 成都:成都理工大学, 2019.
[34]张娅. 三维电极生物膜耦合硫铁同步脱氮除磷及去除PAEs研究 [D]. 北京:北京工业大学, 2016.
[35]李爽. 水稻土厌氧硝酸盐还原耦合亚铁氧化与砷氧化机制 [D]. 广州:中国科学院大学(中国科学院广州地球化学研究所), 2018.
[36]褚翠伟. 杀草丹降解菌株Acidovorax sp. T1的分离鉴定、降解途径及关键酶基因克隆 [D]. 南京:南京农业大学, 2017.
[37]罗俊鹏. 多环芳烃降解菌的筛选、降解特性及其与化学氧化联合应用研究 [D]. 南昌:南昌大学, 2019.
[38]于洋洋,王广智,王卓然,等. 萘好氧降解污泥强化培养特性与降解效能研究 [J]. 环境科学与技术, 2017, 40(8): 128-133.
[39]廖娟,王钢,喻世刚,等. 利用Illumina MiSeq测序平台分析沐川乌骨黑鸡空肠微生物多样性[J].江苏农业科学,2020,48(24):178-182.
[40]刘怡南,温彬,陈再忠. 七彩神仙鱼脑组织转录组mRNAs差异表达分析[J].南方农业学报,2020,51(11):2827-2835.
(责任编辑:张震林)
收稿日期:2021-03-20
基金项目:国家自然科学基金项目(31872002、31772197)
作者简介:黄博闻(1996-),男,江苏无锡人,硕士研究生,研究方向为农业环境。(E-mail)609939306@qq.com
通讯作者:葛静,(E-mail)gejing@jaas.ac.cn;余向阳,(E-mail)yuxy@jaas.ac.cn

