1型糖尿病小鼠心房肌细胞电重塑及AGE对其的影响
郑丹琳,刘沛明,张 利,周梦园,曾 鹏,李穗敏,秦晓玥,梁海丹,邝素娟,杨 慧,饶 芳,邓春玉,3,4
(1. 华南理工大学生物科学与工程学院,广东 广州 510640; 2. 广东省人民医院(广东省医学科学院)医学研究部临床药理重点实验室,广东 广州 510080;3. 华南理工大学医学院,广东 广州 510640;4. 广东省心血管病研究所心血管内科,广东 广州 510080)
糖尿病(diabetes mellitus,DM)是胰岛素抵抗或胰岛素分泌绝对不足引起的慢性代谢疾病,常伴有多饮、多食、多尿、体重减轻以及视力模糊等临床特征。由于久坐、压力、高脂饮食等不良生活方式,全世界约有1.4亿人患糖尿病,预计到2025年,糖尿病人数将达3亿[1]。目前研究成果主要基于2型糖尿病的发病机制及其并发症的研究,对1型糖尿病研究较少。1型糖尿病是由于胰腺β细胞丢失,胰岛素分泌不足,导致低胰岛素血症和高血糖,是青少年中最常见的糖尿病类型,约占全球糖尿病人口的10%,且比例逐年增加[2]。
糖尿病是心肌梗死、冠状动脉粥样硬化等各种心血管疾病发生发展的主要危险因素,与心血管疾病发生率和死亡率增加有关。心房颤动是临床上糖尿病患者最常并发的心律失常之一,比例逐年升高,但其具体机制尚不清楚,临床防治亟待解决[3]。目前研究表明,心房颤动的发生机制主要是心房电重构和结构重构导致的。心房电重构在房颤发生和维持中起着重要作用,主要特征包括心房有效不应期缩短,离散度增加以及频率适应性丧失,传导延迟[4]。已有研究报道,糖尿病会影响心房肌细胞动作电位时程及复极时间,并伴随着多种离子通道电流改变,促进心律失常和心房颤动的发生,但对糖尿病源性心房颤动的具体机制尚未完全阐明[5-6]。HL-1细胞来源AT-1小鼠心房粘液瘤组织,一种具有保持分化的心脏表型的同时持续分裂和自发收缩的心肌细胞系,目前已被广泛用于研究正常或病理状态下的心房肌细胞功能[7]。晚期糖基化终末产物(advance glycation end products,AGE)是糖尿病患者代谢异常中产生的重要代谢产物,参与糖尿病的病理生理过程。本研究以1型糖尿病小鼠和HL-1细胞为研究对象,探讨1型糖尿病小鼠心房肌动作电位时程(action potential duration,APD)和L型钙通道(L-type calcium channel,ICa,L)、瞬时外向钾离子通道(transient outward K+channel,Ito)、超快速延迟整流钾通道(ultra-rapid delayed rectifier K+channel,Ikur)电流的变化,以及AGE参与HL-1心房肌细胞电重塑机制研究。
1 材料
1.1 实验动物SPF级,7-8周龄♂ C57BL/6 小鼠,共30只,购自江苏集萃药康生物科技有限公司,生产许可证号为SCXK(苏)2018-0008,饲养于华南理工大学实验动物中心,恒温(22±2)℃,恒湿(55±5)%,人工光照明暗各12 h·d-1,噪声<50 dB,24 h自由取食和饮水。本研究所有动物实验已通过广东省人民医院(广东省医学科学院)的动物实验伦理审查(No.GDREC201208A)。
1.2 试剂与仪器Advatage血糖仪和血糖检测试纸(德国Roche公司);Langendorff恒流灌流装置;倒置显微镜(德国AXIO公司);MultiClamp700B膜片钳放大器、Digidata 1440A数模转换器、pCLAMP 10.2数据采集分析软件(美国AXON公司);MP-285型微电动操纵器、P97型玻璃微电极拉制仪(美国Sutter公司);蛋白电泳仪、转膜仪(北京市六一仪器厂);AGEs-BSA(Biovision公司,5F24L22210);Anti-RAGE(Abcam公司,GR3221250-8);兔抗AGE抗体、兔抗Kv1.5抗体、兔抗Kv4.3抗体、兔抗Cav1.2抗体(Cell Signaling Technology公司);抗GAPDH鼠多克隆抗体(Proteintech公司);CLAYCOMB培养基、胎牛血清(Bioscience公司);HEPES-Na(SLBT 3849)、MEM(SLBZ3996)、胶原酶Ⅱ(V900892-1G)、链脲佐菌素(Streptozotocin,STZ,100 M1227V)(Sigma公司)。其余试剂均为国产分析纯。
1.3 实验溶液无钙灌流液(mg·L-1):1 MEM,2.6 HEPES-Na,0.9 NaHCO3,用NaOH将PH调至7.35;酶解消化液(g·L-1):1 BSA,0.5胶原酶Ⅱ(使用时用无钙灌流液配置)。
动作电位细胞外液包含(mmol·L-1):145 NaCl,4 KCl,1 MgCl2,1.8 CaCl2,10 HEPES,用NaOH将pH调至7.4;电极内液包含(mmol·L-1):140 KCl;1 MgCl2·6H2O;10 HEPES;5 EGTA;5 Na2-ATP,用KOH将pH调至7.2。
记录Ito电流时,细胞外液(mmol·L-1)包含:140 NaCl,4 KCl,1 MgCl2,10 HEPES,2 CaCl2,10葡萄糖,0.5 CdCl2,用NaOH使pH调至7.4;电极内液(mmol·L-1)包含:140 KCl,1 MgCl2·6H2O,10 HEPES,5 EGTA,5 Na2-ATP,用KOH将pH调至7.2。
记录ICa,L电流时,细胞外液成份为(mmol·L-1):140 TEA-Cl,5 CaCl2,2 MgCl2,10 HEPES,10葡萄糖,用CsOH将pH调至7.4;电极内液使用高Cs溶液(mmol·L-1):100 CsCl,20 TEA-Cl,5 Na2ATP,0.4 Na2GTP,10 EGTA,10 HEPES,用Tris将pH调至7.2。
记录Ikur电流时,细胞外液(mmol·L-1)包含:5.4 KCl,1 MgCl2·6H2O,136 NaCl,0.33 NaH2PO4,10 HEPES,2 CaCl2·2H2O,10 葡萄糖·H2O,0.3 CdCl2,0.5 BaCl2,用NaOH将pH调至7.4;电极内液(mmol·L-1)包含:140 KCl,1 MgCl2·6H2O,10 HEPES,5 EGTA,5 Na2-ATP,用KOH将调节pH至7.2。
KB液成份为(mmol·L-1):50 K-谷氨酸,20 KOH,40 KCl,20 KH2PO4,20牛磺酸,10葡萄糖·H2O,3 MgCl2·6H2O,0.5 EGTA,10 HEPES,20 KOH,用NaOH将pH调至7.4,分装至50 mL离心管,- 80 ℃冰箱保存。
2 方法
2.1 1型糖尿病动物模型的构建9周龄小鼠连续5 d腹腔注射STZ溶液(50 mg·kg-1体质量),同时对照组注射等量的柠檬酸-柠檬酸钠缓冲液(pH值4.2-4.5)。1周后测定随机血糖≥16.7 mmol·L-1,确定1型糖尿病模型建立成功[8]。10周后,分离心房肌细胞,记录动作电位及离子通道电流密度;部分动物留取心房肌组织检测AGE、RAGE及离子通道蛋白表达,比较对照组和糖尿病组小鼠的差异。
2.2 HL-1心房肌细胞的培养HL-1细胞(小鼠心房肌细胞株)是从路易斯安那州立大学健康科学中心的William Claycomb教授实验室获得的。细胞在Claycomb培养基中培养,添加10%胎牛血清、2 mmol·L-1谷氨酰胺、100 μmol·L-1去甲肾上腺素,在预先涂有纤维连接蛋白和0.2 g·L-1明胶的培养瓶上培养,然后在37 ℃,5 % CO2的培养箱下孵育。每48 h换液1次。当细胞密度长到60 %时,可对细胞进行加药处理。
2.3 Western blot技术检测相关蛋白表达颈椎脱臼处死小鼠,剪开胸腔并且用PBS溶液清洗心脏后,留取左右心耳组织,储存于-80 ℃冰箱。提取组织时从冰箱取出心房肌组织,放进冰上加入适量含有蛋白酶抑制剂的中性裂解液,UP200S超声粉碎仪在冰上对组织进行超声粉碎30 s后,4 ℃ 12 000 r·min-1离心15 min,上清即为组织蛋白。BCA法测定蛋白浓度。利用中性裂解液及上样缓冲液(4X loading buffer)调至蛋白浓度相等,100 ℃变性10 min,进行SDS-PAGE电泳分离蛋白、转膜,5 %脱脂牛奶封闭1 h,一抗(1 ∶1 000)4 ℃ 摇床孵育过夜;常温摇床孵育二抗(以1 ∶10 000的比例稀释于5%脱脂奶粉的TBST)1 h。最后用ECL试剂盒显影蛋白条带,ImageJ图像分析软件分析目的蛋白及内参蛋白的灰度值,并进行统计学分析。
2.4 小鼠心房肌细胞全细胞膜片钳实验小鼠用颈椎脱臼法处死,迅速开胸取出心脏,在体视显微镜下,行主动脉逆行插管,固定在Langendorff恒流灌流装置上,对离体心脏进行逆行灌流,采用酶解法分离小鼠单个心房肌细胞。37 ℃预温灌流液和含酶消化液,先用灌流液灌流心脏约10 min,而后用含酶消化液灌流30 min左右,直到组织结构变疏松,滴出的液体呈拉丝状,剪取左右心耳组织,置于KB液中剪碎,毛细吸管轻柔吹打至细胞分散,室温静置10 min, 弃上清,用KB液重悬,4 ℃保存备用。
采用MultiClamp 700B放大器的全细胞膜片钳记录单个心房肌细胞的相关指标。显微镜下选取横纹清晰、贴壁良好的单个心肌细胞,使用MP-285三维操纵器使电极进入细胞外液,测试电极电阻为2~5 MΩ为合格,可继续用于实验。电极接触细胞后,轻吸细胞膜形成GΩ封接破膜。电流幅度稳定后进行补偿,按照参数设置分别记录各电流。使用Digidata 1440A数据采集系统,用MultiClamp 700B放大器记录电流信号并存储在计算机上。GraphPad Prism 8用于离子通道电流密度、复活曲线、失活曲线、APD曲线拟合,计算动作电位振幅(APA)、复极50%、90%电位时程(APD50、APD90)。
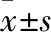
3 结果
3.1 1型糖尿病小鼠模型的构建对照组和模型组小鼠分别注射等量溶剂及STZ一周后,与对照组小鼠(5.18±1.55 mmol·L-1,n=15)相比,糖尿病小鼠血糖值(27.61±4.55 mmol·L-1,n=14)均明显上升(P<0.01),成模率93.33 %,提示糖尿病模型构建成功。继续观察饲养至20周,糖尿病小鼠出现“多饮、多食、多尿”体征,随机血糖水平(26.76±6.0 mmol·L-1,n=13)明显升高(P<0.01)。
3.2 糖尿病小鼠心房肌细胞动作电位时程的变化与对照组小鼠相比,糖尿病小鼠心房肌细胞动作电位时程(APD)明显延长,APA(88.42±11.09 mVvs91.80±2.28 mV,n=7)无明显变化(P>0.05)(见Fig 1A、B);APD50(15.39±5.54 msvs36.60±11.74 ms)、APD90(59.45±12.41 msvs130.83±21.52 ms)均明显增加(n=8,P<0.01)(见Fig 1C、D)。
3.3 糖尿病小鼠心房肌细胞Ito及心房组织Kv4.3蛋白表达的变化与对照组相比,糖尿病小鼠心房肌细胞Ito电流密度明显低于对照组(在+60 mV时,分别为(11.54±3.19) pA/pFvs(5.54±1.91) pA/pF,n=7~10)(P<0.01)(见Fig 2A)。如Fig 2B、Fig 2C激活/失活及复活曲线所示,Ito的激活及复活动力学无明显差异(激活曲线V0.5分别为(21.10±11.44) mVvs(21.84±9.86) mV;Slope值为(21.68±7.29) mVvs(18.81±5.10) mV,复活曲线τ值分别为(31.98±14.89) msvs(29.09±10.43) ms,n=8~11)(P>0.05),但失活加快(失活曲线Slope值分别为(-4.40±1.04) mVvs(-9.32±2.78) mV,n=9~10)(P<0.01)。与对照组相比,糖尿病心房组织中Kv4.3蛋白的表达水平明显下调(0.88±0.17vs0.38±0.27,n=6)(P<0.01,见Fig 2D)。
3.4 糖尿病小鼠心房肌细胞Ikur及心房组织Kv1.5蛋白表达的变化糖尿病小鼠心房肌细胞Ikur电流密度与对照组相比明显降低(在+60 mV时,分别为(8.48±2.32) pA/pFvs(5.28 ±1.39) pA/pF,n=7~8)(P<0.01)(见Fig 3A)。与对照组相比,糖尿病心房肌组织中Ikur主要的编码蛋白Kv1.5表达水平明显降低(0.79±0.11vs0.33±0.21,n=6)(P<0.01,见Fig 3B)。

Fig 1 APD of atrial myocytes isolated from control and diabetic groups
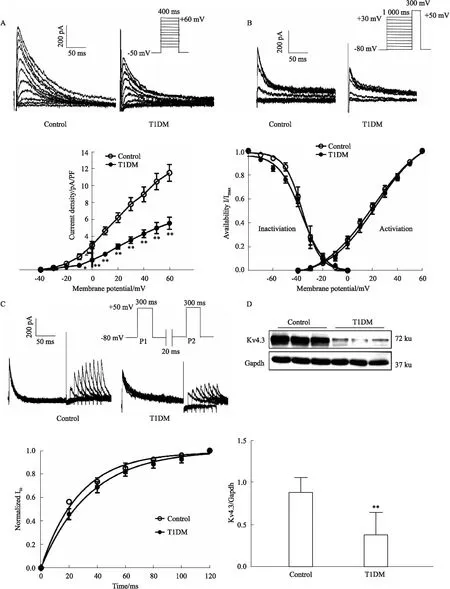
Fig 2 Effect of Ito and related protein expression of atrial myocytes in atriums of diabetic mice
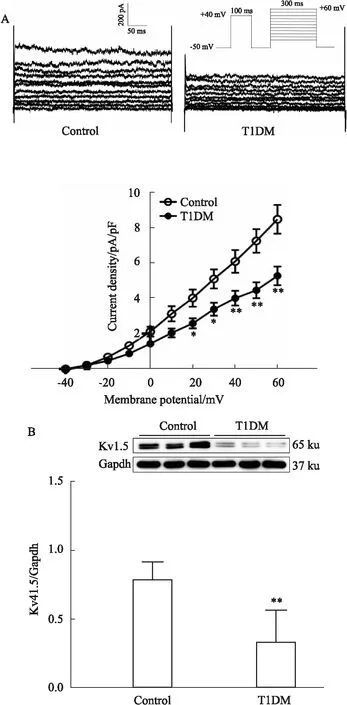
Fig 3 Effect of IKur and related protein expression of atrial myocytes in atriums of diabetic mice
3.5 糖尿病小鼠心房肌细胞ICa,L及心房组织Cav1.2蛋白表达的变化糖尿病小鼠心房肌细胞ICa,L电流密度明显低于对照组(在+10 mV时,对照及糖尿病小鼠ICa,L分别为(-1.87±0.26) pA/pFvs(-1.26±0.24) pA/pF,n=9~10)(P<0.01),其激活电位、锋电位、翻转电位无明显影响(见Fig 4A)。如Fig 4B、C激活/失活及复活曲线所示,ICa,L的激活及复活动力学无明显差异(激活曲线V0.5分别为(-12.64±5.16) mVvs(-14.06±6.64) mV;激活曲线Slope值为(8.28±2.15) mVvs(9.55±3.67) mV;复活曲线τ值分别为(65.48±13.87) msvs(78.85±3.79) ms;n=5~16)(P>0.05),但失活加快(失活曲线V0.5分别为(-36.17±4.08) mVvs(-41.72±4.27) mV;Slope值为(-6.28±1.88) mVvs(-8.22±1.77) mV,n=15)(P<0.01)。与对照组相比,糖尿病小鼠心房肌组织中Cav1.2蛋白的表达水平明显降低(0.97±0.06vs0.40±0.11,n=6)(P<0.01,见Fig 4D)。
3.6 T1DM心房肌组织AGE、RAGE蛋白表达变化以及AGE对HL-1细胞通道蛋白表达的影响与对照组小鼠相比,糖尿病小鼠心房肌组织晚期糖基化终末产物及其受体(AGE及RAGE)蛋白表达明显积累(0.64±0.20vs0.95±0.23;0.87±0.12vs1.08±0.19,n=6/7)(P<0.05,见Fig 5A)。与BSA组相比,AGE ( 0.4 g·L-1)处理HL-1细胞能明显降低离子通道蛋白Cav1.2、Kv4.3及Kv1.5的表达水平(分别为0.67±0.11vs0.37±0.14,0.85±0.03vs0.43±0.09,0.84±0.13vs0.56±0.10,n=3)(P<0.05);与AGE组相比,Anti-RAGE(2 mg·L-1)预处理HL-1细胞明显上调离子通道蛋白表达(分别为0.37±0.14vs0.86±0.09,0.43±0.09vs0.60±0.01,0.56±0.10vs0.77±0.08,n=3)(P<0.05)(见Fig 5B),提示晚期糖基化终末产物与其受体相互作用,参与糖尿病心房肌细胞电重塑。
4 讨论
心房电重构在房颤发生和维持起着重要作用,糖尿病病变损伤引起的离子通道电流的变化,进而影响心房肌细胞动作电位时程。临床研究表明,糖尿病患者心房传导减慢,传导异质性改变,动作电位时程明显延长[4]。目前糖尿病相关的电生理改变大多集中于心室肌的研究,对心房肌的研究相关报道极少。本研究结果显示,STZ诱导的1型糖尿病小鼠动作电位时程延长,APD50,APD90与对照组相比明显延长,动作电位振幅(APA)则未见明显差异,这是多种离子通道电流相互作用的结果,糖尿病心房肌细胞动作电位时程的延长导致糖尿病相关的心房颤动发生。
ICa,L电流是动作电位平台期的主要复极内向电流,参与心肌细胞的收缩。临床研究发现,与窦性心律患者相比,慢性房颤患者心房肌细胞ICa,L电流和Cav1.2蛋白表达均降低,ICa,L通道数量减少可能是慢性房颤患者心房电重构的基础[9]。以往研究发现,药物或转基因诱导的不同种属的糖尿病动物心房肌细胞传导减慢,心房肌细胞的Ca2+调节受损,但ICa,L通道电流变化研究报道不一[10-11]。本研究结果提示,STZ诱导的1型糖尿病小鼠心房肌细胞ICa,L电流密度明显降低,编码蛋白Cav1.2表达水平明显下调;其激活、复活曲线动力学无明显差异,但失活加快,提示糖尿病小鼠在通道动力学功能方面也有部分改变,参与糖尿病小鼠心房颤动。
Fig 4 Effect of ICa,L and related protein expression of atrial myocytes in atriums of diabetic mice
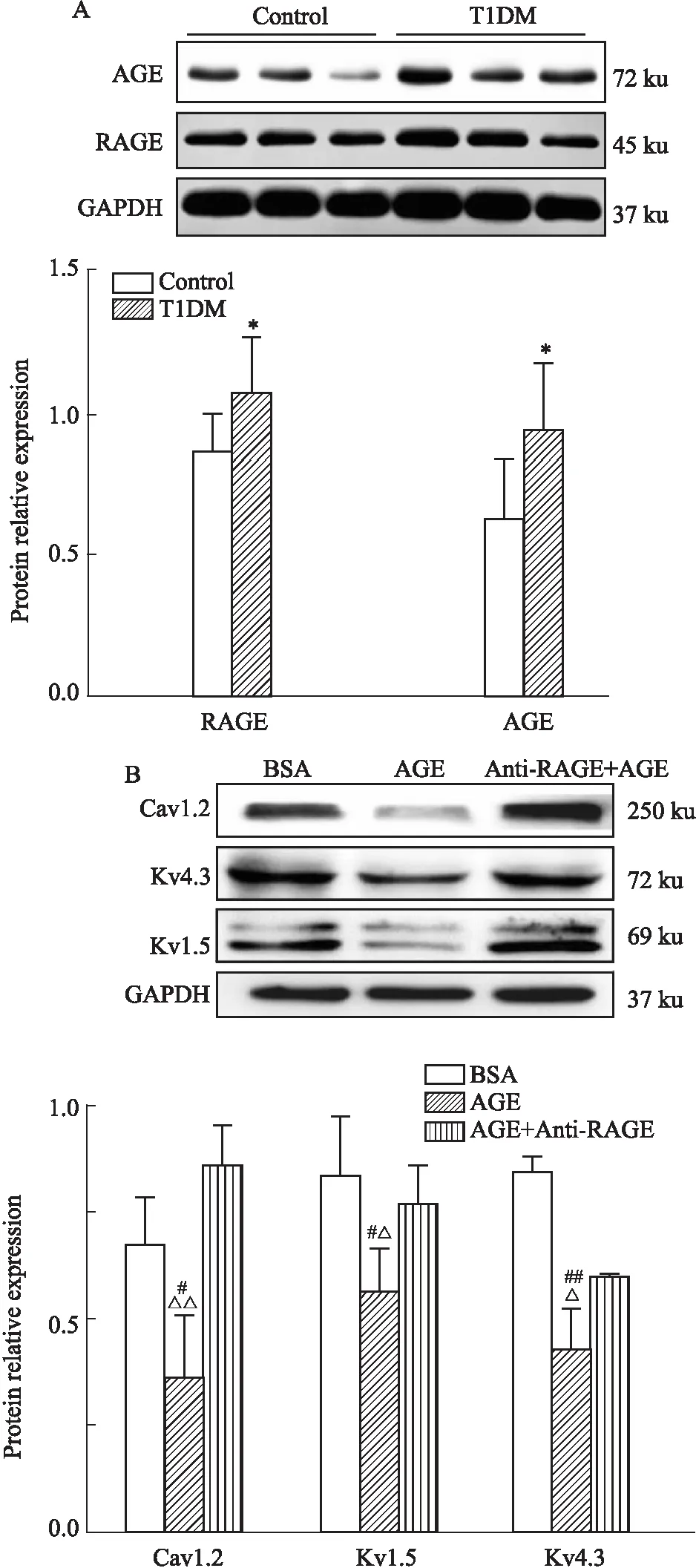
Fig 5 Expression of AGE and RAGE proteins in diabetic mice and channel proteins in HL-1 cells induced by AGE/Anti-RAGE
Ito是心房肌细胞早期复极的主要离子流,在动作电位1相及2相复极中起作用。糖尿病小鼠心房肌细胞离子通道的研究主要集中在小电导钙激活钾通道及钠通道电流[12-13],对心房肌细胞主要的复极电流Ito的研究较少。本研究结果提示,糖尿病小鼠心房肌细胞Ito电流密度明显降低,相关蛋白Kv4.3表达明显低于对照组;其激活及复活曲线无明显变化,但失活加快。
IKur在大多数物种中仅出现于心房肌细胞中,是一种心房特异性电流,也是治疗房性心律不齐的主要靶标[14]。目前,Ikur与房颤相关的研究逐渐引起广泛关注,但关于房颤与Ikur重塑的研究结果不一。与窦律患者相比,慢性房颤患者Ikur电流及Kv1.5蛋白表达均降低;然而,也有研究表明Ikur及Kv1.5蛋白表达在房颤过程中并未改变[15-16]。本研究结果提示,糖尿病小鼠心房肌细胞Ikur电流密度与对照组相比明显降低,主要的编码蛋白Kv1.5表达明显低于对照组。
然而,糖尿病小鼠心房肌细胞离子通道的改变机制还不清楚。晚期糖基化终末产物AGE及其受体RAGE蛋白表达水平在糖尿病患者体内明显积累,参与心律失常并发症的发生[17];既往研究表明,高糖能诱导HL-1心房肌细胞AGE和ROS的生成,以及动作电位时程延长[18],但目前关于AGE与HL-1细胞主要通道蛋白作用机制尚不明确。本研究结果表明,1型糖尿病小鼠心房肌组织AGE、RAGE蛋白表达水平明显增加。随后,在细胞层面上,采用Anti-RAGE预处理HL-1细胞结果提示,糖尿病可通过晚期糖基化终末产物及其受体直接作用于细胞导致心房肌细胞通道相关编码蛋白Cav1.2、Kv4.3及Kv1.5表达水平出现改变,这为临床上治疗糖尿病心房颤动提供了潜在治疗靶点。
综上所述,本研究发现糖尿病小鼠心房肌细胞晚期糖基化终末产物及其受体明显积累,动作电位时程明显延长,ICa,L、Ito及Ikur电流密度明显下调,Ito、ICa,L失活动力学加快,同时伴通道编码蛋白Cav1.2、Kv4.3、Kv1.5表达降低;另外,RAGE拮抗剂预处理可以逆转AGE诱导HL-1细胞离子通道蛋白表达下调。但在动物模型上,糖尿病是否能通过AGE导致离子通道电流发生改变,有待进一步阐明。阐明上述相关机制将进一步明确AGE/RAGE与糖尿病心房颤动的关系,为预防和治疗糖尿病心房颤动的发生发展提供了新的理论依据。
——从一道浙江选考生物学试题谈起

