蛇葡萄素对人宫颈癌SiHa细胞增殖、周期及凋亡的影响
方佳慧,桂 春,张 超,熊晓妹,李永华,张秀桥
(湖北中医药大学药学院,湖北 武汉 430065)
宫颈癌是女性常见的恶性肿瘤之一,其发病率仅次于乳腺癌,占女性癌症的第二位[1]。目前在临床上主要通过铂类抗癌药物为主的化疗手段来治疗宫颈癌,但部分患者会产生铂类药物耐药性及其他不良反应,从而影响药物治疗效果[2]。蛇葡萄素(ampelopsin,AMP)在大叶蛇葡萄等药材中含量较高[3],在湖北西部地区资源较丰富,具有降血糖、降血脂、保肝、抗氧化和抗肿瘤等多种药理作用[4]。近年来[5],研究表明,AMP具有多种抗肿瘤作用,如乳腺癌、肝癌、前列腺癌、肺癌、结肠癌等,但对宫颈癌方面研究尚少,作用机制不明确。课题组前期开展了大叶蛇葡萄提取物抗肿瘤活性及作用机制的初步研究,结果显示,AMP对宫颈癌Hela细胞的增殖有较好的抑制作用。为进一步明确AMP抗宫颈癌作用及其机制,本文选取人宫颈癌SiHa细胞,从细胞增殖、周期和凋亡及其可能机制展开研究,为天然药物治疗宫颈癌提供一定的科学依据,对后期抗癌新药的开发利用奠定基础。
1 材料与方法
1.1 材料
1.1.1细胞株 人宫颈癌SiHa细胞(批号:CL-0210),购自中国典型培养物保藏中心。
1.1.2药物与试剂 AMP,购自上海源叶生物公司(批号:S06J6L1,检测纯度≥98%);MEM培养基,购自武汉普诺赛生命公司;MTT购自美国Amresco公司;胎牛血清(FBS)购自美国Thermo公司;胰蛋白酶及青霉素-链霉素购自美国Hyclone公司;BCA试剂盒购自美国Biosharp公司;Hoechst33258和碘化丙啶(PI)购自美国Sigma公司;Annexin V-FITC/PI试剂盒购自江苏凯基生物公司(批号:KGA108);Rh-123染液购自上海碧云天生物公司(批号:C2007);HRP标记的山羊抗兔二抗、LC3抗体购自美国Proteintech公司;GAPDH、Bcl-2、Cleaved-caspase-3、Bax抗体购自美国CST公司。
1.1.3仪器 CO2培养箱(英国RS Biotech公司);酶标仪和电泳仪(美国Bio-Rad公司);荧光倒置显微镜(日本Olympus公司);流式细胞仪(美国BD公司);化学发光系统(美国Proteinsimple公司)。
1.2 方法
1.2.1细胞培养 宫颈癌SiHa细胞用含10% FBS和1%青霉素-链霉素的MEM培养基,置于37 ℃、5% CO2细胞培养箱中培养,每隔2-3 d传代1次。取对数生长期细胞用于实验。
1.2.2MTT检测细胞增殖抑制 细胞以3×103个/孔接种于96孔板。实验设AMP组、对照组和空白组。AMP组每孔加入100 μL不同浓度培养基稀释液(10、20、40、80、160、320 μmol·L-1),对照组含细胞和培养基,空白组含培养基,每组设置4个复孔。药物分别干预24、48、72 h后,每孔加入MTT试剂(5 g·L-1)20 μL继续孵育4 h,每孔加入150 μL DMSO避光溶解结晶,490 nm波长下用酶标仪测量各孔吸光度(A值),并计算细胞增殖抑制率及IC50。
细胞增殖抑制率/%=[1-(A给药组-A空白组)/(A对照组-A空白组)]×100%
1.2.3Hoechst33258染色法观察细胞形态变化 细胞以2×105个/孔接种于6孔板,培养24 h后弃去旧培养基,设对照组和AMP(10、20、40、80 μmol·L-1)药物组。干预一定时间后,PBS润洗细胞后固定(甲醇 ∶冰醋酸=3 ∶1,500 μL)12 min,每孔加入500 μL浓度为5 mg·L-1的Hoechst33258染色液,室温避光染色30 min后弃去染色液,PBS润洗3遍,自然晾干后避光条件下置于荧光倒置显微镜下用紫外光进行观察,并拍照记录。上述实验重复3次。
1.2.4Annexin V-FITC/PI双染法检测细胞凋亡率 细胞培养接种同“1.2.3”。设对照组、AMP(10、20、40、80 μmol·L-1)药物组、阴性对照组(不加染料)、PI单染组及FITC单染组,干预一定时间后收集细胞,1 500 r·min-1离心5 min,重复2次。加入500 μL Binding buffer重悬细胞,Annexin V-FITC和PI染液各5 μL,轻轻混匀,避光室温染色5-15 min,1 h内上流式细胞仪检测。上述实验重复3次。
1.2.5PI单染法检测细胞周期 细胞培养接种同“1.2.3”。设置对照组、AMP(20、40、80 μmol·L-1)药物组、阴性对照组(不加PI)细胞,干预一定时间后,PBS重悬离心后,加入2 mL细胞固定液(-20 ℃预冷的75%乙醇),固定12 h,1 500 r·min-1离心5 min,重复2次。每管加入Triton X-100、Rnase A、PBS及 PI混合溶液1 mL,常温染色30 min,流式细胞仪FL2通道进行细胞周期检测。上述实验重复3次。
1.2.6罗丹明123检测线粒体膜电位的变化 细胞培养接种同“1.2.3”。设置对照组和AMP(10、20、40、80 μmol·L-1)药物组,药物干预24 h后收集细胞,1 500 r·min-1离心5 min,重复2次,每管加2 mL浓度为1 mg·L-1Rh-123染色液,37 ℃避光染色30 min后,于1 h 内上流式细胞仪检测。上述实验重复3次。
1.2.7Western blot检测凋亡及相关蛋白的表达 细胞培养见“1.2.3”。设置对照组和AMP(10、20、40、80 μmol·L-1),干预一定时间后,加入裂解液裂解细胞,冷冻离心收集上清液,BCA试剂盒进行蛋白定量。上样后凝胶电泳,湿转膜法转膜,封闭1.5 h,4 ℃孵育一抗过夜。次日加入二抗室温孵育1 h,TBST洗涤3次,加入ECL化学发光液,将膜置于全自动化学发光分析仪中显影并分析结果。上述实验重复3次。
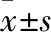
2 结果
2.1 AMP抑制SiHa细胞增殖如Fig 1所示,与对照组相比,AMP分别作用SiHa细胞24、48、72 h时后,在浓度40-320 μmol·L-1内,随着药物浓度的升高抑制率逐渐增强;当AMP浓度分别为40、80、160 μmol·L-1时,随着作用时间的延长抑制率逐渐增强;其中AMP作用SiHa细胞24、48、72 h的IC50值分别为(46.91±2.55)μmol·L-1、(44.22±1.98)μmol·L-1、(40.33±0.54)μmol·L-1。由结果可知,与对照组相比,AMP对SiHa细胞增殖具有明显的抑制作用(P<0.5),且呈现浓度和时间依赖性。
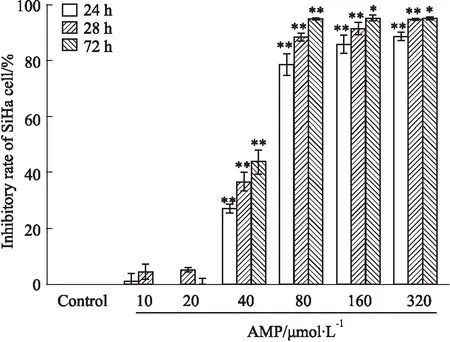
Fig 1 Effect of AMP on proliferation of SiHa n=3)
2.2 AMP对SiHa细胞凋亡的影响
2.2.1倒置显微镜观察AMP对SiHa细胞形态的影响 如Fig 2所示,对照组细胞形态完整,呈多边形;随着AMP浓度的增加(10、20、40、80 μmol·L-1,作用24 h)或作用时间的延长(AMP浓度为80 μmol·L-1,分别作用6、12、24、48 h),细胞数量逐渐减少,细胞间间隙增大,细胞皱缩、变圆,高浓度组细胞碎裂,说明AMP作用于SiHa细胞后,对细胞的生长形态具有显著的影响,且形态学的变化程度与药物浓度或作用时间呈正相关。
2.2.2Hoechst33258染色法观察AMP对SiHa细胞凋亡的影响 在荧光倒置显微镜下观察如Fig 3所示,对照组SiHa细胞形态完整、染色均匀,细胞核内染色质呈淡蓝色荧光;当AMP作用时间为24 h,浓度依次为10、20、40、80 μmol·L-1,细胞核内染色质浓缩逐渐增多,碎裂的亮蓝色染色质逐渐增多,出现凋亡小体;当AMP浓度为80 μmol·L-1,作用时间分别为6、12、24、48 h,与对照组比较,细胞核内染色质浓缩增多,碎裂的亮蓝色染色质增多。结果表明,AMP可诱导SiHa细胞凋亡。
2.2.3Annexin V-FITC/PI双染法检测细胞凋亡率 如Fig 4所示,当不同浓度AMP分别作用于SiHa细胞24 h后,与对照组相比,随着AMP浓度的升高凋亡率逐渐增大(P<0.05);当80 μmol·L-1的AMP分别作用SiHa细胞6、12、24 h后,与对照组相比,随着AMP作用时间的延长凋亡率逐渐增大(P<0.05),具有时效和量效关系。结果进一步表明AMP可诱导SiHa细胞凋亡。
2.3 AMP对SiHa细胞周期的影响如Fig 5、Tab 1所示,当不同浓度AMP分别作用于SiHa细胞24 h时,在0-40 μmol·L-1浓度范围内,G0/G1期分布比例呈上升趋势,S期分布比例呈下降趋势,在40-80 μmol·L-1浓度范围内,G0/G1期分布比例下降,S期分布比例上升,细胞周期分别阻滞在S期和G2/M期;当AMP浓度为80 μmol·L-1,随着给药时间的延长,细胞周期阻滞在G2/M期,并呈一定的时间依赖性(P<0.05)。结果证明AMP对SiHa细胞周期存在一定的影响。
2.4 Rh-123染色检测线粒体膜电位变化如Fig 6所示,当不同浓度AMP分别作用于SiHa细胞24 h后,与对照组相比,随着AMP浓度的升高,线粒体膜电位逐渐降低(P<0.05),具有一定的量效关系。结果表明AMP对SiHa线粒体膜电位有一定影响,其诱导凋亡可能与线粒体途径相关。
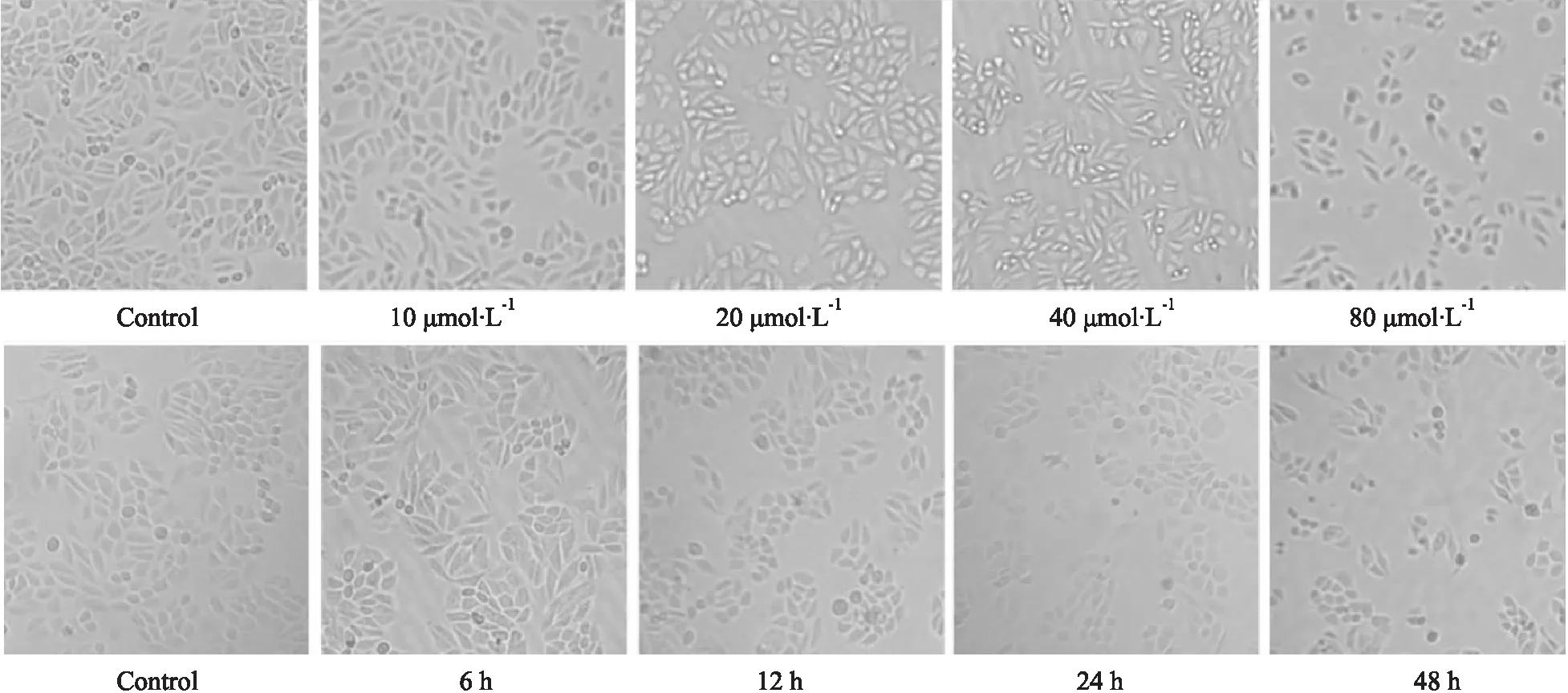
Fig 2 Effect of AMP on cell morphology of SiHa cells(×100)
Fig 3 Effect of AMP on nuclear morphology change of SiHa cells(×200)
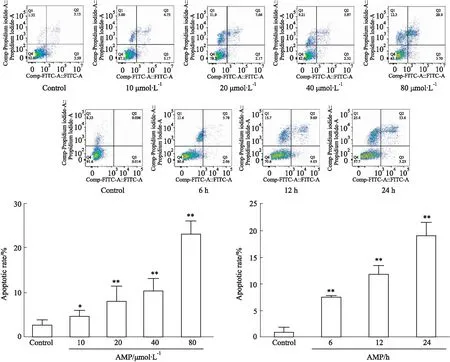
Fig 4 Effect of AMP on apoptosis of SiHa n=3) *P<0.05, **P<0.01 vs control
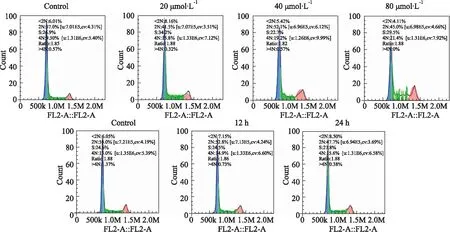
Fig 5 Effect of AMP on cell cycle distribution of SiHa n=3)
Tab 1 Percentage of cell cycle distribution of SiHa cells treated-with 80 μmol·L-1 AMP n=3)
2.5 Western blot检测AMP对SiHa细胞Bcl-2、Bax及Cleaved-caspase-3蛋白表达的影响如Fig 7所示,当不同浓度AMP作用于SiHa细胞24 h后,与对照组相比,Bcl-2/Bax和Cleaved-caspase-3的表达水平逐渐上升,具有浓度依赖性;当80 μmol·L-1AMP分别干预6、12、24 h时,Bcl-2/Bax和Cleaved-caspase-3的表达水平逐渐上升,具有时间依赖性(P<0.05)。结果表明AMP激活了凋亡关键蛋白caspase-3,上调线粒体膜上抗凋亡蛋白Bcl-2表达,下调线粒体膜上促凋亡蛋白Bax表达;同时进一步表明AMP可能通过线粒体途径诱导SiHa细胞凋亡。
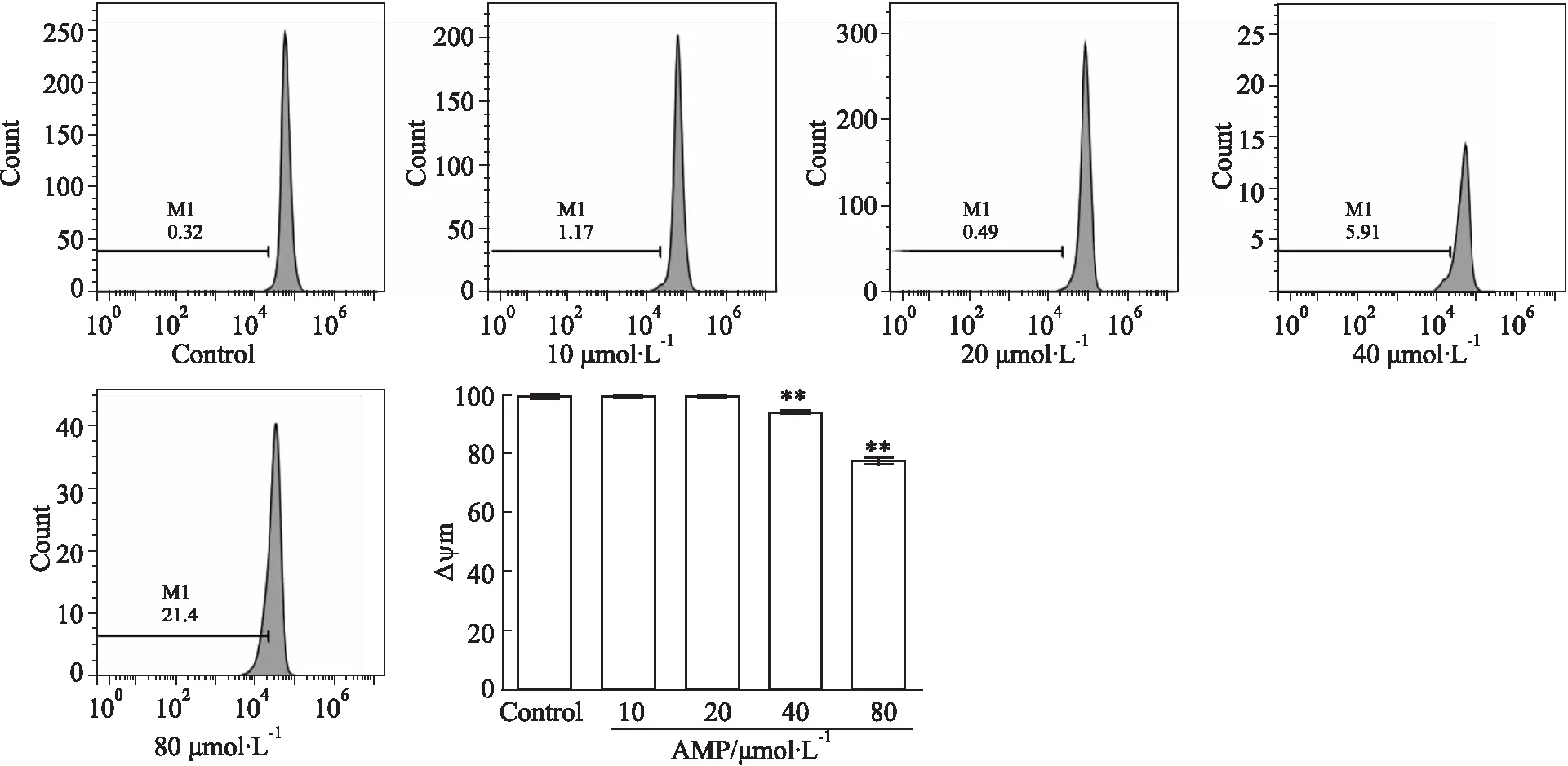
Fig 6 Effect of AMP on mitochondrial transmembrane potential of SiHa n=3)
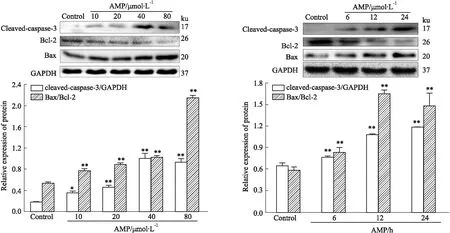
Fig 7 Effect of AMP on expression of Bax, Bcl-2 and cleaved-caspase-3 in SiHa n=3)
3 讨论
AMP是一种主要提取自葡萄科蛇葡萄属植物的天然黄酮类单体化合物,已有研究报道其对多种癌症具有抗肿瘤活性,如AMP可以通过线粒体途径诱导肝癌HepG2细胞的凋亡[8],AMP通过ROS的生成和内质网应激诱导乳腺癌细胞凋亡[9],课题组前期研究AMP对HeLa细胞具有抗肿瘤作用[6-7]。本研究首先通过MTT法检测发现,AMP能显著抑制宫颈癌SiHa细胞增殖,采用Hoechst33258染色法、AnnexinV-FITC/PI双染法及Western blot法从细胞形态学、凋亡率及凋亡标志蛋白方面考察,结果提示,AMP可诱导SiHa细胞凋亡。为进一步探讨AMP抗宫颈癌可能的作用机制,本实验开展细胞周期和线粒体膜电位研究,PI单染法发现AMP可使细胞阻滞在S期和G2/M期。细胞周期阻滞是指细胞周期停滞在检查点,而检查点的改变可导致细胞异常增殖。细胞的复制与细胞周期相关,药物诱导细胞周期中S期阻滞不能改变细胞周期状态,绝大多数癌细胞依赖G2/M检查点来调节细胞复制,阻滞细胞于G2/M期的药物对细胞复制起到了抑制作用,提示G2/M期阻滞药物可能是天然化合物治疗和预防疾病的潜在候选药物[10]。Cyclin家族蛋白为细胞周期调控蛋白,其中cyclin A和cyclin B主要调控S期或M期,cyclin D 和cyclin E参与调控G1期向S期转变。本研究中结果显示,随着AMP浓度的升高,细胞周期分别阻滞于S期和G2/M期,可能与S期和G2/M期检查点相关的Cyclin家族蛋白表达水平变化有关。课题组在后期研究中,可开展相关周期蛋白的研究,进一步确定AMP对SiHa细胞周期阻滞的作用机制。Rh-123染色法检测显示随着药物作用浓度的升高线粒体膜电位逐渐降低,结果提示AMP可诱导SiHa细胞凋亡的作用机制可能与细胞周期及线粒体途径相关。
线粒体途径是由Bcl-2家族蛋白通过控制线粒体通透性来调节细胞凋亡,Bcl-2定位于线粒体外膜,为抑制凋亡标志蛋白;Bax为Bcl-2共沉淀对应蛋白,具有促进凋亡发生的作用[11]。当Bax/Bcl-2比值升高时,促进细胞凋亡,相反抑制细胞凋亡[12]。为进一步证实AMP可通过线粒体途径诱导SiHa细胞凋亡,本文检测了与细胞凋亡相关的代表性Bcl-2/Bax的关键蛋白,实验结果显示Bcl-2蛋白表达水平均下调,Bax蛋白表达水平均上调,提示AMP可以通过激活线粒体途径发挥诱导细胞凋亡的作用。
综上所述,AMP可抑制SiHa细胞增殖,阻滞细胞周期,可能通过抑制线粒体途径诱导细胞凋亡。该研究表明蛇葡萄素在宫颈癌的治疗及临床应用存在一定的应用前景,为进一步开发其药用潜在价值,后续将进一步进行体内相关研究。

