桃叶珊瑚苷通过激活ERβ途径抑制心肌细胞凋亡
李春晓,张璐莎,张丽媛,马璐璐,王倩怡,方乐玉,杨文杰,孙 伟,冷雨泽,陈 璐,王 虹
(天津中医药大学中西医结合学院、方剂学教育部重点实验室、天津市中药药理学重点实验室、天津中医药大学中医药研究院,天津 301617)
抑制心肌细胞凋亡发挥抗心肌缺血损伤从而改善急性心肌梗死后心功能的作用,其部分作用机制与ERβ通路的激活有关。
缺血性心脏病(ischemic heart disease,IHD)是全球死亡率最高的疾病之一[1]。急性心肌梗死(acute myocardial infarction,AMI)能够导致不可逆的心肌细胞损伤或继发的心肌供血不足。虽然现有的治疗方法能够改善冠状动脉血流,增加缺血区域的血液供应从而达到治疗效果[2],但其发病率和死亡率依然居高不下。氧化应激损伤是缺血性心脏病的主要发病机制[3],活性氧的积累导致心肌细胞的坏死和凋亡,其中细胞凋亡贯穿心肌梗死发生的整个病程[4],因此减少心肌梗死后的心肌细胞凋亡对限制心肌梗死患者的组织损伤程度及改善心脏功能具有重要意义。
雌激素受体β(estrogen receptor β,ERβ)在调节正常生理、衰老和多种疾病中发挥重要作用[5]。ER最典型的功能为配体激活的转录因子,介导激素调节的组织和器官中的基因转录[6]。研究表明[7],绝经后妇女急性心肌梗死的增加可能与体内雌激素水平下降和ERβ表达下降有关。在心肌梗死中,ERβ通过调节PI3K/AKT信号通路改善急性心肌梗死患者的心功能及MI后的心肌纤维化[8-9],是预防及治疗围绝经期综合征患者急性心肌梗死的潜在靶点之一。
桃叶珊瑚苷(aucubin,AU)又称β-D-吡喃葡萄糖苷,是杜仲、车前草、地黄等中药材的有效成分之一。近年来研究表明,AU具有抗氧化、抗炎、抗纤维化等多种药理作用[10-11],对免疫、心脑血管、神经系统均有保护作用,但其对心肌细胞凋亡的作用机制尚不清楚。本课题组前期研究发现AU具有植物雌激素样作用[12],能够激活雌激素受体。本研究旨在探讨AU对心肌凋亡的影响及其机制,为AU防治缺血性心脏病提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1细胞与动物 大鼠H9c2,购于美国ATCC公司,8周龄雄性C57BL/6J小鼠购自北京维通利华实验动物研究中心,许可证号:SCXK(京)2016-0006。
1.1.2药物与试剂 AU购于成都曼斯特生物科技有限公司(批号:DST190907-004),纯度为99.93%,分子量为346.33,分子式:C15H22O9;肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α,货号:315-01A)购于PeProTech;放线菌酮(Cycloheximide, CHX,货号:M4881)、MTT(货号:M8180)购于Solaibro;MPP dihydrochloride(货号7A/198343)、(R,R)-THC(货号:6A/192678)购于tocris公司;DCFH-DA粉末(货号:D6883)购于Sigma;DMEM(货号:SH30022.01)购于Hyclone;胎牛血清(FBS,货号:04-001-1ACS)、双抗(青链霉素,货号:03-031-1B)、胰蛋白酶(货号:03-052-1A)购于Biological Industries;β-Actin (3E5) Rabbit mAb(货号:4970)、caspase-3 Antibody(货号:9662)、Akt Antibody(货号:4691)、 p-Akt Antibody(货号:4060)、Bcl2 Antibody(货号:3498)、Bax Antibody(货号:2772)购于CST;Goat anti-Rabbit IgG (H+L) Alexa Fluor®594 conjugate(货号:A-11012)购于Invitrogen;In Situ Cell Death Detection Kit(货号:11684817910)购于Roche。
1.2 方法
1.2.1动物及给药 小鼠在体实验经天津中医药大学伦理委员会(中国天津)批准,在体研究方法均按照指南操作。所有动物实验均按照美国指南(NIH出版物#85-23,1985年修订)和赫尔辛基宣言的原则进行。将小鼠饲养于温度(22±2) ℃和湿度55%±5%房间中,12 h照明/12 h黑暗昼夜交替,在进行实验前适应性喂养1周。研究中使用的AU为10 mg·kg-1·d-1,辛伐他汀作为阳性药,使用剂量为10 mg·kg-1·d-1。将AU和辛伐他汀溶解在生理盐水中灌胃给药。
1.2.2手术 腹腔注射三溴乙醇麻醉小鼠,结扎左前降支冠状动脉建立急性MI模型。手术后将小鼠随机分为4组:假手术组,模型(生理盐水)组,AU组和Sim组。从d 0开始,将小鼠随机分组给药。
1.2.3超声心动 在术前1 d,术后7、14和28 d,用Vevo 2100TM高分辨率超声生物显微镜(VisualSonics Inc.,Canada)和Vevo分析软件(Vevo 2.2.3,[VisualSonics Inc.])进行超声心动图测量。麻醉小鼠后,记录M-模式短轴图像和B-模式长轴图像。测量左心室收缩末期容积(LVESV)和舒张末期容积(LVEDV)。计算左心室射血分数(LVEF)(LVEF=[LVEDV-LVESV]/LVEDV)。
1.2.4Masson染色 在造模28 d超声心动图分析后取材,用体积分数0.04多聚甲醛固定后包埋在石蜡中,并在缝合线下方500 mm距离处切片。通过Masson's Trichrome染色评估心脏组织的梗死面积。
1.2.5细胞培养 细胞培养所用培基为DMEM加入体积分数0.1的胎牛血清,及体积分数0.01的青链霉素混匀,4 ℃存放。细胞于体积分数0.05的CO2、0.95空气、37 ℃、饱和湿度的培养箱内培养。细胞融合至0.8~0.9时进行传代。
1.2.6细胞活力检测 正常培养细胞融合至0.8时,以8×103个细胞每孔接种于96孔板中,分别为Control(0.1%DMSO)组;model组(10 μg·L-1TNF-α,5 mg·L-1CHX,0.1%DMSO);AU 10 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 10 μmol·L-1);AU 20 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1);AU 50 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 50 μmol·L-1),共5组,每组6个复孔。造模同时用AU处理心肌细胞6 h后进行MTT检测。MTT使用浓度为0.5 g·L-1,每孔加入20 μL并在37 ℃下孵育4 h。除去含MTT的培养基后,每孔加入200 μL DMSO,用酶标仪检测490 nm处各孔的OD值。
1.2.7IncuCyte活细胞成像系统 H9c2细胞以含体积分数0.1的FBS的DMEM完全培养基常规培养,当细胞生长覆盖到培养皿的0.9后用胰酶消化,细胞计数后,以8×103个细胞每孔接种于96孔板中。用显微镜观察细胞情况后置于培养箱中培养。将实验分为6组,每组3个复孔,分别为分别为Control(0.1% DMSO)组;model组(10 μg·L-1TNF-α,5 mg·L-1CHX,0.1%DMSO);AU 20 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1);E2组(10 μg·L-1TNF-α,5 mg·L-1CHX,E2 10 nmol·L-1);AU+MPP组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,MPP 100 nmol·L-1);AU+MPP组(10 μg·mL-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,MPP 100 nmol·L-1);AU+(R,R)-THC组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,(R,R)-THC 100 nmol·L-1)。细胞培养24 h后,细胞贴壁良好,铺展生长,此时吸弃培养液,置换成体积分数0.01的FBS的完全培养液进行血清饥饿。血清饥饿24 h后,依据上述分组置换成含有TNF-α及CHX的的完全培养液中。造模6 h后,进行TUNEL染色,置于Incucyte中拍照。
1.2.8Western blot 正常培养细胞融合至0.8时,以2.4×105个细胞每孔接种于6孔板中,分别为Control(0.1% DMSO)组;model组(10 μg·L-1TNF-α,5 mg·L-1CHX,0.1%DMSO);AU 20 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1);E2组(10 μg·L-1TNF-α,5 mg·L-1CHX,E2 10 nmol·L-1),共4组,每组3个复孔。培养24 h待细胞贴壁生长良好后,按分组加入培基,造模给药6 h后提取总蛋白。用BCA法进行蛋白浓度测定,取等量蛋白进行SDS-PAGE,半干法转膜,与相应一抗二抗结合反应后,用化学发光法检测抗原抗体结合区带。用凝胶成像分析仪进行电泳条带的拍照与分析。实验中以β-actin为内参,分别检测了caspase-3、Bax、Bcl2、p-Akt、Akt。
1.2.9TUNEL染色 正常培养细胞融合至0.8时,以8×103个细胞每孔接种于96孔板中,将实验分为6组,每组3个复孔,分别为分别为Control(0.1% DMSO)组;model组(10 μg·L-1TNF-α,5 mg·L-1CHX,0.1%DMSO);AU 20 μmol·L-1组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1);E2组(10 μg·L-1TNF-α,5 mg·L-1CHX,E2 10 nmol·L-1);AU+MPP组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,MPP 100 nmol·L-1);AU+MPP组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,MPP 100 nmol·L-1);AU+(R,R)-THC组(10 μg·L-1TNF-α,5 mg·L-1CHX,AU 20 μmol·L-1,(R,R)-THC 100 nmol·L-1)。细胞培养24 h后,细胞贴壁良好,铺展生长,此时吸弃培养液,24 h后置换成含有TNF-α(10 μg·L-1)、CHX(5 mg·L-1)的完全培养液6 h后使用In Situ Cell Death Detection Kit试剂盒进行染色,DAPI复染细胞核。
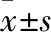
2 结果
2.1 AU能够改善心肌梗死小鼠的心功能超声心动检测术前1 d,术后给药7 d、14 d和28 d左心室短轴缩短率和射血分数。结果显示,心肌梗死前组间的短轴缩短率和射血分数无显着差异,两者均具有正常的心肌功能。心肌梗死后,心肌梗死的C57BL/6小鼠随机分组,在d 7、14和28进行相关指标的检测。结果显示,模型组、AU组及阳性药组相较于假手术组的EF%和FS%明显降低。给药后7 d,AU及阳性药组与模型组之间没有显着差异。但给药后d 14、28,AU组给药效果良好,明显优于模型组(Fig 1A, B)。连续给药28 d后,对来自小鼠的心脏组织进行Masson染色。结果显示正常心室结构完整,心肌纤维化不明显,梗死部位无蓝色,无心室壁变薄。在模型组中,心室壁严重梗塞,纤维化,变薄和心室腔扩大,纤维化程度占整个心室壁的约40%~50%。非梗塞区域有松散的组织细胞和增加的空隙。给药组与模型组相比,给药组的心室壁纤维化及心室腔的变化得到改善(Fig 1C, D)。
2.2 AU能够减少急性心肌梗死小鼠心肌细胞凋亡连续给药28 d后,对来自小鼠的心脏组织进行TUNEL染色。心肌细胞的凋亡可以通过TUNEL+/DAPI双色荧光重合信号确认,TUNEL+ cell为红色,DAPI为蓝色。结果显示AU给药组与生理盐水组相比,TUNEL+(red)信号明显减少(Fig 2)。
2.3 AU提高TNF-α/CHX损伤模型中的心肌细胞活力课题组前期结果表明,TNF-α/CHX能够成功诱导心肌细胞损伤,为了确定药物浓度,本研究采用MTT法检测不同浓度下AU对模型中细胞活力的影响,结果显示AU在20 μmol·L-1及50 μmol·L-1时,能够明显在TNF-α/CHX损伤模型中增加细胞活力,差异具有统计学意义(Fig 3)。预处理24 h能够增强其保护作用。
2.4 AU能够减少TNF-α/CHX损伤模型中的细胞凋亡为了进一步证明AU的抗凋亡作用,本研究采用Western blot法检测TNF-α/CHX损伤模型中6 h时caspase-3、Bcl2、Bax、Akt以及p-Akt蛋白的表达,结果显示造模6 h时,模型组与对照组相比,caspase-3蛋白表达增加,差异具有统计学意义;AU组与模型组相比,caspase-3蛋白表达减少,Bcl2/Bax比例上调,其结果差异具有统计学意义(Fig 4)。
2.5 AU能够促进ERα以及ERβ的表达确定AU的抗凋亡作用后,本研究进一步对AU如何影响凋亡做了进一步的探讨,采用Western blot方法检测AU对心肌细胞中ERα以及ERβ的表达的影响,结果显示AU能够明显促进心肌细胞中ERα以及ERβ的表达,差异具有统计学意义(Fig 5)。
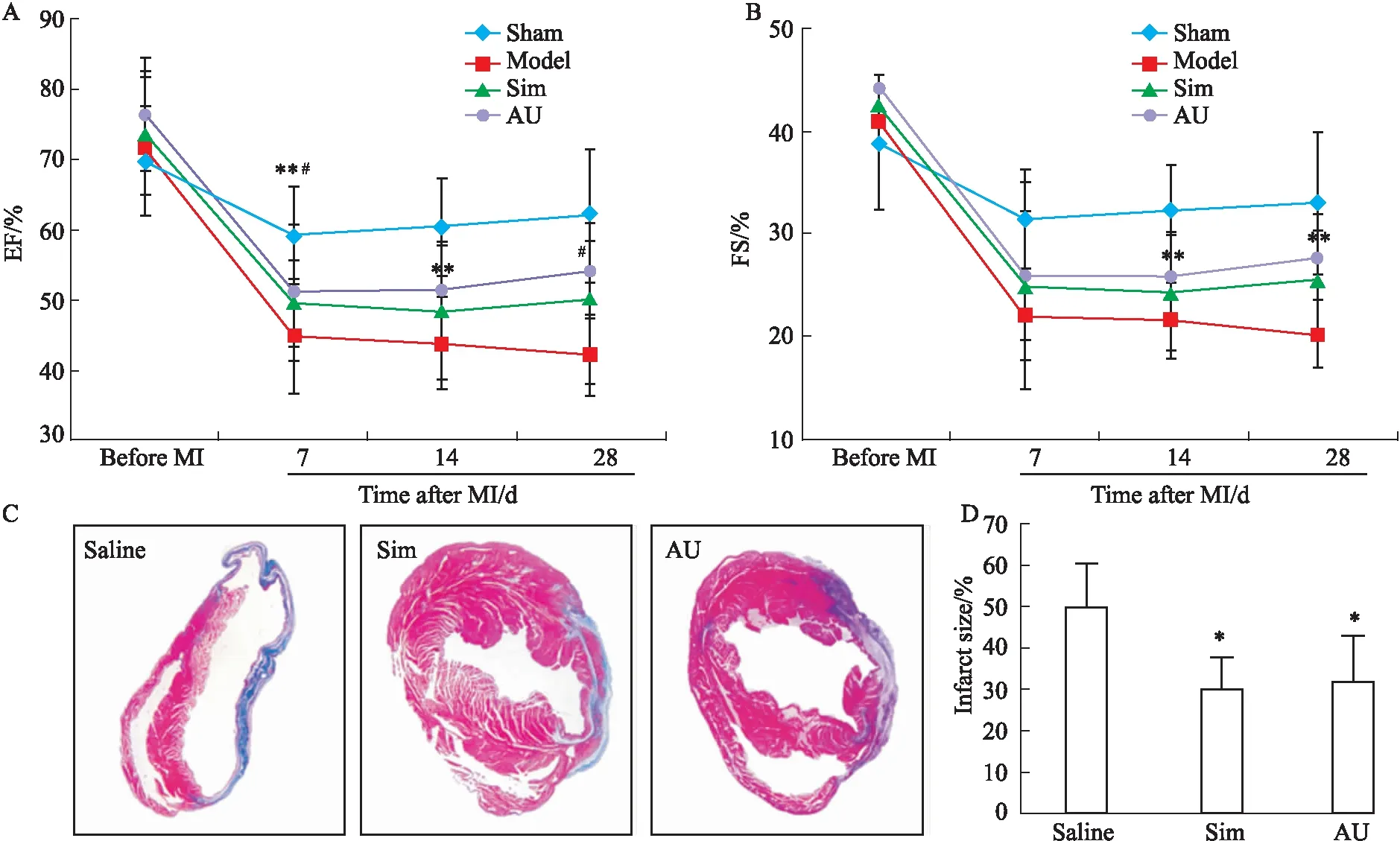
Fig 1 AU improves cardiac function and reduces infarct size after MI
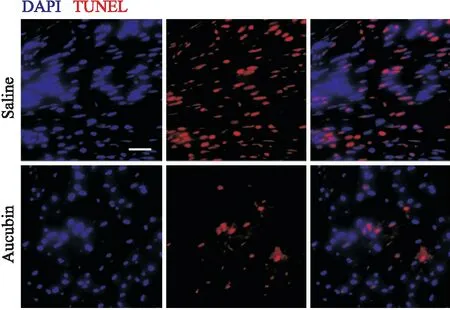
Fig 2 AU inhibits apoptosis of myocardial cells after MI
2.6 ERβ抑制剂能够减弱AU的抗凋亡作用为了探讨AU是否通过激活雌激素受体抑制细胞凋亡,本研究采用TUNEL法检测ERα的抑制剂MPP和ERβ的抑制剂(R,R)-THC对给药后TNF-α/CHX损伤模型中凋亡的影响。结果显示, MPP对AU的心肌细胞保护作用无明显影响;而加入(R,R)-THC后,细胞凋亡数量较AU组有明显上升,其结果差异具有统计学意义(Fig 6)。本研究证明,AU能够激活ERβ发挥心肌保护作用。
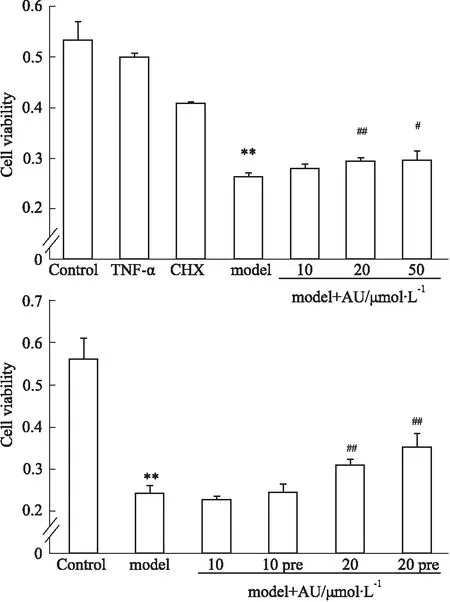
Fig 3 AU improves myocardial cell viability against TNF-α/CHX treatment
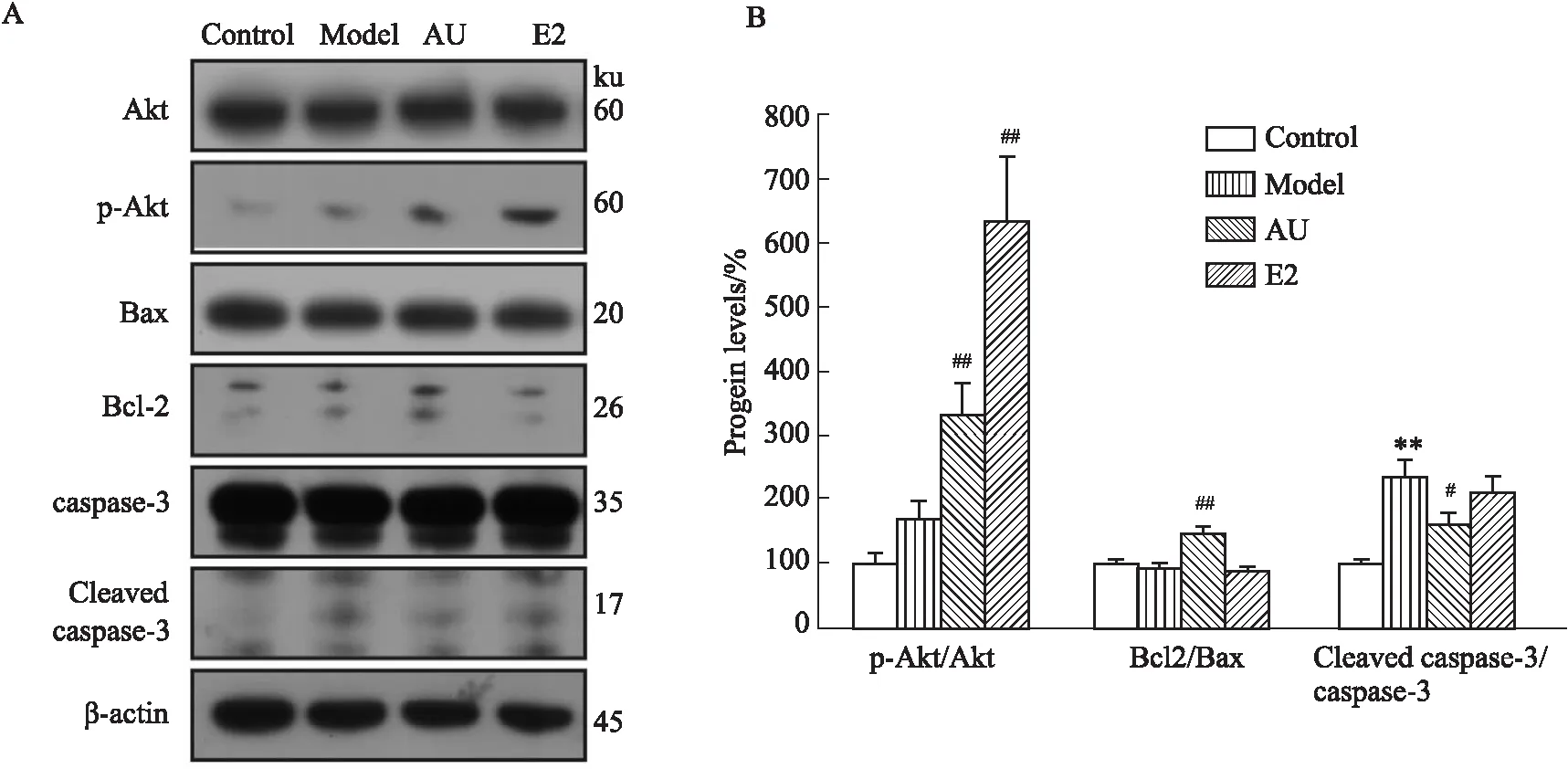
Fig 4 AU inhibits apoptosis induced by TNF-α/CHX
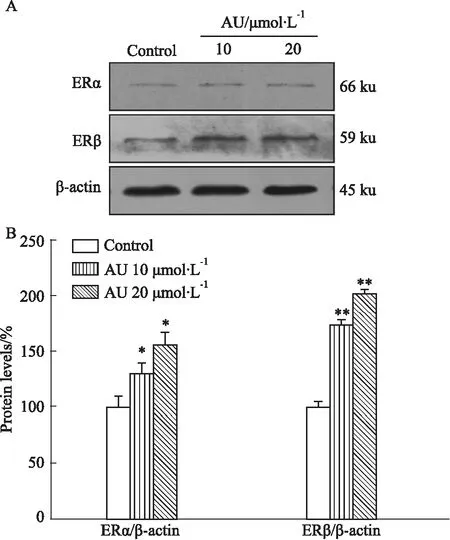
Fig 5 AU promotes ERα and ERβ expression
3 讨论
AU是杜仲等中药的活性成分之一,本研究发现AU可使ERβ表达升高,抑制心肌细胞凋亡,并且加入ERβ抑制剂可阻断AU的抗凋亡作用。表明AU可以通过激活ERβ通路,发挥抗心肌缺血损伤从而改善急性心肌梗死后心功能的作用。
植物雌激素是对具有雌激素相似结构,能够作用于雌激素受体的一类化合物的统称。课题组前期研究证实AU是一种具有植物雌激素样作用的小分子,能够激活雌激素受体[12]。雌激素受体ER于发现于1958年,其中ERβ分布于卵巢、中枢神经系统、心血管系统、肺、结肠、肾脏和免疫系统中[13]。心血管系统功能异常是临床绝经期综合征表现的重要方面之一,Zhang等[9]研究发现,Tg-ERβ转基因小鼠的心肌组织Ⅰ型胶原、α-SMA、TGF-β mRNA的表达水平明显低于野生型小鼠,说明ERβ有助于抑制心肌梗死后心肌纤维化和重塑过程,提高心肌抗纤维化能力。同时,Wang也研究发现将ERβ敲除后,PI3K和Akt磷酸化水平下调,caspase-3和caspase-8的表达增加,Bcl-2蛋白表达水平降低,证明ERβ可能是通过调节PI3K/Akt信号通路改善急性心肌梗死患者的心功能[8]。
本研究采用TNF-α和CHX共同诱导心肌细胞损伤模型,探讨了AU抗心肌细胞损伤作用及其与ER信号通路的相关性。TNF-α能够与膜受体TNFR I或TNFR II结合,激活凋亡通路,同时刺激TNF抗凋亡因子(TNF apoptosis protection fraction,TAPF)的生成,而CHX能够抑制TAPF阻断TNF-α激活的保护途径[14]。有研究表明TNF-α/CHX模型诱导凋亡的主要因素是由于ROS上调诱发细胞内氧化应激和凋亡[15],课题组成功构建了TNF-α/CHX心肌细胞损伤模型,并发现了AU的抗心肌损伤作用,为了进一步探讨其抗凋亡作用是否与雌激素受体相关,本研究选用MPP作为ERα的拮抗剂,(R,R)-THC作为ERβ的拮抗剂[16],表明AU是通过干预ERβ途径发挥抗凋亡作用。
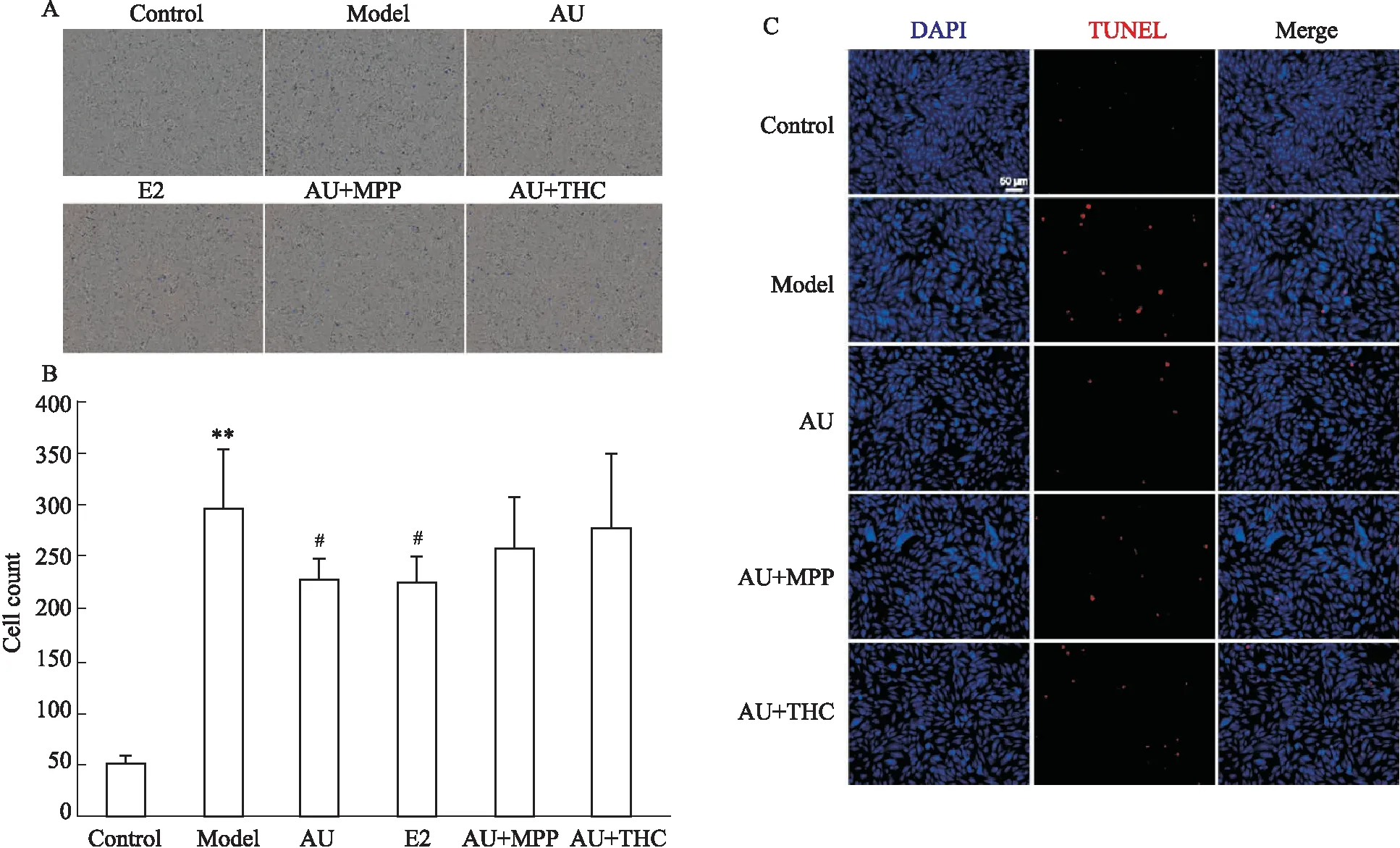
Fig 6 ERβ inhibitor reduces antiapoptotic effect of AU
综上所述,AU可以通过抑制心肌细胞凋亡发挥抗心肌缺血损伤从而改善急性心肌梗死后心功能的作用,其部分作用机制与激活ERβ信号通路有关。本研究为AU应用于急性心肌梗死的治疗提供了实验依据。
(致谢 本实验完成于天津中医药大学中西医结合学院、方剂学教育部重点实验室、天津市中药药理学重点实验室、天津中医药大学中医药研究院,感谢给予的帮助!)

