白藜芦醇通过线粒体调控血吸虫感染小鼠M1/M2极化
周慧慧,吕年银,佟书娟,史丽云,张伟伟
(南京中医药大学病原与免疫学教研室,江苏 南京 210023)
血吸虫病迄今仍然在全球广泛流行并且严重危害人类健康和生活。已经明确血吸虫感染最严重的病理变化是虫卵沉积肝脏形成的虫卵肉芽肿并继发纤维化[1]。研究已经证明,巨噬细胞在血吸虫病肝脏病理过程中发挥关键调节作用,巨噬细胞感染早期向经典激活的巨噬细胞(classically activated macrophage,M1)转化,高表达iNOS、CD16/32,分泌促炎因子IL-12、TNF-α,促进Th1应答,从而抑制肝脏肉芽肿的形成发展;虫卵抗原SEA诱导替代激活的巨噬细胞(alternatively activated macrophage,M2)产生,通过高表达精氨酸酶-1(Arg1)、CD206,分泌抑炎因子IL-10、TGF-β,促进Th2应答从而成为促进肝脏炎性肉芽肿及纤维化的关键因素[2-4]。因此,调控血吸虫肝脏病理进程中巨噬细胞从M1-M2表型的平衡可以成为开发治疗血吸虫病药物的新策略。
白藜芦醇(resveratrol)是一种非黄酮多酚类化合物,研究发现,白藜芦醇具有多种生物活性如抗衰老、抗氧化、抗肿瘤、抗炎等,近期有课题组发现其也对多种免疫细胞具有调控作用。比如,白藜芦醇对肝脏缺血/再灌注损伤的保护是通过调节巨噬细胞极化发挥作用的[5]。白藜芦醇促进巨噬细胞M2极化并缓解小鼠急性痛风性关节炎。本课题组前期研究发现白藜芦醇可以调控Th1/Th2应答抑制血吸虫病的肝脏纤维化,提示白藜芦醇可能在血吸虫感染中通过调控巨噬细胞M1/M2极化进而影响Th1/Th2应答发挥抑制肝脏病理的作用,但还未有研究[6]。许多学者发现,巨噬细胞极化与细胞代谢存在着密切联系,而其中线粒体发挥了至关重要的作用[7-9],如研究发现抑制小鼠巨噬细胞诱导型一氧化氮合酶可以阻碍 LPS+IFN-γ诱导的线粒体呼吸功能下降,改善代谢,促进巨噬细胞从表型M1往M2型极化。在M2型的肿瘤相关巨噬细胞中的代谢特征表现为线粒体通过氧化磷酸化(OXPHOS)合成ATP为M2极化供能,且过氧化物酶体增殖物激活受体γ辅助活化因子1α (PGC-1α)高表达,能够促进线粒体生物合成,增强OXPHOS 过程产生更多的ATP[10]。基于上述的研究背景,本研究拟采用白藜芦醇灌胃日本血吸虫感染小鼠,探讨白藜芦醇对M1/M2极化的影响及相应代谢学机制,为白藜芦醇治疗血吸虫病提供更多的理论依据。
1 材料与方法
1.1 实验动物与阳性钉螺采用于南京大学模式动物研究所的清洁级6-9周龄的雌性C57BL/6小鼠60只(温度:20 ℃;湿度:40%;笼内密度:4;自由获得水和食物),经南京中医药大学科学考察委员会批准,按照NIH《实验动物护理与使用指南》进行动物实验。日本血吸虫感染性钉螺购自南京市疾病预防控制中心。
1.2 试剂白藜芦醇(纯度为98%以上,批号KA080CA14)购自上海源叶生物技术有限公司。吡喹酮购自南京制药厂有限公司(批号20091202)。流式抗体大鼠抗小鼠F4/80-FITC(批号4281123)、大鼠抗小鼠CD16/32-PE(批号4312298)、大鼠抗小鼠CD206-PE(批号2005202)、大鼠抗小鼠CD11b-APC(批号1947198),均购自eBioscience公司。ATP Assay Kit(批号040219190918)购自上海碧云天生物技术有限公司。线粒体DNA检测试剂盒(批号157052014),购自Abcam公司。小鼠TNF-α(批号1901-2)、IL-12p40(批号E2060-1810-1)、IL-10(批号E2100-1710-1)、TGF-β ELISA(批号E2710-1910-1)检测试剂盒,购自达科为生物技术股份有限公司。小鼠Arg1的ELISA检测试剂盒,购自武汉菲恩生物技术有限公司。小鼠iNOS、Arg1、TNF-α、IL-12p40、IL-10、TGF-β和 PGC-1 α的引物,购自上海英骏生物技术有限公司。小鼠iNOS检测试剂盒,购自南京建成生物工程研究所(批号055541)。TRIzolTM,购自上海英骏生物技术有限公司,逆转录试剂盒,购自Fermantas公司(批号00791016),SYBR Green PCR Master Mix,购自Roche公司,seahorse 检测用抑制剂,购自Agilent Technology公司。
1.3 仪器CO2培养箱(Thermo Forma 公司);FACS Calibur流式细胞仪(BD 公司);超净工作台(苏州佳宝净化工程设备有限公司);低温离心机(德国Eppendorf 公司);7500型实时定量PCR仪(美国Applied Biosystems公司);酶标分析仪(美国Bio-Tek公司);seahorse XFe96 分析仪(美国 Agilent Technology)。
1.4 感染模型的建立和分组取6~9周龄雌性C57BL/6小鼠45只,每只小鼠经腹部皮肤感染日本血吸虫尾蚴(12±2)条。自感染3周后,血吸虫感染小鼠随机分为3组,每组15只。小鼠设4组:感染组小鼠为A组,白藜芦醇灌胃治疗的小鼠为B组,从感染第6周连续3周灌胃白藜芦醇20 mg·kg-1·d-1,灌胃吡喹酮治疗的小鼠为C组,从感染后第3、6周分别灌胃吡喹酮500 mg··kg-1·d-1×3 d, 另取正常健康小鼠15只为D组,为健康对照组,白藜芦醇和吡喹酮的剂量参照已发表文献[6]。
1.5 体外SEA刺激和分组取对数生长期的RAW264.7,用完全DMEM培养基将细胞浓度都调至5×105·mL-1,接种于6孔培养板;加入PBS为PBS处理组,加入终浓度20 mg·L-1的SEA为SEA处理组,加入终浓度20 mg·L-1的SEA和终浓度为20 mg·L-1的白藜芦醇为白藜芦醇处理组,加入终浓度20 mg·L-1的SEA和终浓度为100 mg·L-1的吡喹酮为吡喹酮处理组,共培养72 h后收集细胞和培养上清。
1.6 肝脏巨噬细胞的提取摘取感染9周小鼠的肝脏,用PBS缓冲液洗2遍,剪碎,放入研磨仪中研磨5 min,收集细胞悬液于15 mL离心管中,2 000 r·min-1,4 ℃,离心,10 min,弃去上清,加入5 mL红细胞裂解液,冰上静置后离心,取上清,再重复离心2次,均取上清。将上清2 000 r·min-1,4 ℃离心,10 min,弃掉上清,用3 mL 40% percoll 重悬细胞沉淀,然后将细胞悬液缓慢地铺陈到3 mL 80%的percoll上,以2 000 r·min-1,4 ℃,梯度离心20 min,取中间相液体。2 000 r·min-1,4 ℃离心10 min,去上清。用10 mL完全DMEM重悬细胞沉淀,放入10 cm的培养皿中贴壁2 h,洗去不贴壁的细胞,得到的贴壁细胞即为肝脏巨噬细胞。
1.7 ATP assay kit检测巨噬细胞ATP含量取2×106巨噬细胞加入200 μL细胞裂解液,用移液器反复吹打,转移至1.5 mL离心管中,冰上放置30 min,4 ℃,12 000×g,5 min离心,取上清。冰上溶解待用试剂,按照说明书浓度要求配制标准品。以每孔100 μL ATP工作液加入检测孔内,室温放置5 min,以消耗掉本底ATP,降低背景。在检测孔内加入20 μL 样品或标准品,混匀,2 s后用酶标仪检测RLU值。
1.8 流式细胞术检测M1和M2巨噬细胞比例在感染第9周,脱颈处死各组小鼠,摘取肝脏剪碎,采用研磨仪制备成单细胞悬液,用完全DMEM培养液将浓度调节至1×109·L-1。取1mL细胞悬液,1 500 r·min-1,4℃,离心5 min,加入100 μL的PBS缓冲液,同时加入抗体CD11b-APC(0.4 g·L-1)和F4/80-FITC(0.5 g·L-1),对于检测M1加入CD16/32-PE(0.1 g·L-1),对于检测M2加入CD206(0.2 g·L-1),混匀,置4 ℃避光孵育30 min。用PBS缓冲液洗2遍后, 加入500 μL的PBS缓冲液重悬细胞后用流式细胞仪(FACS Calibur,Becton Dickinson公司)检测。
1.9 实时定量RT-PCR检测巨噬细胞中的iNOS、Arg1、TNF-α、IL-12p40、IL-10、TGF-β和PGC-1α的mRNA水平取各组小鼠2×106肝脏巨噬细胞,用TRIzolTM提取总RNA,按M-MLV转录cDNA。iNOS、Arg1、TNF-α、IL-12p40、IL-10、TGF-β、PGC-1 α的反应体系都为SYBR Green PCR Master Mix 10 μL,反转录cDNA 5 μL,上游引物1 μL,下游引物1 μL,ddH2O 3 μL,总体积20 μL。实时荧光定量PCR反应条件:95 ℃ 10 min,40个循环:60 ℃ 60 s,95 ℃ 15 s,溶解曲线60-90 ℃保证扩增为单一产物。以Ct值进行结果分析,采用相对量法与内参β-actin做比较。计算公式为:2-ΔCT,ΔCt=Ct gene-Ct control。各分子引物如下:
iNOS:F:5′-CCCTTCCGAAGTTTCTGGCAGCAGCG-3′
R: 5′-GGCTGTCAGAGCCTCGTGGCTTTGG-3′
Arg1: F: 5′-TGAACACGGCAGTGGCTTTA-3′
R: 5′-GCATTCACAGTCACTTAGGTGGTTTA-3′
TNF-α: F: 5′-AAGGCCGGGGTGTCCTGGAG-3′
R: 5′-AGGCCAGGTGGGGACAGCTC-3′
IL-12:F: 5′-TGGAGCACTCCCCATTCCTA-3′
R: 5′-AGGAACGCACCTTTCTGGTT-3′
IL-10:F: 5′-CTTACTGACTGGCATGAGGATCA-3′
R: 5′-GCAGCTCTAGGAGCATGTGG-3′
TGF-β:F: 5′-CCTACCAGAACGCAGAGATCACT-3′
R: 5′-CACTCGTATCAACAGATGCGTACAT-3′
PGC-1 α:F: 5′-GCAGCCAAGACTCTGTATGG-3′
R: 5′-TTCCGATTGGTCGCTACACC-3′
1.10 ELISA检测RAW264.7培养上清中iNOS、Arg1、TNF-α、IL-12p40、IL-10、TGF-β的表达水平将体外经SEA刺激的不同处理组细胞和培养上清收集于15 mL离心管中,1 500 r·min-1,4 ℃离心5 min,吸取上清,采用酶联免疫吸附试验检测上述细胞因子的水平,操作过程严格按照试剂盒说明书进行。
1.11 seahorse检测细胞耗氧量将收集的不同组的巨噬细细胞以0.2×104/孔接种于96孔seahorse检测专用细胞培养板,每行培养板留一个孔,仅含有培养基,不含细胞,作为阴性对照。将含有校准溶液(200 μL/孔)的测试板以及含有注射器端口和探针的板放置在37 ℃的无二氧化碳培养箱中过夜。d 2去掉细胞培养板中的培养基,用 seahorse分析缓冲液(200 μL/孔)替换,并置于无二氧化碳培养箱中至少0.5 h。然后将抑制剂(寡霉素、FCCP、抗霉素A和鱼藤酮)添加到喷油器板。该板和测试板一起在seahorse XFe96分析仪上运行以进行校准。完成后,将测试板替换为检测专用细胞培养板,并在seahorse XFe96细胞能量代谢分析仪上运行。
1.12 统计分析数据结果用SPSS 15.0软件进行统计分析,并用GraphPad Prism 6.0软件制作统计图。多组间比较宜于用方差分析,两两比较用SNK法。
2 结果
2.1 不同处理组小鼠肝脏中M1和M2的比例在日本血吸虫感染第9周,检测小鼠肝脏巨噬细胞(CD11b+F4/80+)中M1(CD16/32+)和M2(CD206+)的比例发现,如Fig 1所示,比较健康对照组小鼠,感染组、白藜芦醇治疗组、吡喹酮治疗组的M1比例都明显增高(P<0.05),感染组、白藜芦醇治疗组、吡喹酮治疗组的M2比例也显著增高(P<0.01)。但是比较感染组,白藜芦醇治疗组的M1比例显著增高(P<0.01),M2比例明显降低(P<0.05),而吡喹酮治疗组的M1比例都显著低于感染组(P<0.05),M2比例没有差异(P>0.05)。白藜芦醇治疗组的M1比例高于吡喹酮治疗组(P<0.01),而M2比例明显低于吡喹酮治疗组(P<0.05)。
2.2 不同处理组肝脏巨噬细胞中iNOS、Arg1、TN-α、IL-12p40、IL-10、TGF-β的mRNA水平进一步确证白藜芦醇对巨噬细胞极化的影响,检测了血吸虫感染9周各组M1和M2相关因子的表达水平。如Fig 2所示,与健康对照组比较,感染组、白藜芦醇治疗组、吡喹酮治疗组小鼠的肝脏中iNOS、Arg1、TNF-α、 IL-12p40、IL-10、TGF-β的mRNA表达水平都增高(P<0.05),并且感染组和吡喹酮治疗组的M1相关因子iNOS、TNF-α、IL-12p40的表达都低于白藜芦醇治疗组,感染组和吡喹酮组的M2相关因子Arg1、 IL-10、TGF-β的mRNA表达水平高于白藜芦醇组(P<0.05)。而感染组的iNOS、TNF-α、 IL-12p40的表达都高于吡喹酮组(P<0.05),两组的Arg1、 IL-10、TGF-β的表达水平没有差异(P>0.05)。
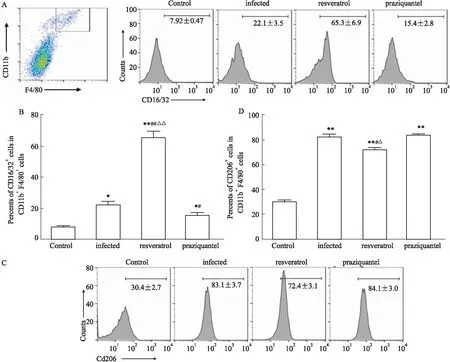
Fig 1 Proportions of M1 and M2 cells in liver of mice from different n=15)
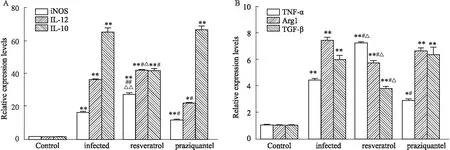
Fig 2 The mRNA levels of iNOS, Arg1, TNF-α, IL-12, IL-10, TGF-β in hepatic macrophages of mice from different n=15)
2.3 体外不同处理组M1及其相关因子,M2及其相关因子的水平在体外采用不同的处理RAW264.7细胞实验去验证体内结果,如Fig 3,4所示,与PBS处理组相比较,SEA处理组、白藜芦醇处理组、吡喹酮处理组的M1和M2的比例都明显增高(P<0.05)。但是白藜芦醇处理组的M1的比例显著高于SEA处理组(P<0.01),相应的iNOS、TNF-α、IL-12的分泌水平也高于SEA处理组(P<0.05)。而与SEA处理组比较,白藜芦醇处理组的M2比例下降(P<0.01),Arg1、IL-10、TGF-β的分泌水平也明显下调(P<0.05)。此外,吡喹酮处理组的M1比例及iNOS、TNF-α、IL-12 的分泌水平也高于PBS组(P<0.05),但低于白藜芦醇处理组(P<0.05)。上述的结果提示白藜芦醇可能通过上调M1,下调M2分化,进而调控Th1/Th2抑制血吸虫病肝脏病理。
2.4 不同处理组肝脏巨噬细胞中线粒体的合成和功能研究表明线粒体在巨噬细胞M1/M2极化中发挥关键作用,进一步探究白藜芦醇是否通过影响线粒体的合成或者功能调控巨噬细胞极化,检测了感染9周各组小鼠肝脏巨噬细胞中mtDNA、PGC-1α的表达水平、ATP的产生及基础耗氧率。如Fig 5所示,感染组、白藜芦醇治疗组、吡喹酮治疗组的巨噬细胞中mtDNA、PGC-1α的mRNA表达水平都高于健康对照组(P<0.05),ATP的产生、基础耗氧率也多于健康对照组(P<0.01)。同时白藜芦醇治疗组的mtDNA、PGC-1α的水平低于感染组(P<0.05),低于吡喹酮治疗组(P<0.05)。ATP的产生、基础耗氧量也明显低于感染组(P<0.01),低于吡喹酮治疗组(P<0.01)。提示白藜芦醇可能通过抑制线粒体的合成和功能进而抑制巨噬细胞往M2极化,促进往M1极化。
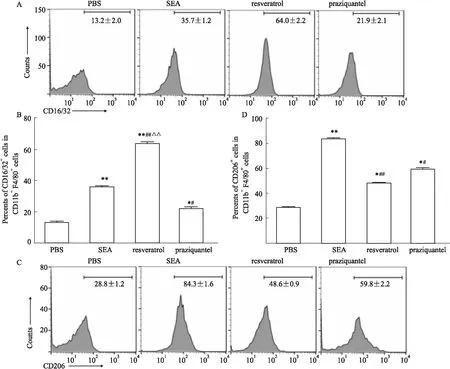
Fig 3 Proportions of M1 and M2 cells in groups with different n=15)
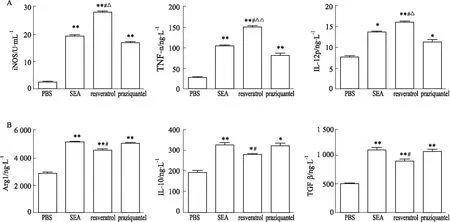
Fig 4 Levels of iNOS, TNF-α, IL-12, Arg1, IL-10, TGF-β in groups with different n=6)
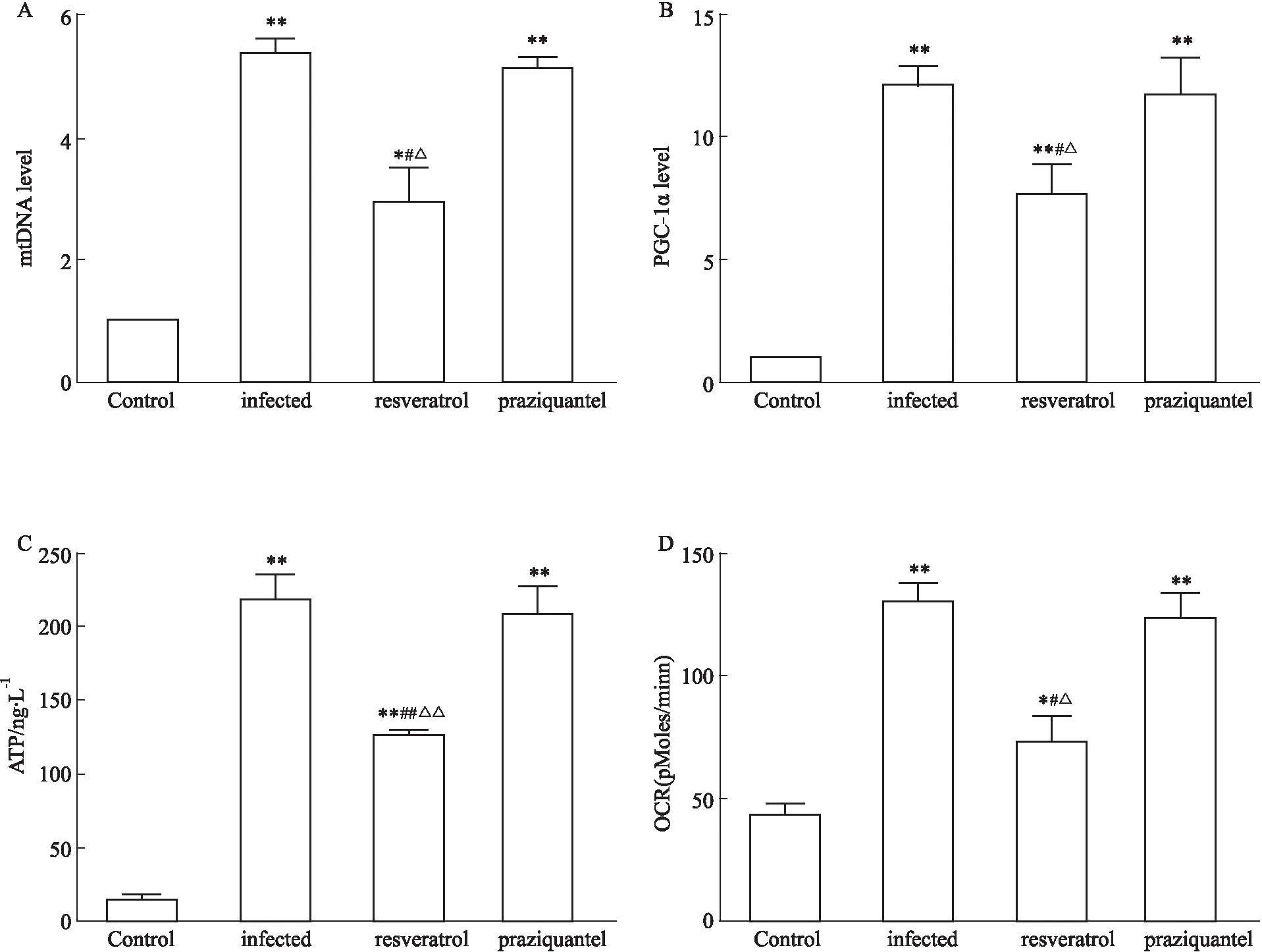
Fig 5 The mitochondrial metabolism in macrophages of mice from different n=15)
2.5 体外不同处理组RAW264.7中线粒体的合成和功能为了确证体内结果,同样采用体外刺激RAW264.7,检测结果如Fig 6所示,与PBS处理组相比较,SEA处理组、白藜芦醇处理组的巨噬细胞中mtDNA、PGC-1α的mRNA表达水平、ATP的含量、基础耗氧量都增高(P<0.05)。但是,白藜芦醇处理组巨噬细胞中mtDNA、PGC-1α的mRNA表达水平、ATP的含量、基础耗氧率明显少于SEA处理组(P<0.05)。吡喹酮处理组巨噬细胞中的mtDNA、PGC-1α的mRNA表达水平、ATP的含量、基础耗氧率与SEA组没有明显差异(P>0.05), 但是高于白藜芦醇处理组(P<0.05)。
3 讨论
巨噬细胞M1/M2极化在多种疾病如肿瘤、炎症、脑卒中、心血管疾病等的发病及进展中都至关重要,在临床上已经成为治疗相关疾病的重要策略[11-12]。血吸虫感染造成的最严重的病理改变是由巨噬细胞介导的T淋巴细胞应答,趋化各种细胞在虫卵周围形成的肉芽肿及其继发的纤维化,因此,巨噬细胞也在血吸虫病理中发挥关键作用。研究表明,血吸虫感染过程中巨噬细胞向M1极化,产生炎性因子,并可以诱导Th1应答,而向M2极化则可以产生抑炎因子,并且诱导Th2应答,因而两者对肝脏病理发挥相反的作用。本课题组前期的研究发现,白藜芦醇可以调控Th1/Th2应答进而发挥抑制肝脏肉芽肿的作用,但其如何调控Th1/Th2的机制并不明确。
基于M1/M2极化对Th1/Th2的调控效应,提示白藜芦醇可能通过影响M1/M2极化,进而调控Th1/Th2应答。结果如预想一致,经过灌胃白藜芦醇治疗后,日本血吸虫感染小鼠肝脏的巨噬细胞中M1(CD11b+F4/80+CD16/32+)的比例显著上升,而M2(CD11b+F4/80+CD206+)的比例则明显下降,这与本课题组之前的实验结果白藜芦醇上调Th1应答,下调Th2应答是相一致的,提示白藜芦醇可能是通过促进M1极化,进而上调Th1应答,同时抑制M2极化,进而下调Th2应答,最终抑制肝脏病理。这证明白藜芦醇的确是可以调控巨噬细胞的极化改变病理,符合黄文泽等[5]研究发现白藜芦醇促进巨噬细胞M2极化并缓解小鼠急性痛风性关节炎。在本研究的血吸虫感染过程中,白藜芦醇则是促进巨噬细胞M1极化进而减轻肝脏病理,究其原因可能在于血吸虫感染致病机制的特殊性。有别于其他常规的炎性病理是由促炎因子导致,血吸虫的病理则是由抑炎因子介导,两者的致病机制不一致。在小鼠急性痛风性关节炎中,激活的信号通路是TLR2/Sirt1/ NF-κB途径,白藜芦醇主要抑制这条通路中的信号分子及信号传递,从而阻碍促炎因子的产生[13]。而在血吸虫感染过程中,巨噬细胞在接受混合抗原SEA刺激后,产生的是抑炎信号通路,促进IL-10、TGF-β等抑炎因子的表达。因此推测,由于两种模型诱导的信号通路有显著差别,导致白藜芦醇发挥作用的靶点不同,因而发挥不同的作用,需要进一步地进行探索。此外,在本研究中发现,吡喹酮发挥抑制M1极化的作用,这与其他课题组发现的吡喹酮化疗4周下调脾脏中M1极化现象一致[14]。表明吡喹酮不仅可以通过杀虫减轻血吸虫感染,同时也可能通过下调巨噬细胞M1极化发挥调控肝脏病理的作用,但具体的调控还需进一步探寻。
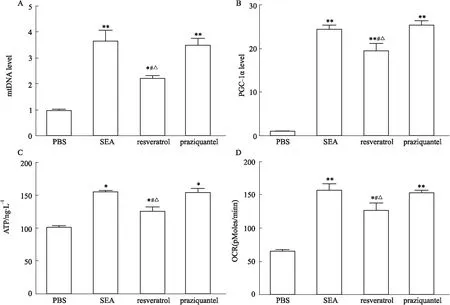
Fig 6 The mitochondrial metabolism in macrophages of groups with different n=6)
巨噬细胞的M1/M2极化受到多种机制的调控。近年的研究发现,细胞代谢尤其是线粒体在M1/M2极化过程中发挥关键作用[8-10]。已经明确在线粒体中发生的氧化磷酸化通过产生ATP支持M2型巨噬细胞的极化,而M1型巨噬细胞的活化可以抑制线粒体功能,阻碍巨噬细胞往M2型极化。张大勇等[15]发现白藜芦醇可以通过线粒体延缓骨髓间充质干细胞衰老,提示血吸虫感染中白藜芦醇也可能通过线粒体调控M1/M2的极化。与预想一致,本实验的结果发现白藜芦醇显著抑制了线粒体的氧化磷酸化水平导致ATP的产生下降,进而抑制M2型极化,促进M1型巨噬细胞的极化。此外,本实验还发现白藜芦醇能够显著下调线粒体的数量,并且是可能通过抑制线粒体合成关键因子PGC-1α的表达来实现,但具体的机制还不明确。有文献报道白藜芦醇可以通过促进线粒体的自噬减少细胞中多余的线粒体减轻病理,这也可能是本实验发现白藜芦醇减少巨噬细胞中线粒体的原因之一,需要进一步的探寻[16]。
综上所述,在血吸虫感染过程中,白藜芦醇不仅可以下调线粒体的功能,还可以减少其合成,从而抑制M2型巨噬细胞极化,促进M1型极化,进而上调Th1、下调Th2,最终抑制肝脏病理,发挥其对血吸虫病的治疗效果。本研究为白藜芦醇调控巨噬细胞极化和能量代谢提供可靠的依据。

