补体旁路激活致血管平滑肌细胞增殖活化及干预研究
李 娇,路青瑜,郭 丽,李 敏,孙黔云
( 1. 贵州医科大学省部共建药用植物功效与利用国家重点实验室,2. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014;3. 贵州省人民医院干医科,贵州 贵阳 550002)
随着人类生活条件的不断改善和提高,心血管系统常见疾病的发病率日趋增高,且有年轻化的趋向,其中动脉粥样硬化(atherosclerosis,AS)作为上述疾病典型代表之一。AS是一种复杂的、慢性的炎症性疾病,是造成心血管疾病高发病率和死亡率的主要原因[1],其中血管平滑肌细胞(vascular smooth muscle cells,VSMC)异常增殖是促进AS病变的主要原因[2]。VSMC是附着于血管内皮细胞表面的一层细胞,作为构成血管壁组织结构、维持血管张力的主要细胞,VSMC异常增殖会诱导细胞形态、结构和相关功能的改变,是导致AS、高血压和高脂血症等多种心血管疾病的细胞病理学基础[3]。多种致病因素导致的VSMC活化和功能紊乱是炎症发展的重要环节,能诱导VSMC产生炎性细胞因子进一步加重炎性反应,在AS发生和发展的过程中起关键作用,因此其动态平衡在组织的稳态中十分重要。多种因素都会导致VSMC增殖活化,例如脂多糖和高氧化低密度脂蛋白等[4-5],据报道补体激活也可以引起VSMC增殖活化[6-8]。补体是免疫系统的一个重要组成部分,当其被过度激活会导致细胞的炎症发生和组织损伤[9-11]。补体的激活主要有3条途径,每条途径的激活产物不尽相同,其中旁路途经在诸多疾病中都扮演重要角色。对于补体旁路途经激活产物致VSMC的影响及作用目前尚不清晰,因此,为进一步认识和了解补体旁路过度激活对VSMC的影响及其相关病理机制,本文开展了血浆补体旁路途径激活对VSMC产生的增殖活化作用研究,从一个新的角度和视野为临床治疗AS相关疾病药物筛选及评价提供参考依据和合适的细胞模型。
1 材料
1.1 试剂胎牛血清(fetal bovine serum,FBS)(阿根廷Natocor-Industria Biológica公司);DMEM高糖培养基(美国Sigma公司);海肾荧光素酶报告质粒、NF-κBp65信号通路质粒和Dual-Luciferase reporter assy system Kit(美国Promega公司);质粒抽提试剂盒(北京天根生化科技有限公司)、Lipo6000TM脂质体转染试剂(江苏碧云天生物技术研究所);血浆标准品(normal human plasma,NHP)(德国Siemens公司),货号为503264C;NHP 经56 ℃水浴灭活0.5 h而得灭活人血浆(inactivated normal human plasma,INHP);眼镜蛇毒因子(cobra venom factor,CVF)由本课题组分离、纯化和活力单位测定;Human E-selectin、ICAM-1和VCAM-1 ELISA Kits(武汉博士德生物工程有限公司);p-NF-κB p65、NF-κB p65、IKK和β-Actin Rabbit mAb(美国CST公司),货号分别为3033S、8242S、8943S和4970S;吡咯烷二硫氨基甲酸(PDTC)(美国Sigma公司),货号为P8765。
1.2 仪器CLM-170B-8-NF CO2培养箱(新加坡ESCO公司);连续波长酶标仪Gen5(美国BioTek公司);化学发光检测仪(美国Promega公司);Fusion-FX蛋白免疫印迹系统(法国Vilber公司);TS2FL倒置相差显微镜及成像系统(日本Nikon公司)。
2 方法
2.1 细胞培养人血管平滑肌细胞株(VSMC)由南华大学陈临溪教授惠赠。VSMC的培养用含0.15比例FBS的DMEM高糖培养基,于37 ℃、含5% CO2饱和温度培养箱中培养。
2.2 补体旁路激活物的制备临用前,将用生理盐水(Normalsaline,NS)稀释的CVF(浓度为6.5×104U·L-1)等体积与NHP轻轻混匀,37 ℃恒温水浴0.5 h制备补体旁路激活产物(CVF-activated complement,CAC),同时以INHP替代NHP同等条件下孵育制备产物作为对照。
2.3 CAC对VSMC增殖活化的检测
2.3.1不同量CAC对VSMC细胞增殖的影响 把对数生长期的VSMC稀释到7.5×106个·L-1后接种于96孔细胞培养板,种板体积100 μL/孔,24 h后进行换液处理,分别加30 μL、40 μL和50 μL/孔CAC刺激VSMC,于37 ℃刺激24 h后MTT法检测细胞活力,镜检观察细胞的形态变化,同时设置灭活血浆孵育产物对照组(Control)。
2.3.2CAC对不同时间VSMC细胞活力的影响 参照“2.3.1”试验方法,加入40 μL CAC后,MTT法分别检测0、6、12、24 h时细胞活力和镜检观察细胞形态的变化情况,同时设置灭活血浆孵育产物对照组(Control)。
2.3.3CAC对VSMC黏附分子表达的影响 细胞接种参照“2.3.1”的方法,每孔100 μL,培养24 h后进行换液处理2次,加40 μL CAC后,用不含血清的DMEM高糖培养基补齐至100 μL,分别取0、6、12、24 h 细胞培养上清,2 000 r·min-1离心10 min取上清测定相关黏附分子的含量。
2.3.4CAC对VSMC NF-κB信号通路的影响
2.3.4.1 质粒制备 质粒制备及浓度测定参照文献[11]。
2.3.4.2 双荧光素酶报告基因检测CAC对VSMC NF-κB p65核内转录活性的影响 将对数期生长的VSMC稀释到7.5×106个·L-1浓度进行种板,每孔100 μL,接种于96孔黑色不透光细胞培养板中,培养24 h,用温育无血清DMEM高糖培养基进行换液处理,弃上清,每孔分别加入90 μL含血清不含抗生素的DMEM高糖培养基和10 μL转染混合液,按Lipo6000TM脂质体转染试剂说明书过夜转染,转染成功后弃去上清,加入40 μL CAC 和60 μL无血清DMEM高糖培养基处理4 h后进行荧光强度的检测(Model),以INHP CVF孵育产物作为对照(Control),具体检测方法和计算公式参考文献[11]执行。
2.3.4.3 CAC对VSMC表达p-NF-κB p65、NF-κB p65和IKK的检测 将处于对数期生长的VSMC接种于25 cm2的一次性细胞培养瓶中,接种密度为5×107个·L-1。培养24 h,待细胞铺满80%~85%时进行换液处理,模型组(Model)加1.2 mL CAC后,再加1.8 mL无血清DMEM培养基补齐3 mL,分别刺激3 h和24 h后,按照碧云天胞质蛋白抽提试剂盒操作提取胞质蛋白,以INHP CVF孵育产物作为对照(Control)。蛋白经聚丙烯酰胺凝胶电泳分离、湿转转膜、一抗(1 ∶1 000)过夜孵育和二抗(1 ∶1 000)孵育1 h后,经化学发光显色成像系统进行曝光显影检测和量化分析。
2.4 PDTC对CAC诱导VSMC增殖活化的干预作用
2.4.1PDTC对VSMC细胞活力的影响 参照“2.3.1”方法进行VSMC细胞的种板和培养24 h后,分别加10 μL/孔PDTC预处理VSMC 2 h,PDTC终浓度分别为:1.0×10-4、1.0×10-5、1.0×10-6、1.0×10-7和1.0×10-8mol·L-1,总体积100 μL,于37 ℃刺激24 h后MTT法检测细胞活力。
2.4.2PDTC对CAC致VSMC增殖的影响 参照“2.4.1”方法,加入PDTC(终浓度分别为:1.0×10-5、1.0×10-6、1.0×10-7mol·L-1),预孵2 h后加入40 μL/孔CAC刺激24 h,MTT法检测细胞活力。分别以NS代替PDTC,设置NHP模型组(Model)和INHP对照组(Control)。
2.4.3PDTC对VSMC黏附分子表达的影响 参照“2.3.3”实验方法,选取各指标表达最高时间点进行PDTC(终浓度1.0×10-5、1.0×10-6、1.0×10-7mol·L-1)的干预检测,预孵2 h。以NS代替PDTC,分别设置Model组和Control组。
2.4.4PDTC对VSMC NF-κB p65核转录活性的影响 参照“2.3.4.2”方法进行细胞种板和转染,其中干预组分别加终浓度为1.0×10-5、1.0×10-6、1.0×10-7mol·L-1PDTC预处理2 h,加入CAC 在37 ℃恒温培养箱中4 h检测荧光强度,按照相对核内转录活性公式计算Ra值,以NS代替PDTC分别设置Model组和Control组。
2.4.5PDTC对CAC致VSMC表达p-NF-κB p65、NF-κB p65和IKK的影响 参照“2.3.4.3”方法进行蛋白抽提。其中干预组加1.0×10-5mol·L-1PDTC预处理2 h,换液后尽量弃去上清,加1.8 mL无血清DMEM培养基,再加入1.2 mL CAC补齐3 mL,分别刺激3 h和24 h后,抽提胞质蛋白。按照Western bolt方法通过蛋白经聚丙烯酰胺凝胶电泳分离、湿转转膜、一抗(1 ∶1 000)过夜孵育和二抗(1 ∶1 000)孵育1 h后,经化学发光显色成像系统进行曝光显影检测和量化分析。
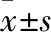
3 结果
3.1 补体激活诱导VSMC的增殖活化
3.1.1补体激活诱导对VSMC细胞的增殖作用 如Fig 1所示,CAC能够刺激VSMC细胞增殖,形态上细胞体积变大;在量效关系上,40 μL CAC作用时间24 h时,细胞增殖达到最大,与对照组相比差异具有显著性(P<0.01),且细胞状态变化最明显。如Fig 2所示随着刺激时间的延长,细胞活力增加,6 h以后,模型组和对照组之间差异具有统计学意义(P<0.01),其中24 h时,细胞形态差异最明显。
3.1.2CAC诱导VSMC表达黏附分子的作用 如Fig 3所示,CAC能刺激VSMC细胞表达E-selectin、ICAM-1和VCAM-1。其中ICAM-1、VCAM-1的最大含量作用时间为6 h,E-selectin在12 h表达最高。
3.1.3CAC诱导VSMC NF-κB p65转录活性上调 CAC作用于VSMC,能够诱导NF-κB p65核内转录活性上调,与对照组相比差异具有统计学意义(P<0.05,Fig 4)。
3.1.4CAC对VSMC表达p-NF-κB p65、NF-κB p65和IKK的影响 如Fig 5所示,CAC刺激VSMC后,上调p-NF-κB p65、NF-κB p65和IKK的表达,其中IKK蛋白表达在刺激3 h和24 h与对照组相比差异具有统计学意义(P<0.01),p-NF-κB p65和NF-κB p65表达在刺激24 h与对照组相比差异具有统计学意义(P<0.05,P<0.01)。
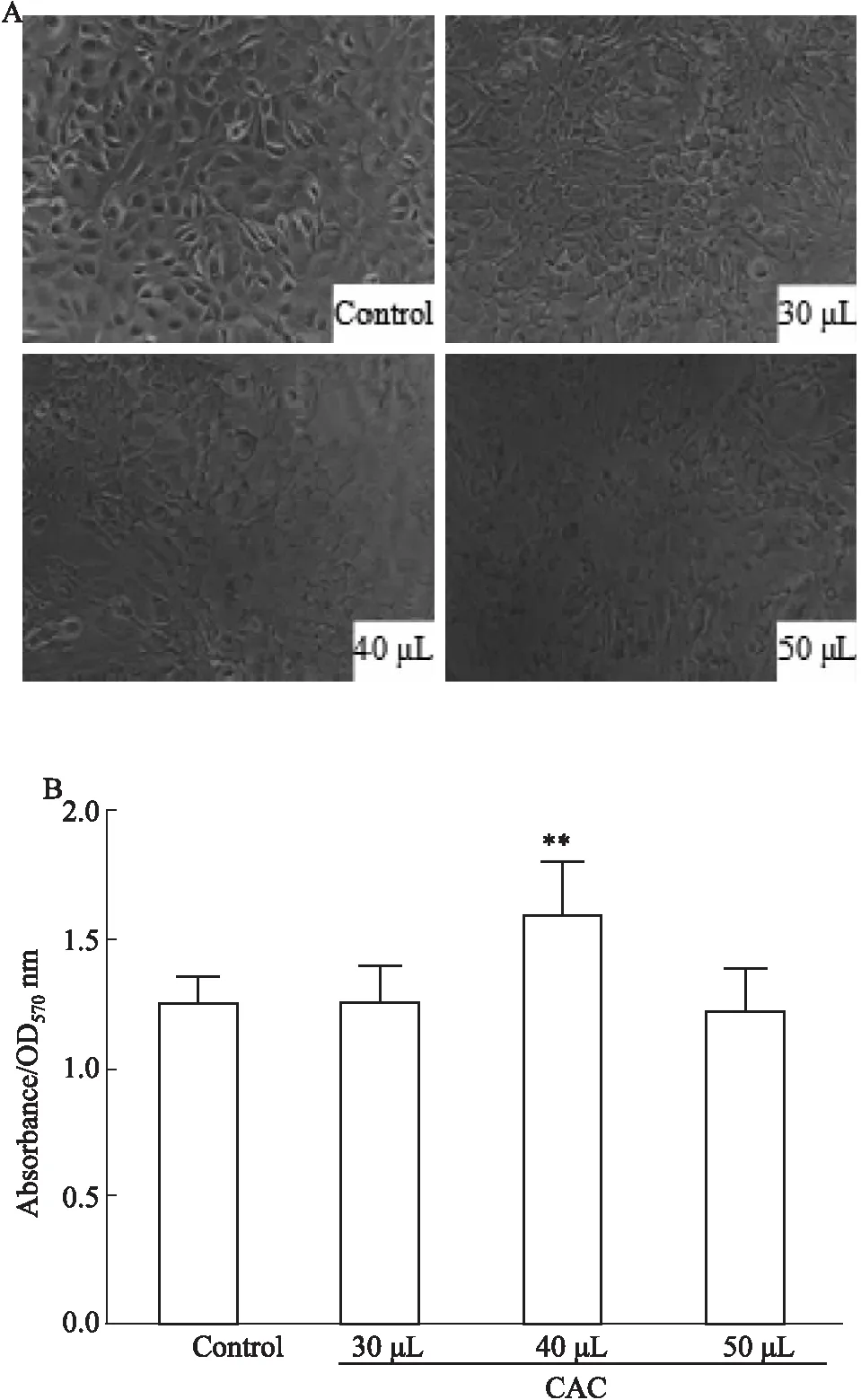
Fig 1 Effect of various concentrations of CAC on VSMC cell proliferation n=3)
3.2 PDTC对补体旁路激活致VSMC增殖活化的干预作用
3.2.1PDTC对CAC致VSMC增殖的影响 5个浓度的PDTC对VSMC细胞活力均有一定的影响,且随着浓度减小,影响逐渐降低,不同浓度间,1.0×10-4mol·L-1与其他浓度PDTC相比对VSMC细胞活力影响差值较大(Fig 6A),因此后续实验选择在1.0×10-5mol·L-1以下浓度范围内选择。Fig 6B的结果显示,不同浓度的PDTC均能抑制补体激活物刺激引起的VSMC增殖,使其在570 nm处吸光值降低,抑制效果与模型组相比差异具有统计学意义(P<0. 05,P<0. 01),表现出明显的量效关系,在细胞形态上,各组间无明显变化(Fig 7)。
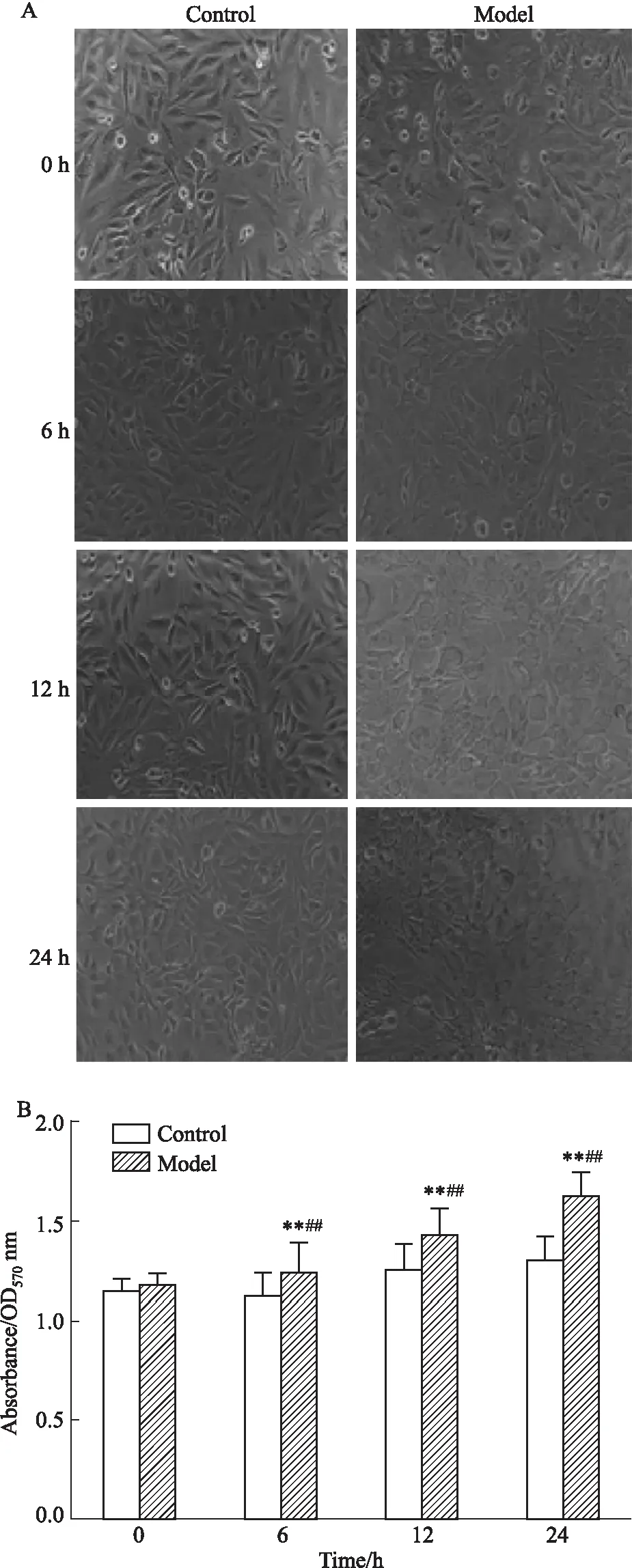
Fig 2 Effect of CAC on VSMC cell proliferation in a time-dependent manner n=3)
3.2.2PDTC对CAC诱导VSMC表达黏附分子的作用 CAC能刺激VSMC细胞表达E-selectin、ICAM-1和VCAM-1。当经PDTC预处理后,E-selectin、ICAM-1和VCAM-1的表达均明显下调,其中,3个浓度PDTC处理组的E-selectin和ICAM-1与模型组相比差异均有统计学意义(P<0.05,P<0.01,Fig 8);VCAM-1经高中两个浓度PDTC处理后与模型组相比差异均有统计学意义(P<0.01,Fig 8B),且各浓度间表现出明显的剂量关系。
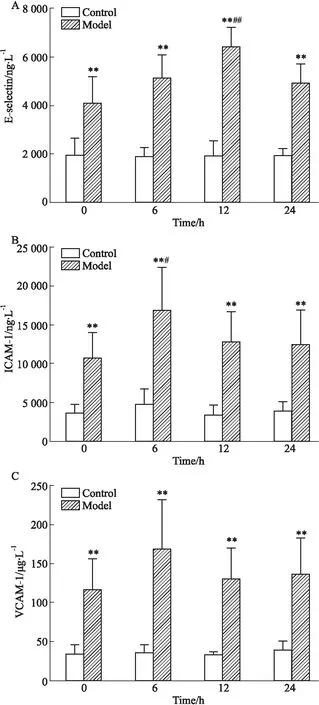
Fig 3 Expression of adhesion molecules in VSMCs after
3.2.3PDTC对CAC致VSMC NF-κB p65核转录活性的影响 如Fig 9所示,PDTC能够明显下调CAC刺激VSMC导致的NF-κB p65核内转录活性的升高,其中浓度为1.0×10-5mol·L-1组与模型组相比差异均有统计学意义(P<0.05)。
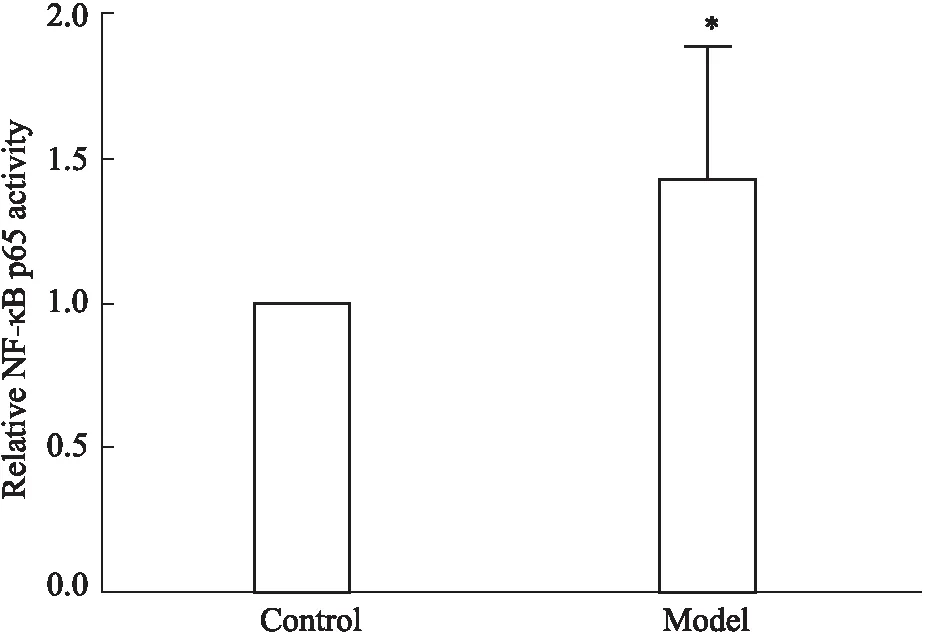
Fig 4 The transcriptional activity NF-κB p65 after exposure of VSMC to CAC n=4)
3.2.4PDTC对CAC致VSMC表达p-NF-κB p65、NF-κB p65和IKK的影响 如Fig 10所示,CAC刺激VSMC后,p-NF-κB p65、NF-κB p65和IKK表达明显上调,而PDTC对其表达上调具有干预作用,其中,在CAC处理24 h时,与模型组相比差异均有统计学意义(P<0.05,P<0.01)。
4 讨论
补体是机体固有免疫系统的重要的组成部分,在AS的诱导和发展中起着重要作用[11]。当其被激活后会产生过敏性毒素C3a、C5a和攻膜复合物MAC等一系列补体活化产物,可直接激活效应细胞产生促炎因子,使机体相关细胞增殖活化,进一步诱导血管内皮细胞的损伤和平滑肌的收缩,继而产生炎性反应和组织损伤,引起一系列相关疾病[12],是引发炎症的主要介导因素[13-14]。因此,补体的干预可为AS的防治提供一种新的思路。我们前期研究结果表明,CVF激活血清中补体旁路后,诱导血管内皮细胞激活,表现出相关信号通路的活化,核内转录活性上调和炎性分子表达变化等一系列反应[15]。这种通过CVF特异激活补体旁路获得补体全成分产物的方式与机体病理生理条件下补体过度激活高度相似,为进一步认识补体旁路激活对VSMC的作用提供一个很好的工具。因此,本文利用CVF来特异激活血浆补体旁路,探索补体旁路激活对VSMC增殖活化的影响,为开展防治AS药物筛选提供一个合适的细胞模型。
在本研究中,补体旁路激活物刺激VSMC后会导致细胞增殖活化、出现明显形态学变化,引起黏附分子的表达上调,NF-κB p65磷酸化水平增加,NF-κB p65核内转录活性升高,NF-κB p65和IKK蛋白表达增加,NF-κB特异抑制剂PDTC对上述炎症反应相关指标的变化均有一定的抑制作用。VSMC表达的黏附分子ICAM-1、VCAM-1和E-selectin在炎症反应中介导炎症细胞黏附发挥着十分重要的作用,其表达升高提示VSMC活化。NF-κB是一个主要由p50和p65两种亚基组成的蛋白二聚体,是活化的细胞中多条信号通路的汇集点,在炎症发生和发展过程中有着至关重要的作用[16]。在脂多糖诱导大鼠VSMC炎症发生过程中,NF-κB通过调控介质炎症靶基因的转录,进而抑制VSMC的增殖和迁移,在调节细胞炎性反应和增殖活化中起着重要作用[17]。有研究报道,抑制NF-κB信号通路活化能够取得较明显的平滑肌保护作用[18]。本研究中,CAC刺激VSMC后NF-κB p65磷酸化水平增加、NF-κB p65核内转录活性升高、NF-κB p65和IKK蛋白表达明显上调,提示当VSMC受到CAC刺激后,NF-κB信号通路被激活,调控黏附分子和p65、IKK蛋白表达上调,增加NF-κB p65转录活性应答增殖活化信号。因此,上述黏附分子及NF-κB核转录因子等相关指标表达的上调提示CAC能够诱导VSMC增殖活化,可直接导致基于VSMC增殖活化应答的炎症发生。本文中,采用NF-κB信号通路活化特异抑制剂PDTC能够明确抑制这些黏附分子和相关蛋白表达,降低NF-κB p65核内转录活性,表明NF-κB信号通路在补体旁路激活造成VSMC增殖活化中具有重要作用。因此,基于本研究结果,PDTC通过抑制VSMC NF-κB信号通路活化强度增加和核内转录活性升高来下调黏附分子的转录调控表达,从而抑制VSMC增殖活化,揭示PDTC对补体旁路激活导致的VSMC增殖活化具有一定的干预作用,可以作为一个有效的阳性药物。通过本研究确定合适的细胞模型条件,可以用于VSMC增殖抑制的活性物质筛选,为下一步从补体的角度去筛选和评价相关的活性物质提供一个新的细胞模型。
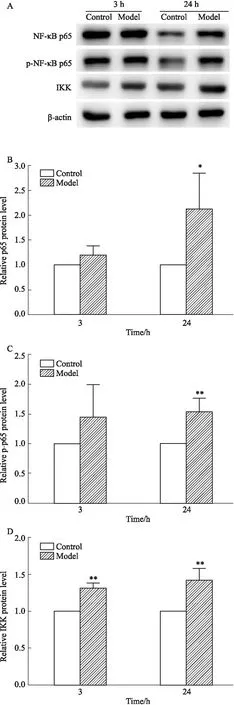
Fig 5 Western blot analysis of p-NF-κB p65, NF-κB p65 and IKK protein expressions of VSMC induced by CAC n=4)
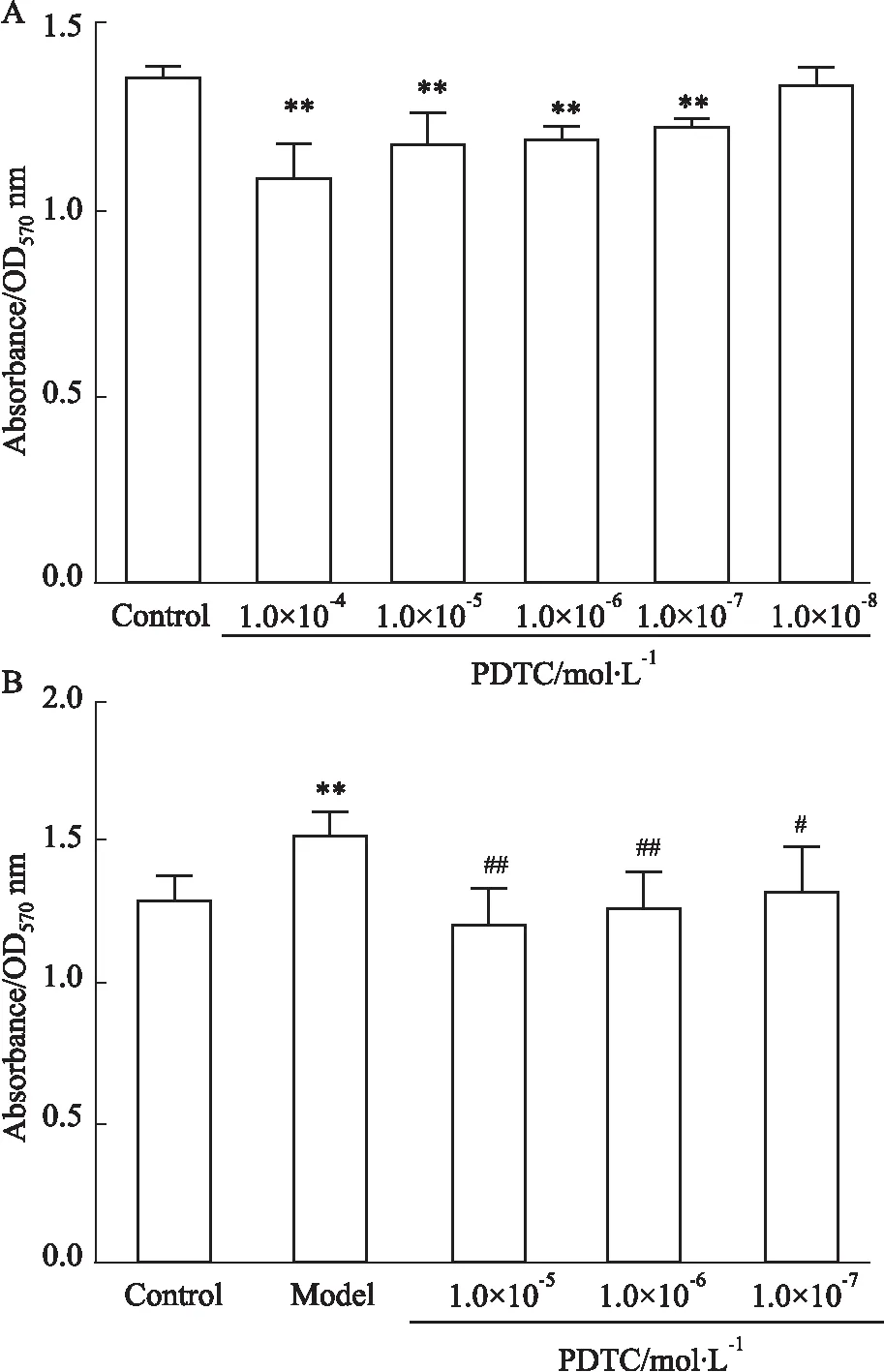
Fig 6 Effect of PDTC on cell proliferation n=4)
Fig 7 Effect of PDTC on VSMC morphology induced by CAC(×100)
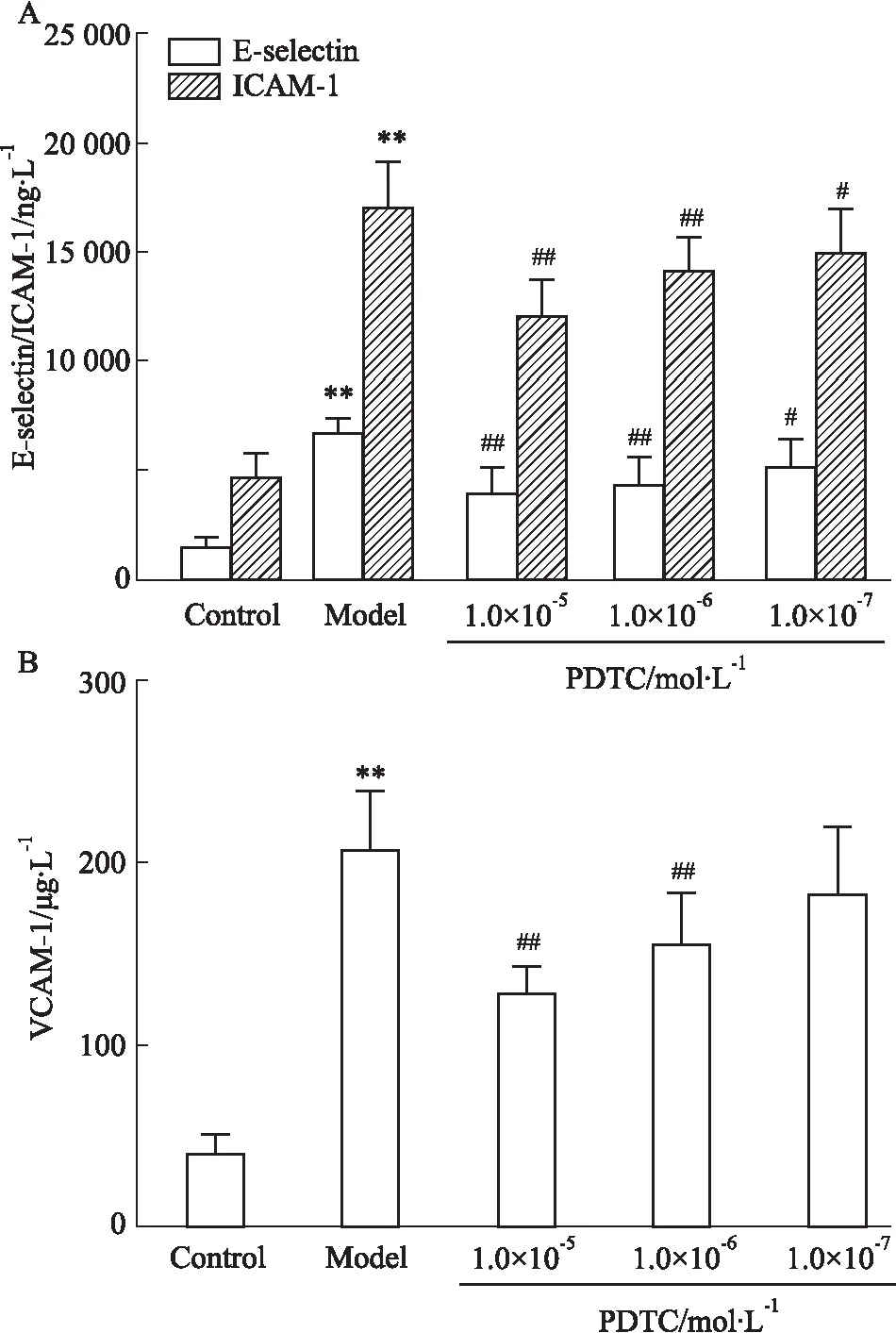
Fig 8 Effect of PDTC with different concentrations on adhesion molecule expression of VSMC induced by
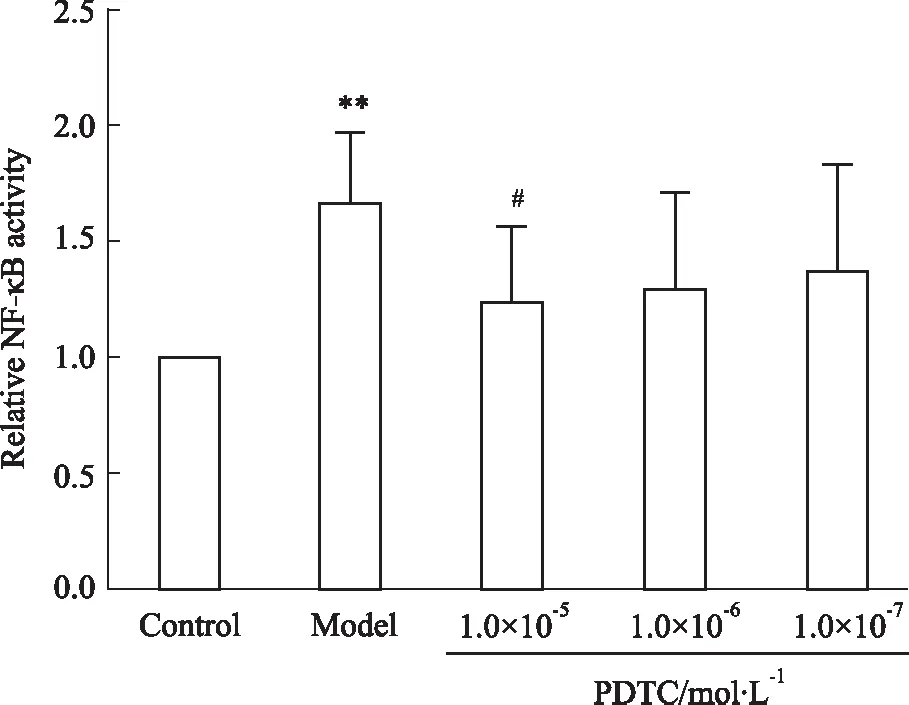
Fig 9 Effect of PDTC with different concentrations on transcriptional activity of NF-κB p65 after exposure of VSMC induced by CAC n=4)
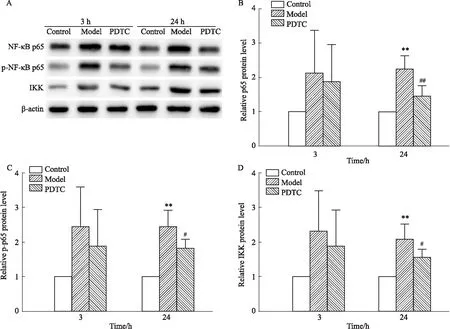
Fig 10 Effects of PDTC on protein level of p-NF-κB p65, NF-κB p65 and IKK n=4)
综上,补体旁路激活可以直接导致VSMC增殖活化,上调表达黏附分子、NF-κB p65核内转录活性和NF-κB信号通路活化,表明补体旁路激活会影响平滑肌细胞的正常功能,产生相关的病理生理效应,提示补体旁路途经可能在AS发生发展过程中扮演了重要角色。本研究从一个新的角度和视野为AS的防治药物筛选提供一个潜在的细胞模型。

