人参皂苷CK对咪喹莫特诱导小鼠银屑病的治疗作用
王 雾,杨 梅,蒋梦雅,汪丹丹,陈镜宇,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽抗炎免疫药物协同创新中心,安徽 合肥 230032)
银屑病是由多种因素相互作用引起的慢性鳞屑性皮肤病,病程反复发作,全球患病率为1%-3%,呈现逐年上升趋势,其中80%以上患者表现为寻常型[1]。近年来[2],大量文献表明Th17分泌的细胞因子IL-23、IL-17在银屑病患者皮肤与血清中明显升高。银屑病患者JAK/STAT3通路被激活,磷酸化STAT3的表达较正常人明显升高。银屑病临床治疗药物主要概括为5大类:内服药、外用药、物理疗法、天然植物用药以及生物制剂。这些药物的副作用也各不相同,内服与外用药常伴有皮肤萎缩、红肿、刺痛、瘙痒、灼烧感;物理疗法大大增加了患者皮肤癌患病率;新兴生物制剂主要针对中至重度患者,常常伴有严重的感染及价格昂贵,临床应用得以限制[3]。因此寻求经济、副作用较少的药物对临床治疗银屑病有重要意义。
人参皂苷CK(ginsenoside metabolite compound K,GCK)是人参中提取的主要生物活性天然化合物,在人肠道菌群水解为Rg2、Rg3、化合物K等,化合物K被认为是口服人参或人参皂苷后具有代表性的活性代谢物,发挥抗炎免疫作用[4]。课题组前期研究表明[5],GCK在类风湿性关节炎(rheumatoid arthritis, RA)动物模型中发挥抗炎免疫作用,其作用机制与抑制T细胞的活化,减少Th17的分化有关。有研究表明[6],GCK对咪喹莫特(imiquimod,IMQ)诱导的BALB/C小鼠银屑病模型有改善作用,但作用机制尚未阐明。另有研究表明[7],GCK通过抑制REG3A/RegIIIg的表达缓解角质形成细胞过度增殖来减轻IMQ诱导的小鼠银屑病样皮损。GCK对银屑病治疗作用与抑制JAK1/2-STAT3通路有无关联,仍不清楚。本实验探讨GCK体内用药对IMQ诱导的小鼠银屑病的疗效和机制。
1 材料与方法
1.1 实验动物BABL/c小鼠,♂,7-8周,购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2017-001,饲养于SPF级动物实验室。所开展的实验均经安徽医科大学临床药理研究所动物实验伦理审查委员会批准。实验中涉及的方法均根据动物实验相关指南和法规进行。
1.2 药物与试剂GCK(由浙江海正制药有限公司提供,纯度≥98%,用0.5%羧甲基纤维素钠溶解,配制成4个剂量组)(批号:S130901);甲氨蝶呤(methotrexate,MTX)购自信谊药业(批号:036180804);地塞米松(dexamethasone,DEX)购自安徽金太阳生化药业(批号:1801192);BCA 试剂盒购自美国赛默飞公司(批号:UJ290656);JAK1一抗(批号:GR221662-23)、磷酸化JAK1一抗(批号:GR249635-22)购于Abcam;JAK2一抗(批号:11)、磷酸化JAK2一抗(批号:10)、STAT3一抗(批号:4)、磷酸化STAT3一抗(批号:34)购于美国Cell Signaling Technology公司;PCNA购于Santa Cruz Biotechnology公司(批号:E0119);K1一抗购自Proteintech;。EDTA抗原修复液(批号:19042401)、免疫组化通用二步法试剂盒(批号:K196915D)、ECL 化学发光试剂购于美国赛默飞(批号:TG269475);IMQ乳膏购于四川明欣药(批号:19030340);凡士林乳膏购于天津市博迪化工有限公司(批号:11021);脱毛膏购于植物医生温和套装(批号:ACG0800604);Mouse IL-17 ELISA kit(批号:2001-1)、Mouse IL-23 ELISA kit(批号:1912-1)购于深圳达科为生物技术股份有限公司。
1.3 仪器Olympus倒置显微镜(日本奥林巴斯);石蜡切片机(德国莱卡);多功能酶标仪(瑞士TECAN公司);低温高速离心机(美国Sigma);化学发光成像系统(美国GE公司);1 mL玻璃匀浆器(广州优博实验器材有限公司)。
1.4 银屑病模型的建立随机将BALB/C小鼠分为如下组(每组10只):正常对照组、模型组、MTX(2 mg·kg-1)组、DEX(5 mg·kg-1)组、GCK 14、28、56、112 mg·kg-1。造模前3 d,背部脱毛2 cm×3 cm范围,观察小鼠背部脱毛情况,进行二次脱毛。造模当天,除正常对照组外的小鼠于背部皮肤上涂抹约62.5 mg IMQ乳膏(5%),正常对照组小鼠背部涂抹等量凡士林。各给药组灌胃给药,正常对照组小鼠灌等量溶媒,连续7 d。
1.5 小鼠背部皮肤观察每日同一时间段用数码照相记录皮损变化,对小鼠皮损处3个指标(鳞屑、增厚、红斑)的程度采用PASI评分,3者评分之和为总分。PASI 评分标准:0~4分,分别表示无、轻度、中度、重度、极重度,总分为3个指标分数之和(0~12分)。d 8小鼠进行眼球取血,取脾脏、胸腺和背部皮肤,25%皮肤用4%组织固定液常温保存,其余组织均放置-80 ℃保存。
1.6 小鼠皮肤组织病理学观察取出固定液中的皮肤,石蜡包埋,切片,苏木精-伊红染色,显微镜观察,拍照。每张切片随机取3处,测量角质层到基底层的垂直距离,统计分析表皮厚度变化。
1.7 免疫组化检测小鼠皮肤中PCNA的表达将石蜡切片脱蜡水化,封闭,加抗原修复液进行冷修复,一抗4 ℃孵育过夜,次日室温放置30 min后,先滴加反应增强液室温反应10 min,后滴加二抗,室温反应20 min,DAB显色5-8 min,苏木精复染20 s,脱水,封片,显微镜观察PCNA的表达情况。
1.8 Western blot检测相关蛋白的表达取冻存的皮肤组织,按照组织裂解液 ∶PMSF ∶磷酸酶抑制=100 ∶1 ∶1比例研磨,14 000×g离心20 min,取上清,BCA蛋白定量;电泳;用PVDF膜进行转膜;TPBS配制脱脂牛奶(5%)在37 ℃温箱中孵育2 h;洗膜,孵育一抗,4 ℃结合12 h以上;洗膜;37 ℃孵育二抗2 h;洗膜显影。
1.9 ELISA检测小鼠背部皮肤中IL-17、IL-23的表达按照试剂盒的说明书进行,在IL-17、IL-23细胞因子检测板中加入样本(稀释4倍)或对应的标准品并设置对照,严格按照试剂盒说明书操作,加检测抗体孵育,洗板,加酶孵育,洗板,加入显色剂显色反应5~30 min后,加终止液使反应终止,10 min内在酶标仪设置参考波长610 nm~630 nm,检测波长450 nm测出各孔吸光度值,用ELISACALC软件绘制标准曲线并计算出各只小鼠皮肤中炎症因子的水平。
2 结果
2.1 小鼠皮肤形态观察d 1~2,正常对照组小鼠皮肤均光滑平整;与正常对照组相比,IMQ诱导的小鼠在d 1就表现出轻微鳞屑,皮肤微微泛红;d 3鳞屑增多,涉及大面积皮肤,并且出现明显增厚现象,可见明显的红斑;d 5鳞屑分布更加密集,增厚现象进一步明显,红斑颜色也进一步加深;d 7鳞屑几乎布满整片背部皮肤,皮肤厚度明显增加,肉眼可见的红斑。MTX、DEX组小鼠皮损明显改善,GCK给药组小鼠皮肤损伤减轻,见Fig 1。
2.2 GCK对小鼠皮肤PASI评分的影响每天同一时间段用数码相机记录小鼠皮损情况,据PASI评分标准进行评分。小鼠鳞屑、增厚、红斑评分在d 1~d 7均持续升高(P<0.05)。将3者评分相加得到总分,总分在d 1~d 7内持续升高,各给药组PASI评分降低(P<0.05),见Fig 2。

Fig 1 Effect of GCK on back skin of mice induced by IMQ n=10)

Fig 2 Effect of GCK on PASI scores of mice induced by n=10)
2.3 GCK对小鼠组织病理学及表皮厚度的影响从HE染色中可以看出对照组小鼠皮肤结构正常,表皮层细胞只有2-3层。IMQ诱导的小鼠表皮明显增厚,角化不全,角化过度,炎性细胞浸润,颗粒层变薄,棘突延长等。GCK给药组可以改善上述变化,见Fig 3。选取HE切片400×的视野,每只小鼠切片选取一个视野,使用ImageJ软件在每个视野中随机量取3处表皮的垂直距离,取其平均值。与正常对照组小鼠相比,IMQ诱导的小鼠表皮厚度明显增加(P<0.01),与模型组相比,各给药组小鼠表皮厚度明显减小(P<0.05),见Fig 3。
2.4 GCK对小鼠表皮中PCNA、K1表达的影响PCNA可以反映角质形成细胞的增殖程度。如Fig 4A所示,对照组小鼠表皮PCNA在表皮基底层少量表达,IMQ诱导的小鼠表皮PCNA表达明显增多,呈多层分布,PCNA阳性细胞表达明显增加。与IMQ诱导的小鼠相比,给药组小鼠表皮PCNA阳性细胞表达减少。皮肤表皮中K1是表皮细胞正常分化的标志。与正常组相比,模型组小鼠皮肤中K1表达降低;与模型组相比,各给药组小鼠皮肤中K1表达明显升高(P<0.05),见Fig 4B。
2.5 GCK对小鼠皮肤JAK1/2-STAT3信号通路的影响与正常组相比,模型组小鼠皮肤中磷酸化的JAK1、JAK2、STAT3蛋白表达升高(P<0.05),与模型组相比,各给药组均能降低JAK1、JAK2、STAT3的磷酸化水平(P<0.05)。提示GCK可能抑制JAK1/2-STAT3信号通路缓解小鼠银屑病,见Fig 5。
2.6 GCK对小鼠背部皮肤IL-23、IL-17水平的影响如Fig 6所示,与正常组相比,模型组小鼠皮损中IL-23、IL-17水平明显升高(P<0.01);与模型组比较,各给药组小鼠皮损中IL-23、IL-17水平明显降低(P<0.01)。
3 讨论
GCK是具有我国自主知识产权的新型活性单体,在我国已注册为1.2类新药,并已完成RA的临床前研究和I期临床试验,目前正在进行GCK治疗RA的II期临床试验。结合临床前长期毒性研究和Ⅰ期临床试验综合显示,GCK具有良好的安全性和耐受性[8]。本课题组前期完成了GCK治疗RA的临床前药效学评估,结果显示GCK具有抗炎免疫调节作用,其机制与抑制T细胞的活化,减少Th17的分化有关[9-12]。

Fig 3 Effect of GCK on histological changes of skin in mice induced by IMQ
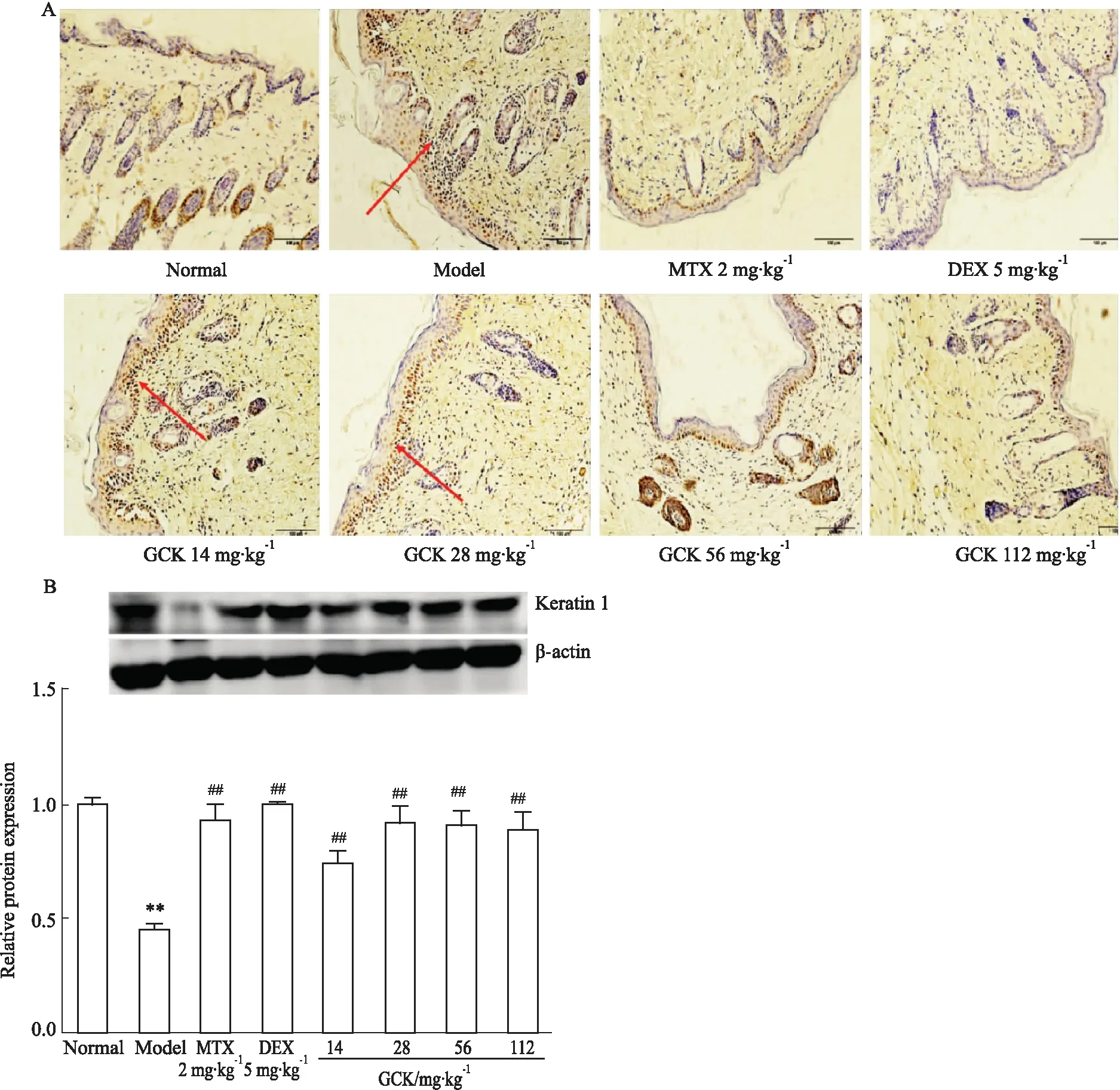
Fig 4 Effect of GCK on expression of PCNA (×200) and keratin1 in skin of mice induced by IMQ n=6)

Fig 5 Effect of GCK on expression of p-JAK1, p-JAK2, and p-STAT3 in skin of mice induced by IMQ n=6)
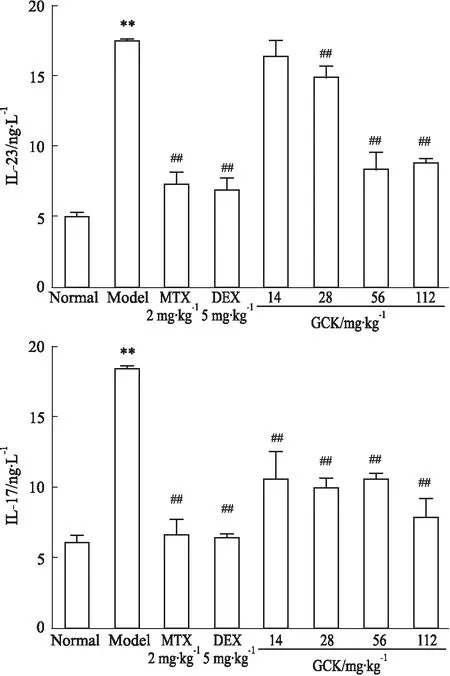
Fig 6 Effect of GCK on levels of IL-17 and IL-23 in skin of mice induced by IMQ n=6)
银屑病发病机制中,IL-23、IL-17的激活促使炎症发生,树突状细胞分泌的IL-23与Th17细胞上的受体结合,刺激Th17细胞分泌IL-17、IL-22等细胞因子。IL-23不仅可以诱导角质形成细胞增殖,还促进新生血管生成并募集中性粒细胞与巨噬细胞等。银屑病的许多关键致病介质,包括IL-23、IL-17的激活,都与JAK1/2-STAT3信号通路的活化有关。与正常皮肤相比,银屑病患者受损皮肤JAK1/2-STAT3信号通路上调[13]。作为银屑病治疗靶标的IL-23、IL-17和JAK1/2-STAT3信号通路已经成为新药开发的重要方向,靶向抗IL-23、IL-17的药物对银屑病有明显疗效。银屑病患者给予IL-17受体单克隆抗体、JAK1/2的抑制剂12周后情况明显改善,通过阻断IL-17A与IL-17受体结合的单抗已陆续上市[14]。
IMQ乳膏最初用于局部治疗由人类乳头瘤病毒引起的殖器和肛周感染,是一种Toll样受体7配体,具有强大的免疫激活作用。临床研究发现,无论是在银屑病患者使用部位还是未使用部位,IMQ会加速银屑病病灶的出现。局部连续7 d涂抹IMQ构建的急性银屑病模型,增强了IL-23、IL-17及 JAK1/2-STAT3的表达[15]。本实验结果表明,GCK可以降低PASI评分,改善皮肤鳞屑、增厚、红斑、角化不全、角化过度、炎性浸润等皮肤病理状况,提示GCK对IMQ诱导的银屑病小鼠的治疗作用。
表皮正常分化的信号表现为角质细胞进入基底层后,K1开始大量表达。银屑病的临床特征性表现为表皮细胞异常增生和分化。本研究结果显示,与正常对照组相比,模型组表皮中PCNA表达明显增加,K1表达降低,GCK给药后,PCNA表达降低,K1表达明显增强;提示GCK可能通过抑制角质形成细胞异常增生,促进正常分化来改善IMQ诱导的银屑病小鼠的皮肤损伤。进一步研究表明,GCK能降低p-JAK1、p-JAK2和p-STAT3的表达,降低炎症因子IL-23、IL-17的水平;提示GCK治疗IMQ诱导的银屑病小鼠可能与下调IL-23、IL-17,抑制JAK1/2-STAT3活化有关。
综上所述,GCK可以缓解IMQ诱导的小鼠银屑病损伤,其作用机制可能与抑制JAK1/2-STAT3活化有关。GCK作为天然药物来源成分,具有耐受性好、不良反应少等优点,本研究为治疗银屑病提供实验依据。

