过敏所致急性纤维素性机化性肺炎的诊治经验及文献复习
高敏楠,张露,杨艳旗,江慧琦,曾宽,王萌
急性纤维素性机化性肺炎(acute fibrinous and organizing pneumonia,AFOP)是一种罕见的急性肺部损伤,Beasley 等人[1]在2002年首次发现并报道了本病,基于其病理学特点,美国胸科协会/欧洲呼吸学会将其归类为特发性间质性肺炎的特殊类型[2]。AFOP 所表现的临床症状是非特异性的,易被误诊漏诊,从症状出现到诊断的平均时间为19~43.9 天[1,3],病人接受治疗后的转归亦差别很大。AFOP尚未引起临床足够重视,其诊断标准及治疗方案尚无定论。以下总结一例过敏相关急性纤维素性机化性肺炎的诊治经过,并复习相关文献。
1 资料与方法
1.1 一般资料
患者42 岁,女性,因“体检发现心脏疾病10 余天”于2020-5-21 收入我科。患者10 余天前外院体检胸片提示“心影异常”,无胸闷、胸痛、气促、心悸等任何阳性症状,查心脏彩超提示“二尖瓣狭窄(重度)并关闭不全(轻度),肺动脉高压(重度)”,拟诊“风湿性心脏瓣膜病”收入院。起病以来精神、胃纳、睡眠可,二便正常,体重无明显变化。既往史、个人史、家族史均无特殊。入院查体:T 36.1 ℃,P 66 bpm,R 20 bpm,NBP 96/59 mmHg,体重48.5 kg。神清,胸廓对称,胸骨无压痛,双侧呼吸运动对称,肋间隙未见异常,双侧触觉语颤对称,无胸膜摩擦感,双肺叩诊清音,双肺呼吸音清,未闻及干湿啰音及胸膜摩擦音。心前区无异常隆起,无心包摩擦感,P 66 次/分,心律齐,心尖部可闻及3/6 级舒张期隆隆样杂音。周围血管征阴性。双下肢无水肿。辅助检查:红细胞沉降率、甲状腺功能、肝炎系列、粪便常规、糖化血红蛋白未见明显异常;血常规:血红蛋白70 g/L;风湿四项:抗链球菌溶血素O 258 IU/mL(参考值<200 IU/mL);凝血常规:凝血酶原国际比值1.19,活化部分凝血活酶时间38.8 s,D-二聚体1.31 mg/L(均轻度升高);生化:白蛋白34.9 g/L,总胆固醇2.5 mmol/L,转铁蛋白1.77 g/L,总铁结合力44.4 μmol/L,余肝肾功能、离子水平等无明显异常。心脏彩超提示“风湿性心脏病:二尖瓣狭窄(重度)并关闭不全(轻度),主动脉狭窄(轻度)并关闭不全(中-重度),三尖瓣关闭不全(中度);肺动脉高压(重度),PASP 约92 mmHg;左室收缩功能正常”;胸片提示“心影增大,符合风心病改变;双肺未见明确异常”;心电图提示“窦性心律,双房增大,左心室高电压”;腹部超声提示“肝内多个囊性占位病变,考虑肝囊肿;脾轻度肿大;胆囊、胆管、胰腺、肾脏、输尿管、膀胱未见明显异常”。
1.2 方法
1.2.1 术前准备 患者术前主要存在中度贫血原因未明及重度肺动脉高压所致高手术风险,血液内科会诊,完善相关贫血检查,其中地贫常规结果明显异常,考虑诊断“地中海贫血”,暂不需特殊治疗。术前给予安立生坦口服联合曲前列尼尔持续皮下微量泵入降低肺动脉高压。
1.2.2 手术治疗 完善相关术前准备后,于2020年6月3日在全麻、体外循环下行主动脉瓣、二尖瓣瓣膜置换(机械瓣)+三尖瓣整形+双房改良迷宫术后,手术按常规步骤进行并留置肺动脉测压管(PA 管),顺利脱离体外循环,术程顺利。
1.2.3 术后病情变化及肺部疾病相关治疗 常规关胸期间于输注血浆及纤维蛋白原期间发生严重过敏反应,表现为全身皮肤潮红,散在多发风团,伴有肺动脉压(PA)升高、血压降低,并气道内持续涌出大量淡黄色澄清血浆样液体,严重通气障碍,立即予甲强龙80 mg 静推,并肾上腺素静注,血压稍平稳,其后予肾上腺素、去甲肾上腺素持续静脉泵入,于当日16:20 返回ICU 病房。
返回ICU 时风团逐渐消退,躯干部皮肤仍有潮红,T 37.4℃,P 88 bpm,ABP 98/54 mmHg,PA 52/32 mmHg,气道内仍持续涌出大量淡黄色澄清血浆样液体,需以持续性吸痰管每间隔3~5 min 清理一次,其后1 h,血压再次出现波动,呈逐渐下降趋势(最低ABP 68/45 mmHg),紧急行床边心脏彩超,排除心包填塞及低心排综合征等因素后,考虑为过敏及其相关炎症反应所致外周血管阻力下降并相对有效循环血量不足,再次予甲强龙40 mg 静注强化抗过敏、抗炎,并肾上腺素、去甲肾上腺素静脉泵入维持血压,白蛋白及晶体液补充容量,其后患者血压逐渐平稳(ABP 91/58 mmHg),4 h 后气道内分泌物清理时间可延长至15~20 min 一次,7 h 后气道内分泌物清理时间延长至1 h 一次,但出现体温升高,最高39℃,予抽血送检病原学培养,并升级抗菌素至美罗培南1 g q12 h ivdrip(原方案为拉氧头孢2 g bid ivdrip),并予物理降温等对症治疗,体温可降至36.5℃。
2020年6月4日起,患者气道内未见明显前述血浆样分泌物,血管活性药物使用大致同前,生命体征相对稳定(ABP 93~109/46~61 mmHg,PA 44~52/24~29 mmHg),但仍有发热(最高T 39.6 ℃),予加用利奈唑胺600 mg q12 h ivdrip强化抗感染治疗,体温可降至38.2℃,患者间中房颤,予可达龙复律,间中使用西地兰控制心室率,患者NT-ProBNP 较前升高,予加用米力农强心治疗。其后继续监测生命体征、体温、感染指标、心功能等,并维持强心、抗感染、机械辅助通气、降低肺动脉压等治疗,间中心脏彩超评估心脏功能。因患者血管活性药物使用种类繁多,血流动力学仍不稳定,仅能定期复查床边胸片了解肺部情况,基于患者过敏后炎症反应严重,再抗感染同时考虑予甲强龙40 mg qd+丙球10 g qd ivdrip 使用一周至2020年6月9日,感染指标逐渐降低(如表1),肺部炎症渗出逐渐改善(如图1)。
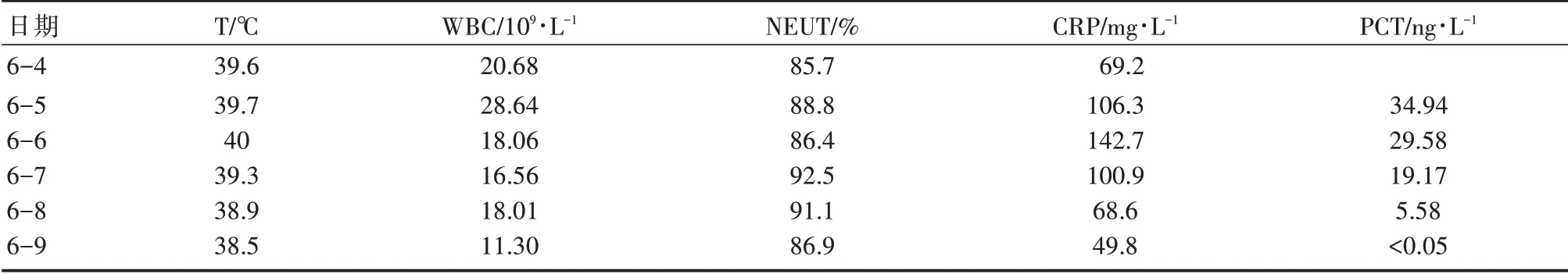
表1 感染相关临床指标监测表
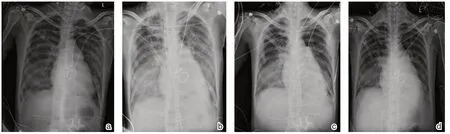
图1 术后早期胸片比较 a. 6-3 床边胸片b. 6-4 床旁胸片c. 6-6 床旁胸片d. 6-9 床旁胸片
鉴于胸片所示右下肺斑片状实变影,不排除肺部引流不畅因素,遂于6月5日及6月8日分别行床边纤支镜检查,可见气道粘膜充血严重,气道内含有大量纤维素样物质(如图2),活检钳取并清理气道,留取部分组织标本送检病理,6月10日病理结果回报为纤维素性渗出物,伴少量炎症细胞浸润(如图3)。
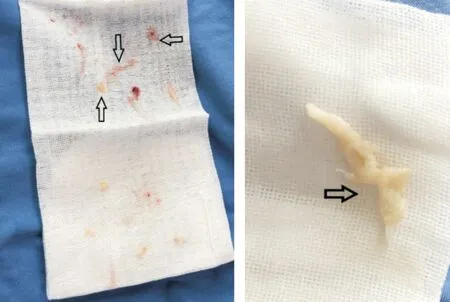
图2 气道内纤维素样物质 呈乳白色非透明光滑条柱状,最大直径约4 mm、长约30 mm)
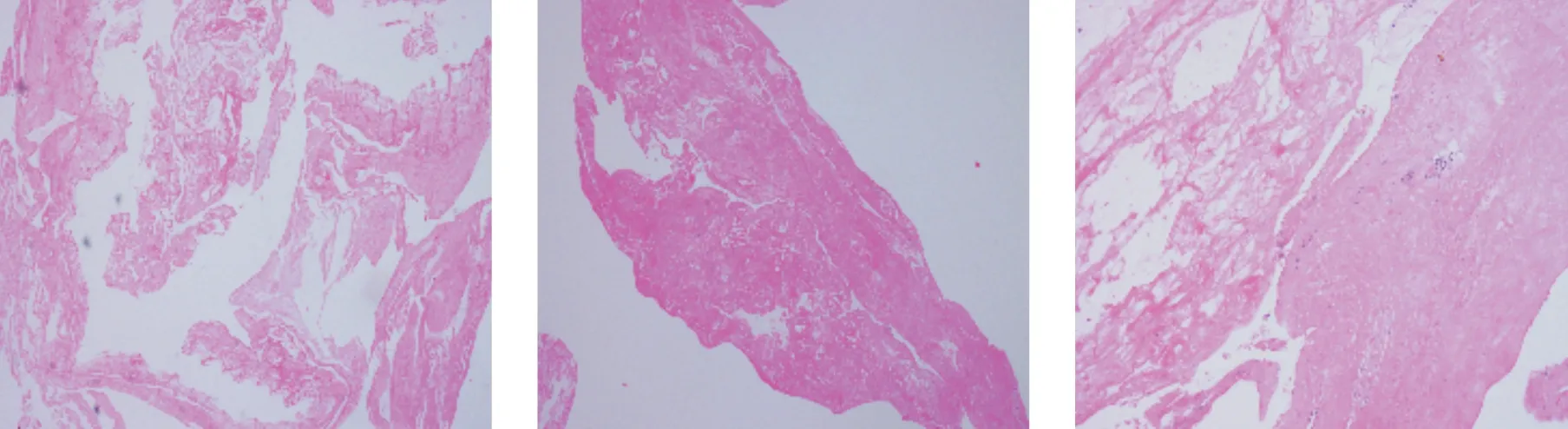
图3 气道内嵌取组织病理结果(HE×100)
6月10日患者血常规提示血小板降低明显,反复生化检查提示低钙血症,且患者体温仍未恢复正常,遂请血液科、内分泌科、风湿免疫科及呼吸科多学科会诊,考虑患者发热与低血小板或与感染所致骨髓抑制相关,但病因尚未明确,予进一步完善真菌D 葡聚糖,真菌抗原GM、EB 病毒DNA、巨细胞病毒DNA、T-SPOT 等检查,拔出原CVC 管并加做CVC 管细菌培养,同时将抗生素方案更换为替加环素50 mg qd+舒普深3g q12h ivdrip,发热>38.5℃时使用地塞米松5 mg 退热。以上病原学结果均为阴性。调整药物方案后,患者血小板计数逐渐稳定,一般情况改善,血压稳定,氧合满意,遂于6月12日停用机械辅助通气,拔除气管插管,6月14日复查胸片肺部炎症同前相仿,但患者血流动力学逐渐稳定,血管活性药物用量逐渐减小后生命体征仍稳定,于2020年6月15日转至普通病房,间中仍有房颤发作,发作时血压明显降低,予药物控制待心律稳定后于2020年6月19日行胸部CT 检查(如图4),结合患者病史、CT 检查结果及前述气道内组织病理结果,诊断急性纤维素性机化性肺炎,予激素治疗。
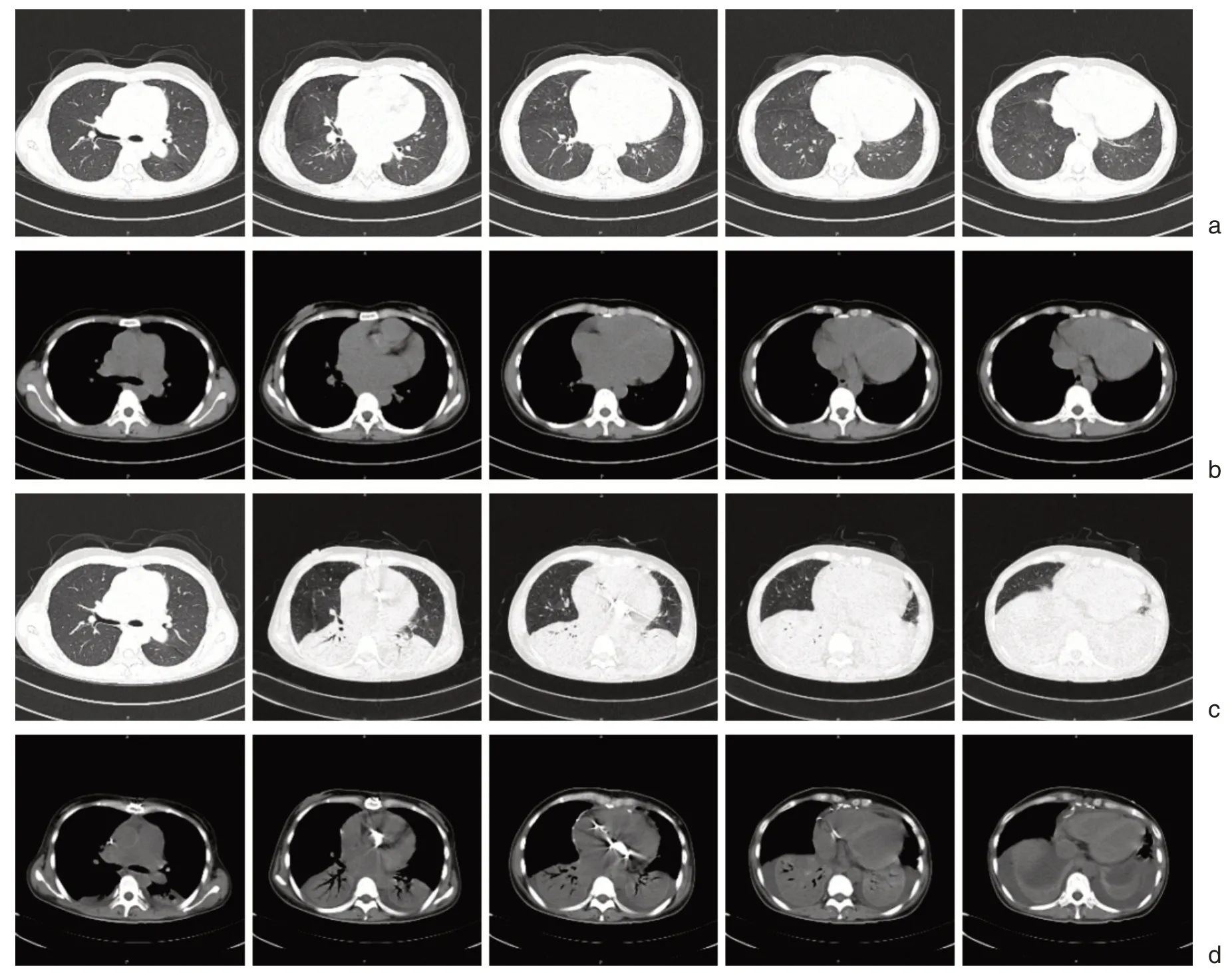
图4 术前及术后第一次胸部CT 比较 a. 5-19 术前CT 肺窗未见明显异常,b. 5-19 术前CT 纵隔窗未见明显异常,c. 6-19 术后第一次CT 肺窗见双下肺大片肺实变,d. 6-19 术后第一次CT 纵隔窗见双下肺大片实变伴少量胸腔积液
2 结 果
2020年6月20日 至2020年6月29日予甲强龙40 mg qd ivdrip,2020年6月30日起改为强的松口服30 mg qd 起,2020年7月3日复查胸部CT,结果较前好转(如图5),2020年7月9日进一步减量至25 mg qd,后患者情况稳定,于2020年7月14日出院。
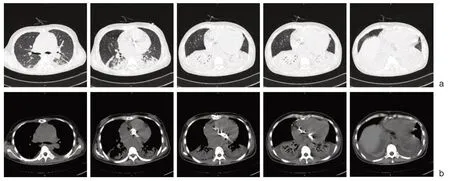
图5 使用激素治疗后第一次复查胸部CT 结果 a. 7-3 复查CT 肺窗,b. 7-3 复查CT 纵隔窗,肺部实变较前减轻,气管影较前增加
患者出院后继续口服激素并门诊复查,2020年7月16日强的松减至20 mg qd,2020年7月23日至15 mg qd,2020年8月22日至10 mg qd,2020年9月22日至5 mg qd。复查胸部CT 结果均较前明显好转(如图6),亦无任何呼吸系统症状。
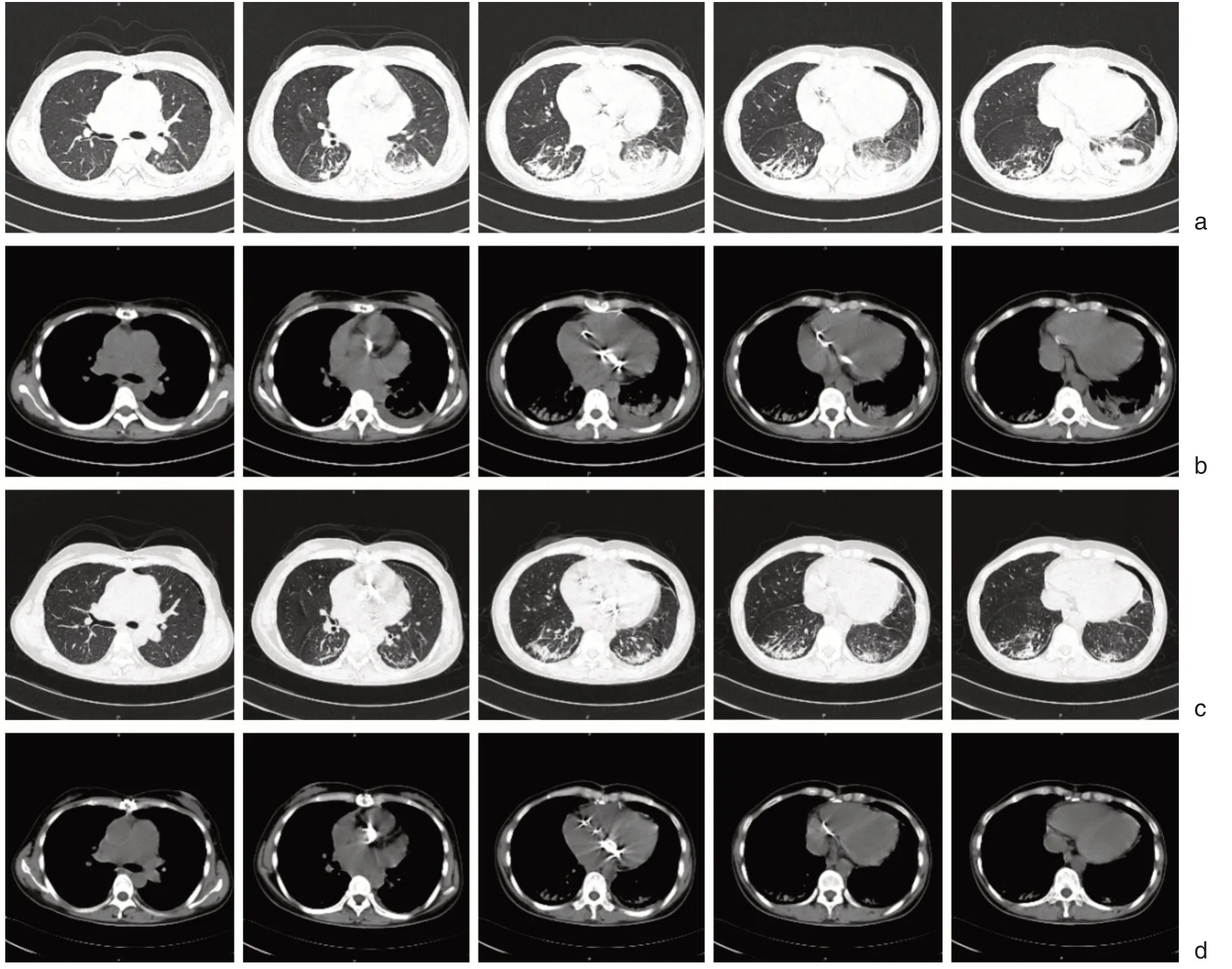
图6 激素治疗后门诊复查胸部CT 结果 a. 8-11 复查CT 肺窗,b. 8-11 复查CT 纵隔窗,c. 9-14 复查CT 肺窗,d. 9-14 复查CT 纵隔窗,可见激素减量使用后肺部实变仍较前进一步明显减少,部分病变组织已基本恢复正常
3 讨 论
AFOP 是临床罕见疾病,迄今为止,尚无对本病的大规模临床研究,故其病因、诊断及治疗均无明确标准,其临床起病可分为急性或亚急性病程,不同起病方式与临床预后关系紧密,急性起病者常迅速发展为呼吸衰竭而导致不良预后,特别是需要机械通气的AFOP,据现有报道,若其病情进展或基础疾病控制不理想,病死率或高达100%[1,3]。
当前对本病的报道仅有一百余篇,且多为病例报告,诊断多数以病理结果为主要依据,其病理改变主要为肺泡腔内大量纤维蛋白沉积形成嗜酸性的纤维素球,及相关的组织炎症性表现,如急慢性炎症细胞浸润、肺泡间隔增宽、肺泡上皮增生等[3-5]。此外,影像学表现亦诊断提供重要依据,AFOP 影像学各异,最常见的影像学表现为双侧肺基底部大片状实变,毛玻璃样改变和叶间间隔增厚[6],其他影像学表现包括双侧弥漫性粟粒浸润,以及伴有大叶实变的广泛性结节[6,7]。
本病例患者虽因出血倾向明显未能取得肺组织穿刺活检标本,但支纤镜钳取气道内组织病理符合其主要病理表现,再结合其他临床资料,均较支持本病诊断,基于对本病认识不足,且患者血流动力学不稳定,未能尽早进行胸部CT 检查,诊断或有延迟。
AFOP 已知可能相关的病因有很多,如感染(今年的COVID-19 感染患者亦有发现此种病例可能)[8,9]、结缔组织病[10]、血液系统疾病[11]、药物、环境暴露[3,12]或器官移植[13,14]等多种因素,有时可合并有以上多种因素,亦可是未能发现任何可疑病因的特发 性病例[6,7,15]。如本病例所述的与过敏反应高度相关的情况暂未见明确报道,但其与过敏反应发生的时间顺序(同期发生抑或继发),仍有待进一步观察论证。
当前普遍被认可的AFOP 治疗方案主要包括免疫抑制剂及糖皮质激素[6,15,16],但对其具体用量及治疗周期尚未达成共识。亦有研究说明肿瘤坏死因子抑制剂依那西普可有效治疗急性肺损伤和AFOP[17,18],抗生素[3]及免疫球蛋白治疗可能也会使患者获益[19,20]。就本病例诊治经验来看,使得患者预后良好应该是多因素的,早期的机械通气、抗菌素、甲强龙及丙球的使用或都带来获益,较可惜的是对本病认识不足导致中间皮质激素使用剂量不足,我们建议对于本病应尽早完善胸部CT 及组织病理检查同时结合临床病史资料尽早诊断,并尽早足量使用激素,且激素减量应该缓慢,同时对有可疑或明确病原感染时同时使用抗菌素及丙种球蛋白,必要时定期清理气道,保持气道引流通畅,或可提高病人生存概率。

