甘草治疗肝细胞癌的网络药理分析与潜在机制研究
马晓飞,王喜城,陈捷,黎文信,陈涛*
肝细胞癌(HCC)是最常见的恶性肿瘤之一[1]。尽管如手术切除、射频消融、TACE、靶向治疗等治疗手段得到了一定的进步,但肝癌的异质性与快速进展,HCC 的总体预后不能令人满意。发展更有效的肝癌治疗策略是新时代要求。既往研究指出基因的异常表达和突变参与了肝癌的发生和发展,靶向密切相关致癌分子的策略具有较大治疗潜力[2]。因此,开发此类药物用于HCC 患者的临床治疗,值得探究。
中草药(TCM)是中国文化瑰宝,近年来发现某些中药具有稳定的抗肿瘤效果,逐渐引起人们的关注[3]。中草药的多种活性成分同时作用于疾病的多个靶点,具有巨大的抗瘤潜力[3,4]。甘草是中药的重要成员之一,已有千年的使用史,多国的药典中都有记载甘草治疗疾病的效果[5,6],约60%的中药处方都含甘草配伍[7]。另外,根据TCMSP数据库信息,约280 种有药物活性的化合物从甘草中分离。从甘草中提取的活性成分具有多种药理作用,如抗肿瘤、抗微生物、抗病毒、抗炎等其他活性[8]。但甘草是否可以用于治疗肝癌仍然不清楚,且潜在抗癌机制仍未探究。
基于网络分析方法的进步,近年来系统药理学得到发展迅速,成为探索和分析药理学研究的可靠方法[9,10]。该种研究模式已被实验证明是准确与高效的,且在研究中药配方治疗疾病机制方面已得到认可,如补肾益智配方、芪参益气滴丸和胃消消汤[11-13]等。因此,网络药理学的研究策略是解决传统草药抗肿瘤效应与恶性肿瘤之间关系的有效途径。
本研究应用网络药理学的研究方法构建了两个靶标-通路网络以研究这些潜在基因与信号通路之间的特定关系。产生了“甘草途径”以说明甘草在肝癌治疗中抗肿瘤机制,揭示了甘草在肝癌治疗中潜在的分子作用机制。研究结果可以为进一步探究甘草的抗肝癌临床应用奠定基础。
1 材料和方法
1.1 有效化合物鉴定
甘草所有化合物均从中药系统药理数据库和分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索得到。TCMSP 有中国药典(2010年版)注册的所有502 种中药配方信息,13,729 种成分,3339种靶标和867 种疾病信息,相关文献通过文献挖掘和数据库集成来整合[14]。基于OB 与DL,鉴定与甘草有关的活性化合物。OB 是未经修饰的药物通过口服吸收进入循环系统的百分比。OB 是评估口服药物吸收功效的完善指标[5],具有高OB的生物活性化合物开发为药物潜力更大[15]。本研究选择甘草中OB>30%的草药成分作为候选分子。DL 是药物分子的功能或物理性质的另一种评判指标,DL 已广泛用于筛选具有不良性质的化合物[16,17]。本研究DL 的标准>0.18。
1.2 确定甘草的分子靶标
基于SysDT 模型和Herb Ingredients 的Targets数据库,TCMSP[15,18]完成目标预测。由于识别出的候选靶标进行非规范的解释,因此使用UniProt知识库(www.uniprot.org/)获取甘草化合物分子靶标及基因编号。
1.3 甘草HCC 靶点
人类基因数据库(GeneCards,http://www.genecards.org/)鉴定与HCC 相关的基因。GeneCards 数据库鉴定所有肝癌的相关预测靶点并注释靶点基因、蛋白质和疾病的全面信息。
1.4 PPI 网络建设与分析
基于公共数据库STRING(已知和预测蛋白质-蛋白质相互作用的搜索工具,版本11.0,https://string-db.org)构建HCC 相关基因和甘草相关治疗靶基因的相互作用网络[19]。最低要求交互得分是0.4,且断开连接的节点隐藏在网络中。导出PPI网络,进行蛋白质相互作用统计。
1.5 基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析
GO 分析是注释具有功能的基因的常用方法,包括分子功能(MF),生物途径(BP)和细胞成分(CC)[18],KEGG 用于系统分析基因功能和相关的高水平的基因组功能信息[20]。对于89 个关键的潜在基因,使用R 的clusterProfiler 程序包(版本:3.12.0)识别GO 和KEGG[21]。P值<0.05 设为GO和KEGG 富集分析有统计学意义的标准。
1.6 甘草通路及其治疗模块
进一步阐明甘草的分子治疗机制,整合从KEGG 分析获得的12 个甘草与癌症、肝脏疾病相关途径,包括“前列腺癌途径(hsa05215)”,“结直肠癌途径(hsa05210)”,“胰腺癌途径(hsa05212)”,“癌症相关蛋白多糖途径(hsa05205)”,“膀胱癌途径(hsa05219)”,“肝细胞癌途径(hsa05225)”,“TNF 信号途径(hsa04668)”,“MAPK 信号途径(hsa04010)”,“凋亡信号转导途径(hsa04210)”,“ERBB 信号转导途径(hsa04012)”,“乙型肝炎途径(hsa05161)”和“丙型肝炎途径(hsa05160)”。
2 结 果
2.1 甘草中活性成分的鉴定
利用TCMSP 数据库,检索甘草的290 种化学成分,分为皂苷(主要为甘草甜素)、类黄酮、香豆素、生物碱、多糖、谷甾醇和氨基酸等[22]。以OB>30%和DL>0.18 为标准,筛选出92 种化合物,占甘草中化合物总数的31.72%。根据Mol ID,表1 中显示前10 种成分。尽管甘草酸OB 值为10.62%,DL为0.11,但是甘草中含量最高的成分(>2%),且具有广泛的生物学活性,包括抗肿瘤作用效力[23-26],也列为“候选化合物”。总共获得TCMSP 数据库中列出的93 种化合物。
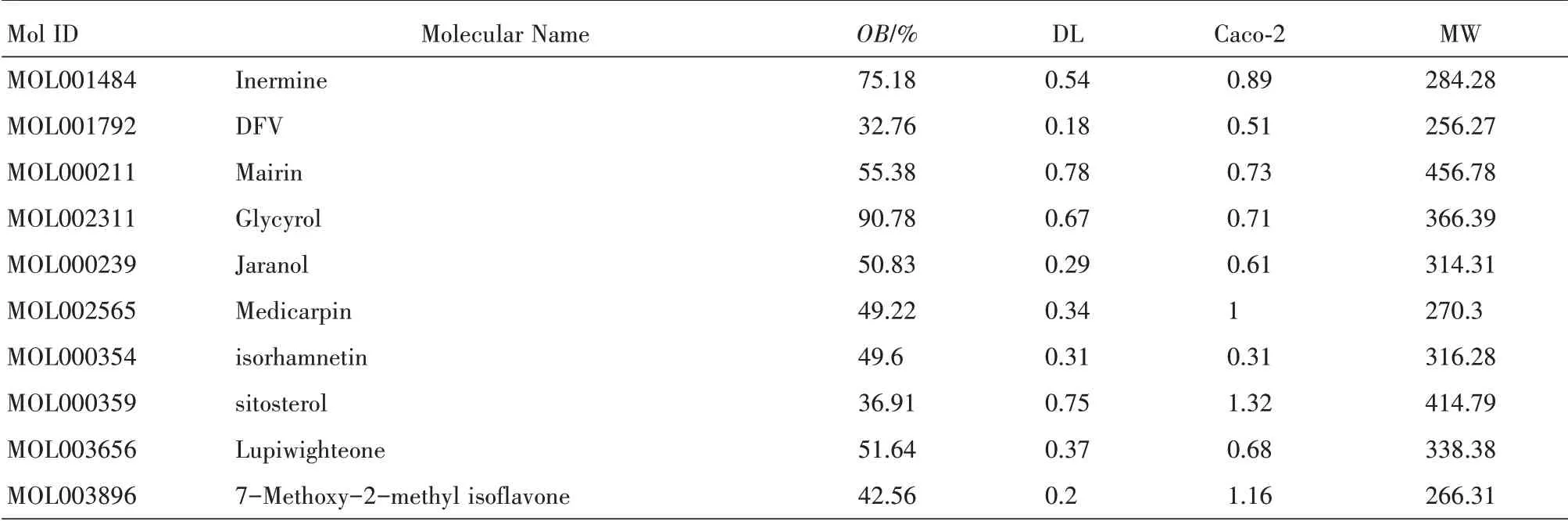
表1 TCMSP 中甘草的92 个代表性成分中的10 个及其相应的预测OB、DL、Caco-2 得分和MW(分子量)
2.2 构建疾病复合目标网络。
基于上述TCMSP 数据库,预测105 个相关靶标与甘草的93 种化合物相互作用。为了验证这些基因与肝癌的相关性,用GeneCards 数据库和OMIM数据库鉴定与疾病相关的基因。消除两个数据库结果的冗余,基于关键字的搜索从数据库中收集总共6318 个HCC 相关基因。将甘草的复合靶标与HCC 靶标相结合,共选择89 个重叠的中枢基因作为治疗HCC 的潜在靶标(图1A)。排除5 种与重叠基因无关的候选化合物,最终选择88 种化学成分作为甘草得活性化合物。5个舍弃的化合物如下:甘草糖苷E、3,22-二羟基-11-氧代-δ(12)-亚麻烯-27-α-甲氧基羰基-29-oic 酸、糖苷、甘草酸和18α-羟基甘草酸。中药配方的疗效机制是多种化合物与靶标协同作用[27,28],因此89 个重叠基因被认为是有效的治疗靶标。数据导入Cytoscape 3.7.1,如图1B 所示,构建疾病复合目标网络。此网络中,12 个关键的绿色节点(包括NCOA1,NCOA2,PPARG,PRSS1,PTGS1,ACHE,AR,CHEK1,ESR1,ESR2,F7,GSK3B)连接的化合物远比其他基因更多。
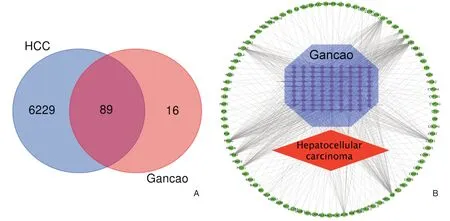
图1 本研究疾病-复合物-靶标网络 A. 肝细胞癌(HCC)和甘草草有关化合物-靶标的Venn 分析;B. 红色节点代表HCC,绿色节点代表潜在目标,紫色节点代表草药化合物,连线代表它们之间的相互作用
2.3 PPI 网络的建设
进一步研究甘草和HCC 相关的89 个潜在靶标之间的相互作用,STRING 软件构建一个PPI 网络阐明蛋白质与蛋白质的相互作用(图2a)。置信度设为大于0.4 并除去与网络无关的靶蛋白,PPI网络中总共获得862 个关联。连通边的数量用于分析PPI 网络并确定前30 个关键蛋白。其中,IL6值(度= 59)显著高于其他节点,表明IL6 蛋白可能在PPI 网络中起到桥梁的作用。此外,疾病-复合物-靶标网络结果显示,PPARG,AR,ESR2和GSK3B与其他蛋白质的相关性更高(图2B)。结果表明,上述基因表现出较高的中枢度且在肝癌中起关键作用。
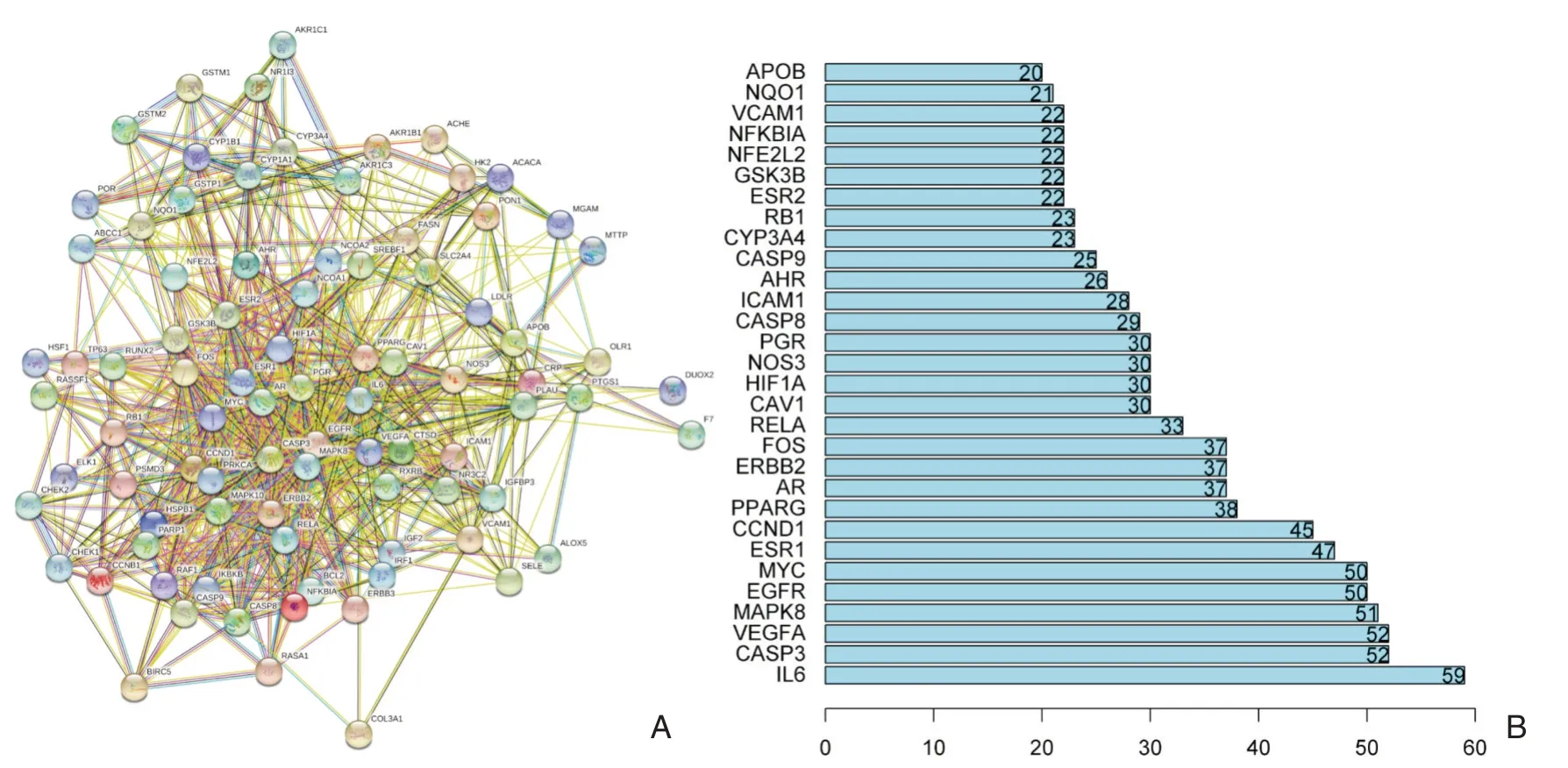
图2 蛋白质-蛋白质相互作用网络(PPI)对String 数据库中生物过程中89 个潜在目标的分析 A PPI 网络分析蛋白质与蛋白质的相互作用;B PPI 网络连通边数量分析确定的30 个关键蛋白
2.4 GO 富集分析与靶基因富集的途径
R 中的clusterProfiler 软件包(版本:3.12.0)进行GO 富集分析,进一步确认潜在靶标的功能。图3 列出20 个最丰富的BP 项(≤0.05)。结果表明,转录激活因子活性,RNA 聚合酶Ⅱ转录调控区序列特异性DNA 结合和RNA 聚合酶Ⅱ近端启动子序列特异性DNA 结合涉及许多靶标,表明甘草能够调控多种肝癌进程中相关基因的表达水平。

图3 甘草和肝癌相关的目标基因的基因本体(GO)分析 X 轴表示这些术语的显著富集的基因比例。Y 轴表示目标基因的GO 中的生物过程项(FDR<0.01),圆圈的大小表示相关基因的数量
R 中的clusterProfiler 程序包,分析相关基因的比例获得了前20 条途径(图4A)。37.07%(33/89)靶标基因参与癌症相关的途径,如“前列腺癌”,“结肠直肠癌”,“胰腺癌”,“癌症相关蛋白多糖途径”,“膀胱癌”,甚至“肝细胞癌”。表明甘草的药物靶向基因与肝癌等肿瘤发生途径密切相关。EGFR,RAF1 和CCND1 是与6 种癌症相关途径关联最大的靶标基因,表明甘草最可能调节这3 个靶标发挥抗肿瘤作用(图4B)。同时,29.21%(26/89)的靶标基因和2 种肝相关途径有关,即“乙型肝炎”和“丙型肝炎”。肝炎病毒感染是导致慢性肝病致癌重要因素,我们分析了涉及3 种信号通路(“肝细胞癌”,“乙型肝炎”和“丙型肝炎”)的网络并探索高度联系的靶标分子。如图4C 所示,RAF1,MYC 和RB1 是与3 中信号通路联系最密切的分子。RAF1 通过两个网络参与8 条信号通路。在图4A 的前20 条途径,RAF1 参与14 条途径,这表明RAF1 在甘草发挥抗HCC 作用中具有重要意义,这与Rui Zhou 等人的研究一致[29]。
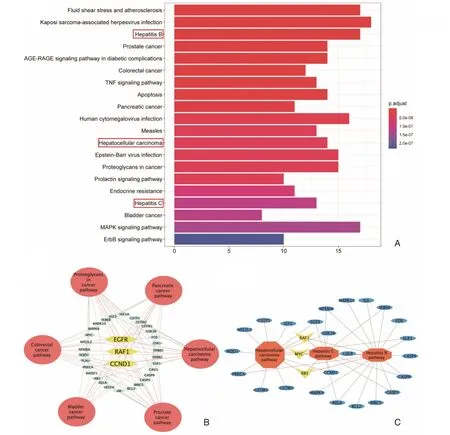
图4 主要潜在靶标的KEGG 富集的主要信号通路途径 A. 选择按基因比例测量的前20 条途径,证明主要潜在靶标的关键生物学作用。横坐标代表每个途径中的目标计数。纵坐标表示主要路径。B. 癌症相关途径和潜在致癌基因的网络。粉色,浅绿色和黄色分别代表途径,基因和中枢基因。C. 建立与肝脏相关的通路和潜在目标的网络。橙色,蓝色和黄色分别表示信号通路,靶标和枢纽基因
2.5 甘草信号通路
基于上述的KEGG 信号通路富集分析前20 条富集通路的结果(图4 所示),为了更全面、详尽地阐述甘草在肝癌中的具体作用机制,我们进一步筛选出6 条癌症相关通路:“胰腺癌”、“肝癌”、“前列腺癌”、“膀胱癌”、“结直肠癌”和“癌症相关的蛋白多糖通路”和2 条肝脏疾病相关的通路:“乙肝病毒通路”和“丙肝病毒通路”,通过对KEGG 数据库中与甘草相关的这8 条信号通路中具体的信号分子进行综合分析,最终汇总得到图5 所示结果。可以发现,这一整合分析后的综合的甘草-肝癌信号通路中,还涉及了“TNF 通路”,“ERBB 通路”,“MAPK 通路”和“凋亡通路”。并且,这12 个通路可以分为三个具体的治疗模块:增殖模块、凋亡模块和炎症模块,这提示甘草可能可以通过调控上述的“TNF 通路”,“ERBB 通路”和“MAPK通路”等明星通路进而抑制肝癌细胞的增殖,促进肝癌细胞的凋亡和加速“肝炎-肝硬化-肝癌”的进程。
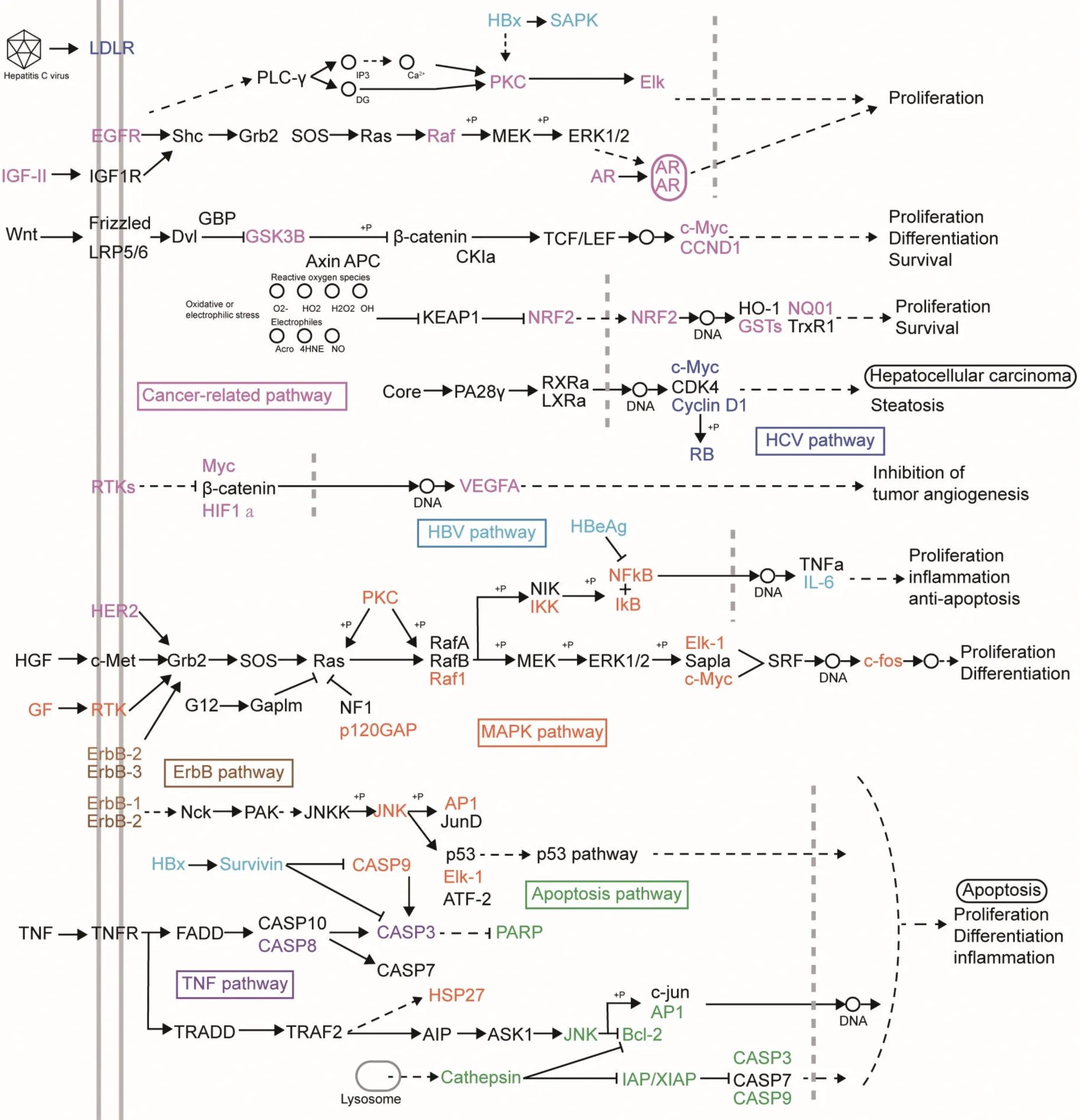
图5 甘草信号通路和治疗模块 甘草针对的主要靶标分子分布在整合的甘草信号途径上。构建的甘草途径由十二种信号途径(以不同的颜色表示)整合而成,这十二种通路主要从图4 中筛选得到的与癌症、肝脏疾病相关的通路。具体各个通路中的分子信息来源于KEGG 数据库(https://www.kegg.jp)。实线和虚线箭头表示直接和间接激活,T 箭头表示抑制作用
3 讨 论
治疗癌症的新靶标是探索抗恶性肿瘤新药的有效手段。甘草是使用最广泛的草药之一,已被用于治疗多种疾病[30-32]。但甘草能否在肝癌中发挥抗肿瘤作用尚不清楚。在这项研究中,我们使用网络药理学方法来分析甘草在肝癌治疗中的作用机理。
具有良好的OB(>30%)和DL(>0.18)的化合物可以在疾病中产生令人满意的药物活性的结果。本研究从甘草的290 种化学成分中鉴定93 种。其中大多数欧亚甘草黄酮都具有较高的OB 和DL值,例如甘草查尔酮A(40.79%,0.29),甘草查尔酮B(76.76%,0.19),甘草查尔酮G(49.25%,0.32),甘草苷(65.69%,0.74),甘草利酮(63.58%,0.47),光甘草定(53.25%,0.47)甘草异黄酮(46.27%,0.44)。特别的,甘草苷是甘草水提取物的质量控制标志物,且已在临床实践中使用,据报道具有抗氧化和抗病毒活性[33,34]。甘草酸在胃肠道中可被水解为18β-甘草次酸,表明该水解产物可能是体内的甘草酸的活性形式,并解释在低OB 值和OL 值低的情况下,甘草酸仍可发挥多种作用[35]。有报道称甘草次酸抑制致癌启动子,并作为HCC 的活性靶向配体用于诊断和治疗[36]。
药物-靶标网络中识别出共同的生物学特征将提供重要的信息,更好地了解潜在基因的相互作用机制[37]。将疾病-复合物-靶标网络与PPI 网络相结合的结果,与其他蛋白质相比,PPARG,AR,ESR2 和GSK3B 表现出更高的质量(图2B)。这四个中枢基因中,发现PPARG 与最可能的靶标相互作用(38),其次是具有22 个潜在靶标的蛋白AR(37),ESR2(22)和GSK3B。另外,PPARG,AR,ESR2 和GSK3B 分别与甘草的66、67、55 和57 个成分相连。这些表明,这四个分子可能在甘草的药理作用中起更大的作用。网络中更多的中心蛋白是IL6,CASP3 和VEGFA,它们相互作用最多的蛋白分别为RAF1,MYC 和RB1。有趣的是,这三个还参与图5 中通过甘草途径鉴定的三个模块。IL6参与炎症模块,CASP3 参与了凋亡模块,VEGFA 参与了增殖模块。
通过研究活性成分和潜在靶标,该网络揭示甘草可能通过多种信号途径和各种生物细胞过程治疗肝癌。根据KEGG 分析,我们揭示甘草可能通过干扰细胞增殖,凋亡和炎症而具有治疗作用。此外,在20 个GO 中,我们得出的结论是,潜在的靶标主要与转录激活因子和RNA 聚合酶Ⅱ相关。同时,细胞增殖和凋亡相关的某些途径,例如TNF 途 径(hsa04668,程 度=13),MAPK 途 径(hsa04010,程度=17)和细胞凋亡途径(hsa04210,程度=14)都有很强的相关性。另外通过KEGG,还识别几种与癌症有关的途径,包括三种消化系统肿瘤(胰腺,HCC 和直肠)和两种泌尿系统肿瘤(膀胱和前列腺)。结果阐明,甘草通过多种途径抑制肝癌的进展,在肝癌治疗领域具有巨大潜力。

