壳聚糖/富含血小板血浆凝胶促进骨髓间充质干细胞成骨分化的研究*
吴广升 王亚男 马丛丛 惠光艳
壳聚糖(chitosan,CS)是一种来源于虾、蟹壳等 材料的天然大分子多糖,以CS为基础制备的壳聚糖温敏凝胶具有优秀的生物学特性,如:生理中性、温敏性、可注射性、可降解性、对大分子药物的缓释性等。将壳聚糖温敏凝胶作为载体,负载细胞及药物用于医学、生物学等方面的研究已经取得了良好的效果[1-3]。富含血小板血浆(platelet-rich plasma,PRP)可以从血液中提取并含有多种生长因子,如,转化生长因子-β、血管内皮生长因子、血小板衍生生长因子、胰岛素样生长因子-1等。PRP制备过程具有取材方便、低成本、微创等特点,已经被广泛应用于骨组织再生、牙周组织再生、皮肤及粘膜损伤修复等领域的基础研究及临床应用[4]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)可以从患者自身骨髓中提取,具有来源充足、增殖能力强、无免疫源性、易于接种成活等优点,在组织工程研究领域是应用最广泛的种子细胞[5,6]。
本实验将犬BMMSCs植入CS/PRP凝胶中并在体外培养7d,观察BMMSCs在CS/PRP凝胶中成骨分化情况,为CS/PRP凝胶作为支架材料应用于骨组织再生提供初步的研究依据。
1.材料和试剂
1.1 主要试剂与仪器CS(博益特生物公司,医用级,脱乙酰度91%,青岛),β-GP、维生素C、地塞米松、吲哚美辛、3-异丁基-1-甲基黄嘌呤、胰岛素、牛凝血酶(Sigma,美国),淋巴细胞分离液(索莱宝生物公司,北京),培养板(Corning,美国),茜素红、油红O染色液(雷根生物,北京),乙酸(优级纯,国药集团),OCN一抗抗体(Abcam,美国)、OPN一抗抗体(Santa,美国)、二抗免疫组化试剂盒(中杉金桥生物,北京),磁力搅拌器(金坛荣华,江苏),振荡搅拌器(跃进医疗器械厂,上海),倒置显微镜(Olympas,日本),离心机(飞鸽,北京),细胞培养箱(Thermo,德国)。
2.实验方法
2.1 犬BMMSCs原代培养及诱导分化实验 参考相关文献[2],将成年雄性杂种犬(青岛大学实验动物中心提供并通过青岛大学动物伦理委员会审核)麻醉、常规消毒铺巾后,采用髂后上棘穿刺法抽取骨髓5ml(含肝素100U/ml)。加等体积PBS稀释后置于淋巴细胞分离液的液面,以1500rpm的速度离心20min,吸取中层云雾状有核细胞层。PBS液洗两次后以1.0×106/ml的密度置于37℃,5% CO2和饱和湿度的孵箱中培养。培养到第3d时首次换液,之后每隔2d换液一次,取第3代BMMSCs进行成骨及成脂诱导分化实验。
2.2 CS温敏凝胶的制备 参考相关文献[7],将0.2gCS加入8ml 0.1mol/l乙酸溶液中,磁力搅拌器上持续搅拌2h;0.56gβ-GP溶于2ml双蒸水中后,两种溶液冰浴15min,并将β-GP逐滴加入到CS溶液中,并持续搅拌10min。获得CS质量浓度为2%,β-GP质量浓度为5.6%的CS/β-GP溶液。最后将CS/β-GP溶液置于37℃恒温孵箱内10min,观察凝胶形成情况。
2.3 PRP的制备 参考相关文献[8]静脉抽取犬全血9ml放入含有1ml3.8%枸橼酸钠抗凝剂的15ml离心管内,轻柔的上下翻转离心管,使血液与抗凝剂充分混匀。采用2步法离心,常温下1500转/分离心10min,将红细胞与血浆分离,再3000rpm的速度离心10min,使富血小板血浆与乏血小板血浆分开,获得约1ml的PRP。
2.4 CS/PRP凝胶制备 如文献所述方法[8],将PRP按体积比1∶1的比例逐滴加入CS/β-GP溶液中,先用牙周探针充分搅匀CS/β-GP与PRP的共混液,再加入适量的1000U/ml牛凝血酶(含0.1g/ml CaCl2),然后在振荡搅拌器震荡2min,进一步混匀,获得CS/β-GP与PRP体积比为1∶1的CS/PRP共混液。最后将CS/PRP共混液置于37℃恒温孵箱内10min,观察凝胶形成情况。
2.5 CS凝胶及CS/PRP凝胶负载BMMSCs体外培养实验 将适量BMMSCs离心弃上清后分别滴加入CS/β-GP溶液及CS/PRP溶液,震荡混匀(BMMSCs浓度为1×106/ml),分别滴加入24孔板中(每孔0.6ml),置于37℃恒温孵箱内10min形成凝胶后,再分每孔加入1ml DMEM培养液,隔天换液。
2.6 HE染色及免疫组化分析 负载了BMMSCs的CS凝胶及CS/PRP凝胶体外培养7d后,先使用PBS液冲洗3遍,再用多聚甲醛侵泡24h固定,最后用石蜡包埋标本、切片,分别进行HE染色及免疫组化观察。组织切片经过二甲苯脱蜡、酒精梯度脱水、高压抗原修护后滴加一抗4℃过夜,二抗免疫组化试剂盒进行染色。光镜下观察BMMSCs在CS凝胶组及CS/PRP凝胶组中OPN和OCN的表达情况。将样本置于400倍光镜下,随机选择5个高倍视野进行观察并拍照,通过Image J2x图像分析软件对每个的样本的灰度值进行计算分析。Image J软件灰度值计算的原理是:阳性结果越强,棕褐色染色越深,白光的穿透效率越低,得到的灰度值越小,默认灰度值范围为0~255[1]。
2.7 统计学方法 实验结果均采用均数±标准差(-x±S)形式表示,通过SPSS 19.0软件对实验数据进行统计学分析,采用one-way ANOVA方法进行方差分析,P<0.05表示差异具有统计学意义。
3.结果
3.1 BMMSCs形态学观察原代接种2d后,BMMCSs贴附于细胞培养瓶底部,形态呈多边型、星型、三角形,并伴有散在分布的小细胞克隆。经过7~10d的培养,BMMCSs铺满80%的瓶底面积时,可以进行传代。第3代BMMCSs呈三角形及长梭形形态,并且轮廓清晰、伸展充分。
3.2 多向分化诱导结果 经过成骨诱导21d后,BMMCSs茜素红染色阳性,大量圆形或椭圆形的红色矿化结节位于呈铺路石样紧密排列的BMMCSs表面上(图1A)。油红O染色显示:BMMCSs在体外成脂诱导14d后,小气泡样的圆形红色脂滴呈弧形排列在BMMCSs内(图1B)。
3.3 CS/β-GP溶液成胶过程及性状CS/β-GP溶液在室温下为透明且流动性好的液体,pH值为6.8~7.0。置于37℃恒温水浴箱,8~10min后可见CS/β-GP溶液已凝胶化,呈白色或淡黄色。
3.4 BMMCSs在CS凝胶及CS/PRP凝胶中生长情况 如图2所示,体外培养7d后,BMMCSs在CS凝胶及CS/PRP凝胶中均可以存活,细胞核呈蓝色椭圆形。
3.5 BMMCSs在CS凝胶及CS/PRP凝胶中OCN及OPN表达情况 如图3所示,CS/PRP凝胶组中,OCN在BMMCSs胞浆中呈强阳性表达,黄褐色(图3A)。OPN在BMMCSs胞浆中呈阳性表达,黄色(图3C)。CS凝胶组中,OCN和OPN在BMMCSs胞浆中均呈弱阳性表达(图3B,3D)。图4为OCN及OPN在CS凝胶及CS/PRP凝胶中表达水平半定量分析结果。在OCN灰度值分析中,CS/PRP组显著小于CS组(P<0.01)。在OPN灰度值分析中,CS/PRP组也显著小于CS组(P<0.05)。说明CS/PRP组中,OPN和OCN的表达水平均高于CS组。
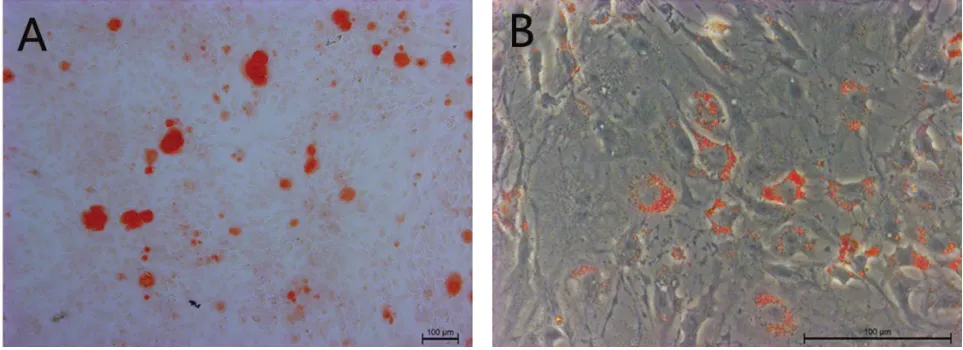
图1 BMMCSs多向分化潜能鉴定(A,茜素红矿化结节染色,×100;B,油红O脂滴染色, ×400)
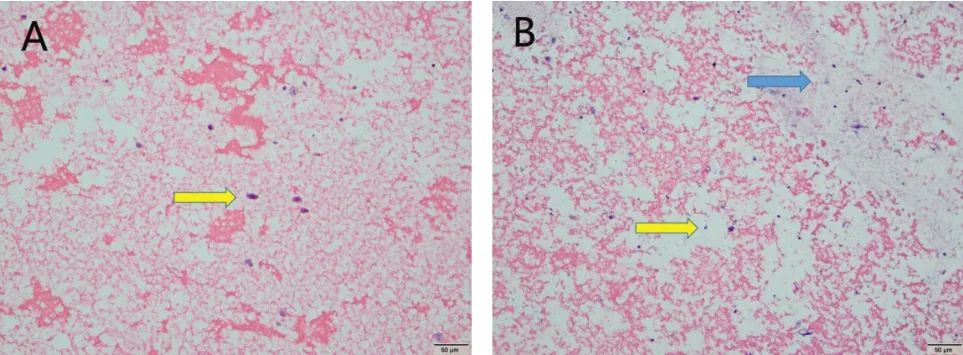
图2 BMMCSs在体外培养7d后HE染色(A,BMMCSs在CS凝胶中生长情况, ×100;B,BMMCSs在CS/PRP凝胶生长情况,×100),示BMMCSs,示PRP。
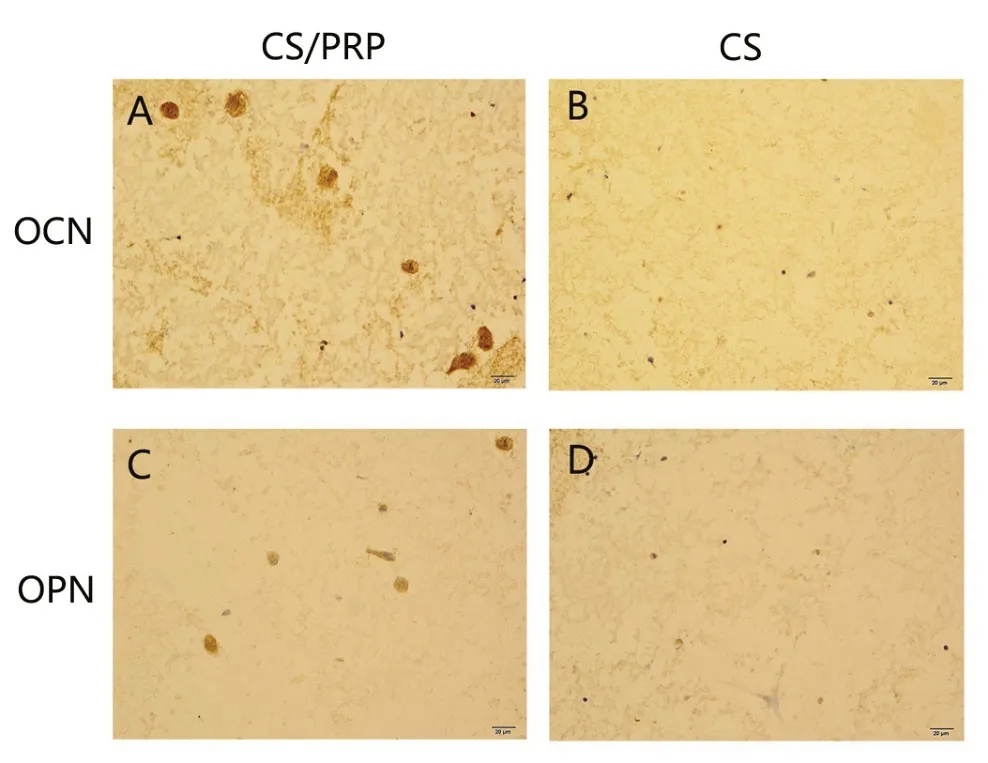
图3 BMMCSs在CS凝胶及CS/PRP凝胶中OCN及OPN表达情况(×400)
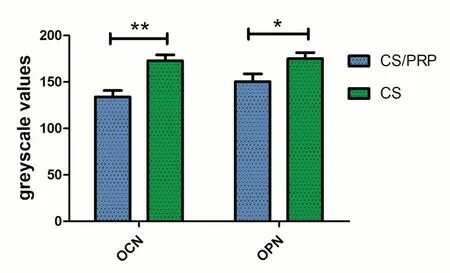
图4 通过灰度值半定量分析OCN及OPN在CS凝胶及CS/PRP凝胶中表达水平(*P<0.05,**P<0.01)
4.讨论
PRP是一种取材方便、微创、成本低廉并能提供大量自体生长因子的血液制品。PRP中的血小板通过脱颗粒作用被激活后,可以释放多种生长因子,其含量是全血中的3-5倍,可以促进组织修复再生。将PRP复合入合适的支架中,通过释放生长因子在可以促进骨细胞的趋化、分化、增殖,可以调节骨的重建与重塑[4]。有文献报道[9]PRP中血小板的激活方式对各类生长因子持续释放的时间及累计释放的量有重要影响。PRP中生长因子可持续释放8-10d,即在血小板的整个生命周期中均有生长因子释放,并且PRP可以维持这些生长因子的正常生理比例。本课题组前期研究结果中证实,CS与PRP共混后,可以通过控释PRP中生长因子的释放促进BMMSCs增殖及碱性磷酸酶的分泌达7天之久[10]。
许多文献指出CS具有良好的生物相容性,可以作为生长因子、细胞、基因、纳米粒等载体并维持其活性[11-13]。Ma等[14]将巨噬细胞与siRNA同时加入CS水凝胶中体外培养,发现CS水凝胶可保持细胞较高的活力(>88%),并且对RANK基因沉默效果可长达9d。本课题组前期通过扫描电镜观察冻干后的CS/PRP凝胶呈多孔的海绵状结构,CS/PRP比率为1∶1时孔径为100~200μm[7]。本实验中,如图2所示,BMMSCs可以在CS及CS/PRP凝胶中呈圆形,存活良好,由于CS与BMMSCs的胞浆均嗜伊红被染成红色而不易区分,这可能和BMMSCs在CS凝胶中呈球形生长有关。Huang等[15]从人脂肪和胎盘中分离得到的MSCs,分别在壳聚糖膜和透明质酸修饰的壳聚糖膜上培养,发现这两种MSCs均呈三维球体附着在CS膜上生长,并且维持MSCs干细胞标记基因的表达。李华杰等[16]发现脐带组织来源的MSCs在CS膜上成球生长,与规贴壁培养相比,CS膜培养可显著促进MSCs的迁移趋化特性及迁徙相关基因表达水平。本课题在后续的实验中通过扫描电镜观察,也发现BMMSCs在壳聚糖凝胶内具有呈球形生长的特性,说明CS不仅具有良好的生物形容性,还可以为BMMSCs提供一个呈球形生长并维持干细胞特性的环境。
OCN是由成骨细胞合成、分泌到骨基质中的非胶原蛋白,是成骨细胞分化成熟的标志[17]。OPN是由成骨细胞分泌一种糖基化的磷蛋白,通过调节羟磷灰石晶体的生长可以调节骨的矿化功能和速度,是成骨细胞分化的早期标志[18]。本研究中,BMMSCs在CS/PRP凝胶中培养7d后,OCN呈强阳性表达(图3A),OPN阳性表达(图3C),说明CS/PRP凝胶可以为BMMSCs提供一个成骨诱导分化的环境。本课题组前期实验结果[2]也表明CS/PRP凝胶负载BMMSCs注射入犬的牙周缺损模型中可以取得更佳的骨再生效果,可能与CS/PRP凝胶可以缓释PRP中的多种生长因子,持续地促进BMMSCs增殖和成骨分化有关。农桔安等[19]以明胶海绵负载MSCs和PRP植入羊椎间盘纤维环缺损,通过马松三色、免疫组化的方法证实取得了良好的纤维环修复效果。Liao等[20]以含有PRP和双相磷酸钙的可注射热凝水凝胶作为支架,负载脂肪干细胞修复兔颅骨缺损,通过一系列体外及体内实验,发现此凝胶体系在体外可以促进ALP、OCN等成骨相关基因的表达,在体内实验中不仅促进兔颅骨缺损的再生,通过免疫组化实验发现新骨中高表达OCN。
综上所述,尽管以多种凝胶支架材料复合PRP可以到达促进软骨、骨等组织再生的效果,但为了更好地让PRP应用于临床,仍需进行大量的临床前研究以及临床验证探索。

