乳酸氧化酶的固定化研究
刘 洋,周晶辉,赵 强,赵士敏,许 岗
(湖南福来格生物技术有限公司,湖南 长沙 422010)
丙酮酸是生物代谢的重要中间体,丙酮酸及其盐被越来越广泛地应用于药物前体、食品添加剂和减肥补充剂等的制备,市场潜力巨大[1-2]。乳酸是制备丙酮酸的重要原料,其价格仅是丙酮酸的10%。随着生物技术的发展,生物催化越来越多地运用于丙酮酸的制备[3]。以乳酸为原料生物催化制备丙酮酸的常用酶有乳酸脱氢酶(lactate dehydrogenase,LDH)、乳酸氧化酶(lactate oxidase,LOx)[4-5]。其中LDH需要有NAD+参与反应,其价格昂贵,不易于工业化生产[5];而LOx作为一种黄素蛋白酶,以黄素核苷酸(FMN)作为辅因子,FMN和酶蛋白牢固结合,反应过程中无需额外添加辅因子,节约了生产成本[6-7]。因此,以LOx为催化用酶更适合于丙酮酸的工业化生产。
固定化酶在生产中具有产物易分离、可重复使用等优点,相对于游离酶更具应用价值[8-9]。目前,文献报道的固定化LOx多用于制备检测微量乳酸的生物传感器[10-12],且不具备生产能力;而用于工业化生产丙酮酸的固定化LOx也未能克服固定化酶稳定性差的问题,如刘真等[13]制备的磁性壳聚糖固定化LOx转化5批次后,残余酶活仅70%;王艳等[14]采用包埋法制备的海藻酸钙凝胶包埋LOx反应5批次后,残余酶活仅85%。酶的基本性质对酶固定化有直接影响。鉴于此,作者首先对LOx游离酶的基本性质进行研究,优化LOx的固定化条件,并考察固定化LOx的使用稳定性及储存稳定性,以期为固定化LOx的工业化应用提供参考。
1 实验
1.1 菌种与试剂
乳酸氧化酶重组菌Pet-30-avLOx,自行克隆、构建并保存。
ECHA/S氨基载体,意大利Resindion S.R.L公司;ES-1环氧树脂,天津南开和成科技有限公司;乳酸(含量80%),河南金丹乳酸科技股份有限公司;过氧化氢酶(0.3 MU·mL-1),山东泰安信得利生物工程有限公司;其余试剂均为分析纯。
1.2 LOx的分离纯化
1.2.1 发酵液的制备
挑取保存的E.coliBL21(DE3)/Pet-30-avLOx单菌落接种到含有50 mg·L-1卡那霉素的LB培养基中,37 ℃、220 r·min-1摇床过夜培养;将培养液按1.5%的接种量转接到含有50 mg·L-1卡那霉素的160 mL TB培养基中,37 ℃、220 r·min-1培养至OD600值约为0.4~0.6,加入1 mmol·L-1IPTG,25 ℃、220 r·min-1过夜诱导表达,即得发酵液。
1.2.2 LOx的分离纯化
将上述发酵液于4 ℃、5 000 r·min-1离心3 min,收集菌体;用pH值7.5的50 mmol·L-1磷酸盐缓冲液重悬菌体;控制均质机压力800~900 bar,均质3次破碎菌体后,于4 ℃、10 000 r·min-1离心15 min,收集上清液;上清液用NI柱纯化,10 mmol·L-1咪唑洗涤至无蛋白流后,再用300 mmol·L-1咪唑洗脱;用10 kD超滤膜浓缩脱盐,即得LOx游离酶。
1.3 LOx的固定化
1.3.1 固定化载体的预处理
氨基载体活化:将100 g ECHA/S氨基载体用pH值8.0的100 mmol·L-1磷酸盐缓冲液清洗,真空抽干溶液后,加入400 mL终浓度为5%的戊二醛溶液,维持pH值为7.8~8.2,25 ℃搅拌1 h后真空过滤,再用20 mmol·L-1磷酸盐缓冲液清洗至无戊二醛残留。
环氧基载体清洗:用20 mmol·L-1磷酸盐缓冲液清洗ES-1环氧树脂至无泡沫产生。
1.3.2 固定化LOx的制备
向LOx游离酶液中加入一定浓度的磷酸氢二钾溶液,用磷酸氢二钾溶液调节pH值,按一定投料比(游离酶与载体的比例,U∶g,下同)加入ES-1或ECHA/S载体,搅拌过夜,用pH值7.5的25 mmol·L-1磷酸盐缓冲液洗涤5次,即得ES-1固定化LOx、ECHA/S固定化LOx。
1.4 固定化LOx酶活的测定
用0.1 mol·L-1pH值7.5的Tris-HCl缓冲液配制5%乳酸溶液。将40 mL经30 ℃预热的5%乳酸溶液加入到30 ℃恒温水浴杯中,加入适量固定化LOx、0.5 mL过氧化氢酶(酶活>20 000 U·mL-1),0.7 L·min-1通氧反应10 min后,取上清液1 mL置于50 mL容量瓶中,采用高效液相色谱测定丙酮酸的生成量。
色谱条件:色谱柱为CenturySIL C18-BDS(4.6 mm×200 mm, 5 μm),流动相为0.58%磷酸二氢铵(pH值3.5)-甲醇(100∶5,体积比),流速1.0 mL·min-1,检测波长215 nm,柱温25 ℃,进样量20 μL。
酶活定义:在30 ℃、pH值7.5的条件下,每分钟生成1 μmol丙酮酸所需的酶量即为1个酶活单位(U)。比酶活为1 mg酶所具有的酶活单位。
1.5 固定化LOx的使用稳定性及储存稳定性
在350 mL反应体系中加入6%乳酸、6 300 U固定化LOx、5 mL过氧化氢酶、30 μL消泡剂。控制通氧量为240 L·h-1、反应温度为30 ℃、pH值为6.8~7.0。每0.5 h取样,测定丙酮酸生成量和乳酸残留量。当乳酸残留量小于3 mg·mL-1时,即认为达到反应终点。用去离子水将固定化LOx清洗干净后,进行下一批次反应,考察固定化LOx的使用稳定性。
分别将1.5 g固定化LOx加入到若干支10 mL灭菌离心管中,于4 ℃储存,持续监测固定化LOx的储存稳定性。
2 结果与讨论
2.1 LOx游离酶的基本性质
2.1.1 pH值稳定性
LOx游离酶酶活为688.4 U·mL-1,比酶活为158.5 U·mg-1。不同pH值下,将LOx游离酶于4 ℃储存45 d,考察其pH值稳定性,结果如图1所示。
由图1可知,pH值为5时,LOx游离酶的酶活随储存时间的延长缓慢下降,储存45 d后仍保留77%的酶活;其它pH值条件下,储存45 d后酶活可以保留90%以上。表明,LOx游离酶有较好的pH值稳定性。

图1 LOx游离酶的pH值稳定性Fig.1 pH value stability of free LOx
2.1.2 热稳定性
在pH值为7时,将LOx游离酶分别置于35~60 ℃水浴中保温1 h,考察LOx游离酶的热稳定性,结果如图2所示。
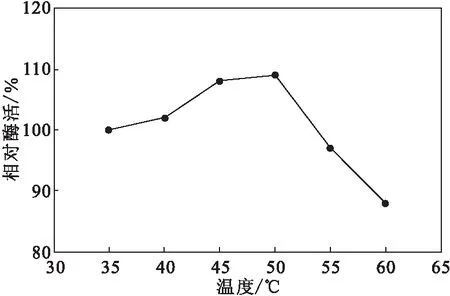
图2 LOx游离酶的热稳定性Fig.2 Thermal stability of free LOx
由图2可知,当温度低于50 ℃时,LOx游离酶的酶活保持稳定,无酶活损失;当温度升至60 ℃时,也仅有12%的酶活损失。表明,LOx游离酶具有较好的热稳定性。
2.2 LOx固定化条件优化
2.2.1 载体选择
向LOx游离酶液中加入终浓度为1 mol·L-1的磷酸氢二钾溶液,用磷酸氢二钾溶液调节pH值至7.0,按投料比4 000∶1加入载体ES-1或ECHA/S,25 ℃搅拌过夜,用pH值7.5的25 mmol·L-1磷酸盐缓冲液洗涤5次,测得ECHA/S固定化LOx和ES-1固定化LOx的酶活相差不大,分别为122.60 U·g-1和121.61 U·g-1。4 ℃下,2种固定化LOx的储存稳定性如图3所示。
由图3可知,4 ℃下,ES-1固定化LOx的酶活随储存时间的延长逐渐降低,77 d后仅保留9%的酶活;而ECHA/S固定化LOx的酶活几乎没有损失,77 d后仍保留98%的酶活。表明,ECHA/S氨基载体更适于LOx的固定化。

图3 固定化LOx的储存稳定性Fig.3 Storage stability of immobilized LOx
2.2.2 投料比选择
按2.2.1方法,分别按投料比500∶1、1 000∶1、2 000∶1、3 000∶1、4 000∶1、5 000∶1进行固定化,考察投料比对固定化LOx酶活的影响,结果如图4所示。

图4 投料比对固定化LOx酶活的影响Fig.4 Effect of material ratio on enzyme activity of immobilized LOx
由图4可知,当投料比为500∶1时,由于载体处于不饱和吸附状态,固定化LOx的酶活较低,相对酶活不足50%;随着酶投加量的增加,载体吸附逐渐趋于饱和,固定化LOx的酶活迅速升高;在投料比达到1 000∶1后,载体处于过饱和吸附状态,固定化LOx的酶活随着酶投加量的增加缓慢升高。因此,选择投料比为1 000∶1。
2.2.3 磷酸氢二钾浓度选择
一般情况下,酶的固定化需要适当盐浓度促进载体与酶分子的表面疏水作用,促使酶分子吸附于载体表面。按2.2.1方法,投料比为1 000∶1,向LOx游离酶液中分别加入终浓度为0 mol·L-1、0.50 mol·L-1、1.00 mol·L-1、1.25 mol·L-1的磷酸氢二钾溶液,考察磷酸氢二钾浓度对固定化LOx酶活的影响,结果如图5所示。

图5 磷酸氢二钾浓度对固定化LOx酶活的影响Fig.5 Effect of dipotassium phosphate concentration on enzyme activity of immobilized LOx
由图5可知,磷酸氢二钾浓度在0~1.00 mol·L-1时,固定化LOx的酶活无明显差异;当磷酸氢二钾浓度为1.25 mol·L-1时,固定化LOx的酶活显著下降。实验发现,加入磷酸氢二钾溶液后酶液瞬间变浑浊,推测为盐浓度过高导致酶的盐析。因此,LOx的固定化无需额外增加盐浓度,这样可大幅降低下游废水的处理难度,节约生产成本。
2.2.4 固定化温度选择
按2.2.1方法,投料比为1 000∶1,分别于20 ℃、25 ℃、30 ℃、35 ℃、40 ℃下进行固定化,考察固定化温度对固定化LOx酶活的影响,结果如图6所示。
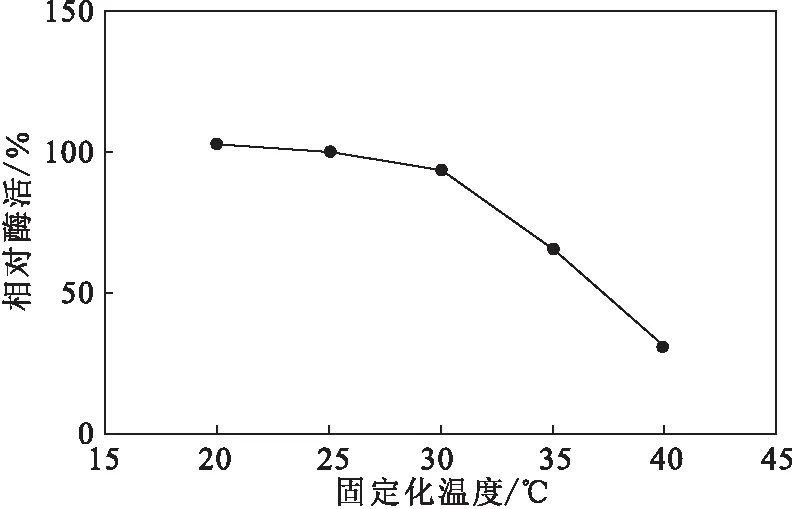
图6 固定化温度对固定化LOx酶活的影响Fig.6 Effect of immobilization temperature on enzyme activity of immobilized LOx
由图6可知,固定化LOx的酶活随固定化温度的升高逐渐降低。可能是由于,酶的固定化使酶的刚性增加,随着固定化温度的升高,酶分子结构逐渐展开,与酶活相关的一些氨基酸残基逐渐暴露,从而被载体固定,导致酶活下降;还可能是由于,酶与氨基载体为共价结合方式,高温不利于共价键的形成[15]。固定化温度超过30 ℃后,固定化LOx的酶活急剧下降;40 ℃时酶活仅为20 ℃时的28%。因此,选择固定化温度为20 ℃。
2.2.5 固定化pH值选择
按2.2.1方法,投料比为1 000∶1,固定化温度为20 ℃,调节LOx游离酶液pH值分别为6、7、8、9进行固定化,考察固定化pH值对固定化LOx酶活的影响,结果如图7所示。

图7 固定化pH值对固定化LOx酶活的影响Fig.7 Effect of immobilization pH value on enzyme activity of immobilized LOx
由图7可知,固定化pH值对固定化LOx酶活无显著影响,pH值为7~8时,固定化LOx的酶活稍高,而游离酶pH值正好处于这个范围。因此,LOx固定化时无需特意调节pH值,这样可以避免pH值调节过程中造成酶失活的可能性,从而提高固定化LOx的使用稳定性。
综上,确定LOx的最优固定化条件为:使用ECHA/S氨基载体,投料比为1 000∶1,自然盐浓度,固定化温度20 ℃,固定化pH值7~8。
2.3 固定化LOx的催化性能及稳定性验证
经测定,固定化LOx的丙酮酸摩尔收率约为71%,与游离酶(约70%)相当。进行13批次反应后,固定化LOx酶活整体保持稳定(图8),酶活无明显损失。固定化LOx在4 ℃下储存60 d和130 d后,相对酶活分别为102%和103%,酶活无损失。表明,制备的固定化LOx具有较好的使用稳定性和储存稳定性。
3 结论
将LOx在大肠杆菌E.coliBL21(DE3)中重组表达,经分离纯化后得到游离酶,该游离酶具有较好的pH值稳定性和热稳定性。采用ECHA/S氨基载体,在LOx游离酶与载体比例为1 000∶1(U∶g)、自然盐浓度、固定化温度为20 ℃、固定化pH值为7~8时,搅拌过夜固定,得到固定化LOx,该固定化LOx具有较好的使用稳定性和储存稳定性,转化13批次后,酶活无明显下降;4 ℃下储存130 d,无酶活损失。该固定化工艺简单,对设备要求低,仅需对固定化温度稍加控制,制备的固定化LOx酶活高、稳定性好、可多批次重复使用,为产业化应用提供了参考。

图8 固定化LOx的使用稳定性Fig.8 Use stability of immobilized LOx

