干扰KISS1基因对猪卵巢颗粒细胞功能的影响
陆思羽,何颖婷,周小枫,辛晓萍,张爱玲,袁晓龙,张哲,李加琪
干扰KISS1基因对猪卵巢颗粒细胞功能的影响
陆思羽1,何颖婷1,周小枫1,辛晓萍1,张爱玲2,袁晓龙1,张哲1,李加琪1
(1广东省农业动物基因组学与分子育种重点实验室/国家生猪种业工程技术研究中心/华南农业大学动物科学学院,广州 510642;2广东高校应用生态工程技术开发中心/广东第二师范学院生物与食品工程学院,广州 510310)
卵泡是卵巢的基本结构和功能单位,其主要功能是排卵和分泌激素。颗粒细胞能促进卵泡发育,其过度凋亡能抑制卵泡发育,诱导卵泡闭锁,进而降低雌性动物发情频率,影响雌性动物繁殖力。现已有研究发现,在卵巢组织中发挥着重要作用。【】研究通过干扰,以阐释对猪卵巢颗粒细胞凋亡、周期及分泌雌激素能力的影响,为完善在猪颗粒细胞中的分子调控机制提供一定的依据。设计的干扰片段KISS1-siRNA,转染体外培养的母猪卵巢颗粒细胞,通过实时定量PCR(quantitative real time PCR, qRT-PCR)检测干扰对母猪卵巢颗粒细胞中磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)信号通路部分基因转录水平的影响;采用流式检测法、Annexin V- FITC及ELISA技术,分别探究干扰对颗粒细胞周期、凋亡及雌二醇(estradiol, E2)分泌量的影响,最后使用qRT-PCR技术检测对雌激素受体及雌激素信号通路关键基因转录水平的影响。在猪颗粒细胞内,干扰后,PI3K通路激活相关基因、、及转录水平下降,其中关键基因的转录水平显著降低(<0.05),PI3K通路激活抑制相关基因、及转录水平也有所降低;干扰后,颗粒细胞周期在细胞分裂间期(G0/ G1)阻断,细胞的凋亡率显著上升,细胞中E2的浓度显著降低(<0.01),雌激素受体和及雌激素通路的基因、、、和转录水平也相应显著下降(<0.05)。能够参与猪颗粒细胞PI3K和雌激素通路,干扰能够使卵巢颗粒细胞阻滞在细胞分裂间期,促进颗粒细胞凋亡,降低颗粒细胞分泌雌激素的能力,表明对于卵巢颗粒细胞的分裂与生长、雌激素分泌具有重要作用。
母猪;颗粒细胞;;PI3K;E2
0 引言
【研究意义】卵巢是母畜繁育的基础,其主要功能是产生和排出成熟的卵子。卵巢卵泡中的颗粒细胞能够分泌性激素,促进母畜性征的发育及维持,卵巢能否健康发育关系着母畜繁殖能力的强弱及利用年限的长短[1]。卵泡生长发育的本质是颗粒细胞增殖和分化[2],卵泡闭锁的主要标志是颗粒细胞凋亡,颗粒细胞能够为卵巢和卵泡的生长发育提供促性腺激素受体、类固醇激素、细胞因子、生长因子等物质[3],颗粒细胞过度凋亡会导致雌激素分泌减少,孕激素分泌增加[4]等。综上所述,颗粒细胞作为卵泡的重要组成部分,其功能会直接影响卵泡的生长发育,进而影响雌性动物的繁殖能力。本研究将颗粒细胞作为探究卵泡体外发育的细胞模型,通过设计的干扰片段,基于实时定量PCR(quantitative real time PCR, qRT- PCR)试验证明干扰能够影响PI3K/AKT通路的信号传导,并进一步在细胞水平和分子水平探究了干扰对猪卵巢颗粒细胞凋亡、周期及雌激素分泌能力的影响,为完善调控颗粒细胞功能的机制研究提供了一定的理论基础。【前人研究进展】1997年Lee通过原位杂交和差异显示技术首次发现并命名了,该基因位于人类1号染色体1q32-41区,能够抑制肿瘤生长[5],因此可作为区分转移性黑色素瘤和非转移性黑色素瘤的标志物[6]。近年来有研究表明,基因在母畜发情、卵泡生长发育、排卵等生理过程中起着重要的作用[7]。对成年大鼠使用Kisspeptin治疗后,的表达量与大鼠的排卵数成正相关[8-9],而突变,会导致大鼠和小鼠的卵巢功能衰退,卵泡发育异常,进而阻碍卵泡成熟,影响小鼠卵巢黄体组织的形成[9-10]。此外,当小鼠到达初情期时,和在下丘脑-垂体-性腺轴中的表达量显著增高,表明信号可由性腺轴传导,在哺乳动物中枢和神经内分泌系统中发挥作用[8]。这些研究结果表明,在一定程度上影响着母畜的繁殖性能。前期研究已经证实过表达能够促进卵巢卵泡的发育和排卵[8],且在卵泡生长发育的过程中起到重要性作用[7],但目前干扰在猪卵泡颗粒细胞中的作用尚不清楚。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)可以磷酸化磷脂酰肌醇[11],其作为细胞中典型的信号转导通路[12-13],参与调节细胞的生长、分化、增殖和凋亡。PI3K/AKT是调控原始卵泡激活和发育的经典信号通路,是PI3K/AKT通路的终止信号,在初级和次级卵泡中敲除卵母细胞的该基因,PI3K/AKT信号通路仍能够正常激活[14],敲除成年小鼠卵母细胞中的,小鼠的原始卵泡在卵泡池就会发生早衰,且FSH和LH分泌异常,使小鼠丧失生育能力[15],但是敲除颗粒细胞中的,能够减缓颗粒细胞凋亡[16],并促进颗粒细胞增殖。此外蔡竞等证实等表达水平下调能够抑制PI3K/AKT/mTOR信号通路的活性,抑制颗粒细胞增殖,进而影响卵泡发育[17],综上可知卵巢卵泡的发育与PI3K/AKT通路活性相关。【本研究切入点】PI3K信号通路与卵巢卵泡的生长发育密切相关,笔者前期研究表明过表达能够显著降低猪卵巢颗粒细胞的凋亡率,促进颗粒细胞分泌雌二醇(estradiol, E2),显著上调PI3K信号通路关键基因及雌激素受体和的mRNA水平[18],基于干扰猪卵巢颗粒细胞中基因的表达,能够影响PI3K信号通路部分标志基因的表达,我们推测干扰同样也能够影响颗粒细胞功能,因此本研究拟通过干扰,进一步阐释对猪卵巢颗粒细胞功能的影响机制。【拟解决的关键问题】本研究以长大二元杂母猪卵巢卵泡颗粒细胞为试验材料,在转录水平证实干扰能够影响PI3K信号通路相关基因的表达,并拟在细胞和分子水平研究干扰对颗粒细胞凋亡、周期及E2分泌的影响。
1 材料与方法
1.1 试验材料
母猪卵巢颗粒细胞:采集广州市嘉禾望岗屠宰场的长大二元杂母猪卵巢,迅速置于4℃含2%双抗(青霉素和链霉素)的PBS中,尽快返回实验室,并迅速分离卵巢颗粒细胞。
主要试剂:DMEM基础培养基、含EDTA的胰酶稀释液、PBS缓冲液、胎牛血清、青霉素和链霉素购自Hyclone(美国);Lipofectamine®3000转染试剂盒、Opti-MEM®试剂购自Invitrogen(美国);的干扰片段KISS1-siRNA(CAACAAGAAGTGGGA GCAGAA)及对照Scrambled- siRNA由广州锐博生物科技有限公司(中国)合成;Trizol、PrimeScriptTMRT Reagent Kit试剂盒购自TAKARA(日本);无水乙醇、4%甲醛、氯仿、异丙醇购自广州鼎国生物有限公司(中国);SYBR Green qPCR Mix购自Thermo(美国);Annexin V-FITC/PI双染细胞凋亡检测试剂盒和细胞周期检测试剂盒购自江苏凯基生物技术股份有限公司(中国);猪雌二醇试剂盒购自江苏酶免实业有限公司(中国);其他均为常规化学试剂。
1.2 原代颗粒细胞的分离与培养
从屠宰场采集的母猪卵巢,迅速置于4℃含2%双抗(青霉素和链霉素)的PBS试剂中,迅速带回实验室,在准备室用PBS清洗数次。在细胞房超净台取5 mL DMEM于15 mL离心管,使用镊子夹取母猪卵巢,用1 mL注射器小心多次吸取卵泡液共2 mL于15 mL离心管(卵泡直径为3—5 mm);25℃ 800 r/min离心5 min,弃上清,再加入预热的PBS(含1%双抗),轻柔吹打以重悬沉淀细胞,清洗沉淀细胞两次。先加入10 mL完全培养基(含10%小牛血清和1%双抗)于75 cm2细胞培养瓶,再加入5 mL细胞悬液,轻柔摇晃均匀。将培养瓶置于37℃,5% CO2培养箱,48 h后观察颗粒细胞的生长状况,用PBS清洗颗粒细胞两次,加入15 mL的完全培养基,再培养24 h可进行后续相关试验。
1.3 颗粒细胞的接种和转染
铺板:观察细胞状态,当细胞汇合度达到80%左右,用预热的PBS(含1%双抗)清洗颗粒细胞两次;使用5 mL 0.25%的胰蛋白酶消化75 cm2培养瓶中的细胞3—5 min,快速加入5 mL不完全培养基(含10%胎牛血清的DMEM培养液)终止消化,25℃ 800 r/min离心5 min;用预热的PBS(含1%双抗)清洗细胞两次。将细胞悬液均匀加入细胞培养孔中,用完全培养基补充体积,轻柔地摇晃均匀,置于37℃,5% CO2培养箱继续培养。
转染:铺板后细胞的汇合度达到80%左右,即可转染。用预热的PBS清洗颗粒细胞两次,转染方法参照Lipofectamine® 3000试剂盒说明书(每个试验组设计4个重复,使用24孔细胞培养板进行),步骤如下:在灭菌的1.5 mL离心管中加100 μL Opti-MEM和4 μL Lipofectamine® 3000试剂,离心混匀;在新的离心管中依次加入95 μL Opti-MEM、5 μL稀释好的Scrambled-siRNA和KISS1-siRNA(此时干扰片段及其对照终浓度为50 nmol·L-1)及4 μL P3000TM,离心混匀;将Lipofectamine® 3000混合液加到P3000TM混合液中,离心混匀,在室温下孵育10 min;在每孔细胞中加入450 μL不完全培养基及50 μL混合液;转染后将细胞培养板置于37℃,5% CO2培养箱继续培养,6—12 h后换液(防止转染试剂对细胞影响过大)。
1.4 颗粒细胞RNA抽提
从细胞中抽提RNA,不需要对细胞进行消化,直接加入Trizol(10 cm2·mL-1)在冰上放置10—15 min,4℃12 000 r/min离心5 min,将含RNA的上清转移至新的RNase-free管,加入氯仿(氯仿﹕Trizol为 1﹕5),激烈震荡,室温下放置5 min,4℃12 000 r/min离心15 min,将上层水相小心移至新的RNase- free管,加入异丙醇(异丙醇﹕Trizol为1﹕2),轻微颠倒混匀,室温下放置10 min,4℃12 000 r/min离心15 min,去上清。加入与Trizol等量的75%乙醇,清洗抽提的RNA,4℃12 000 r/min离心15 min,去上清,此步骤重复两次。将RNA于室温干燥5—10 min,加入30 μL的DEPC水溶解RNA沉淀。
RNA质检:制备浓度为1%的琼脂糖凝胶,将2 μL RNA样品与2 μL Loading Buffer混匀,15 V/cm电压电泳20 min,使用凝胶成像仪拍照,观察条带,使用紫外分光光度计检测样品OD260/OD280的比值;-80℃保存备用。
1.5 检测关键基因的转录水平
RNA反转录参照TAKARA的PrimerScriptTMRT Reagent Kit说明书。RNA反转录反应体系(10 μL):5×PrimeScriptRT Master Mix,2 μL;Total RNA≤500 ng;补充RNase Free dH2O至总体积达10 μL。RNA反转录反应条件:37℃15 min,85℃5 s。
参照NCBI公布的序列信息,使用Primer primer 5.0设计qRT-PCR引物(表1)。以母猪卵巢颗粒细胞的cDNA为模板,GAPDH为内参。qPCR反应体系(20 μL):2×SYBR Green PCR Master Mix,10 μL;PCR Forward Primer,0.6 μmol·L-1;PCR Reverse Primer,0.6 μmol·L-1;cDNA,2 μL;补充dd H2O至总体积达20 μL。qPCR反应程序:95℃预变性10 min;95℃预变性5 s,60℃延伸1 min,42个循环。引物由上海捷瑞生物科技有限公司合成。
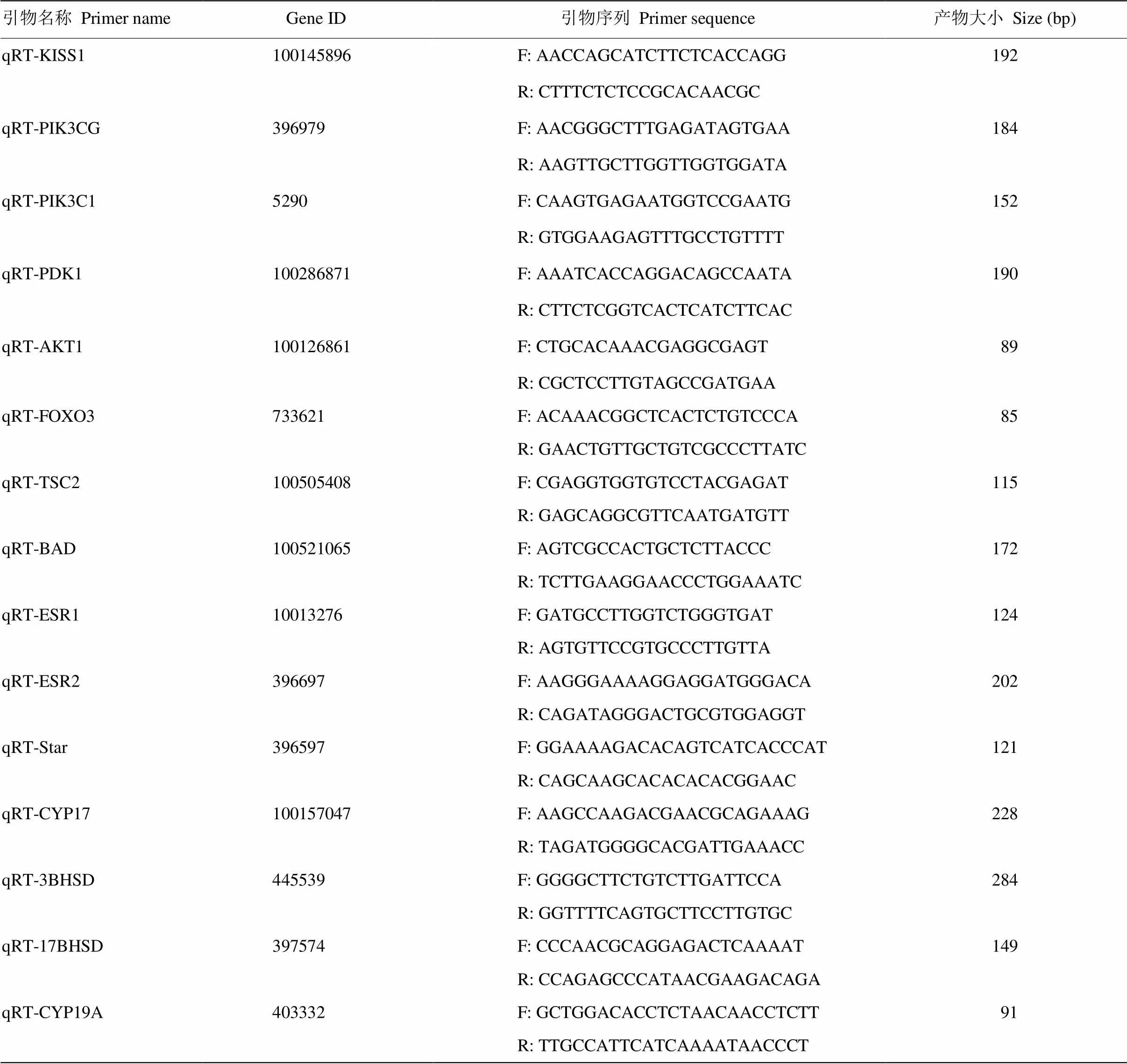
表1 定量引物
1.6 颗粒细胞凋亡检测
参照江苏凯基生物技术股份有限公司的Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书进行颗粒细胞凋亡检测。取细胞接种于6孔板,当细胞汇合度达到80%左右,转染Scrambled-siRNA和KISS1-siRNA于颗粒细胞培养24 h,PBS清洗细胞,使用不含EDTA的胰酶消化细胞,再次用PBS溶液清洗细胞。取0.5 mL 细胞悬液(约5×105个细胞),加入500 µL 1×Binding Buffer,加入5 µL Annexin V-FITC,再加入室温预热的5 µL Propidium Iodide,室温避光孵育5 min,立即用流式细胞仪检测分析(每个试验组设计3个重复)。
1.7 颗粒细胞周期检测
使用江苏凯基生物技术股份有限公司的流式检测细胞周期试剂盒,取细胞接种于6孔细胞板,当细胞汇合度达到80%左右,转染Scrambled-siRNA和KISS1-siRNA于颗粒细胞培养24 h,PBS清洗细胞,使用不含EDTA的胰酶消化细胞,再次用PBS溶液清洗细胞。使用70%的乙醇溶液固定细胞,4℃固定细胞4 h以上,将固定好的颗粒细胞用预冷的PBS洗两次,室温2 000 r/min离心5 min,用400 µL的碘化丙啶轻柔重悬细胞,加入100 µL RNase,4℃避光孵育30 min。24 h内用流式细胞仪检测分析(每个试验组设计3个重复)。
1.8 颗粒细胞上清中E2含量检测
使用ELISA检测细胞上清中E2的含量,参照江苏酶免实业有限公司的猪雌二醇ELISA试剂盒说明书。确定标准品孔和样本孔,在标准品孔中加不同浓度的标准品50 μL;取细胞接种于6孔板,当细胞汇合度达到80%左右,转染Scrambled-siRNA和KISS1- siRNA于颗粒细胞培养24 h,吸取细胞上清1 000 r/min离心20 min,取50 μL于96孔板即为样本孔,空白孔不加;用封板膜封住反应孔,37℃孵育30 min,弃去液体,在吸水纸上拍干,每孔加入350 μL的洗涤液,静置1 min,弃去液体,在吸水纸上拍干,该步骤重复5次;每孔加入100 μL的辣根过氧化物酶标记的检测抗体(除空白孔),用封板膜封住反应孔,37℃孵育30 min,弃去液体,在吸水纸上拍干;每孔加入350 μL的洗涤液,室温静置1 min,弃去液体,在吸水纸上拍干,该步骤重复5次;每孔加入各50 μL A和B底物,用锡箔纸包裹以避光,37℃孵育15 min;每孔加入50 μL的终止液,在15 min内用酶标仪A450测定OD值。
1.9 数据的统计分析
每个试验3—4个生物学重复,数据均用平均值±标准差表示,并经双尾T-test检验差异是否具有统计学意义。**代表<0.01,*代表<0.05。
2 结果
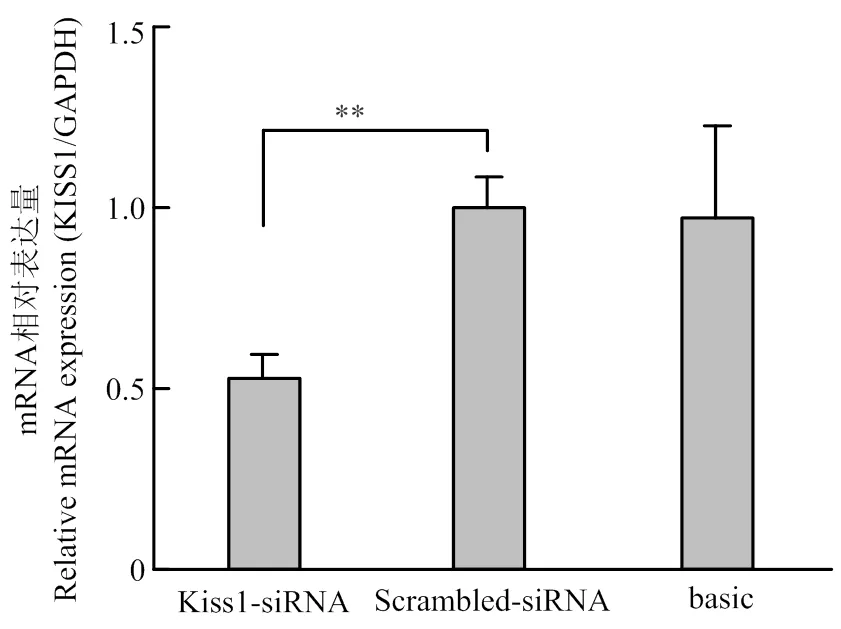
2.1 干扰猪KISS1的效果
转染Scrambled-siRNA和KISS1-siRNA(序列:CAACAAGAAGTGGGAGCAGAA)至颗粒细胞后的qRT-PCR结果如图1,KISS1-siRNA组的的表达水平显著低于Scrambled-siRNA对照组(<0.01),结果表明干扰片段KISS1-siRNA具有良好的干扰效果,可以用于后续试验。
* P<0.05,** P<0.01。下同 The same as below
2.2 干扰KISS1抑制PI3K信号通路
干扰后,激活PI3K信号通路的转录水平显著降低(<0.05),转录水平降低,但差异不显著(图2-A);抑制PI3K通路的和转录水平显著降低(<0.05),的mRNA表达水平降低,但差异不显著(图2-B)。结果表明,干扰能够抑制PI3K信号通路部分标志基因的表达。
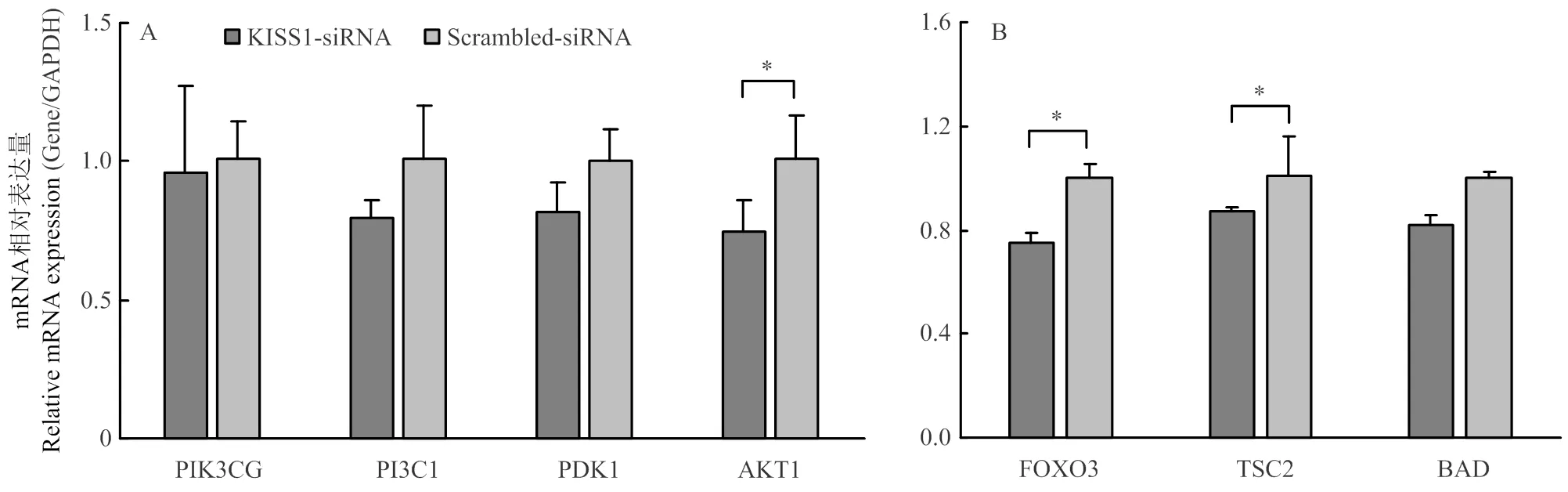
A. PI3K信号通路激活相关基因的表达;B. PI3K信号通路抑制相关基因的表达
2.3 干扰KISS1的表达促进颗粒细胞的凋亡
颗粒细胞Annexin FITC/PI检测结果如图3,其中Q1区域为机械损伤细胞,Q2(FITC+/PI+)区域为晚期凋亡或坏死细胞,Q3(FITC+/PI-)区域为早期凋亡细胞,Q4(FITC-/PI-)区域为活细胞(图3-A和B)。KISS1-siRNA组颗粒细胞的凋亡率显著高于Scrambled- siRNA对照组(<0.01)(图3-C),结果表明,干扰促进颗粒细胞凋亡。
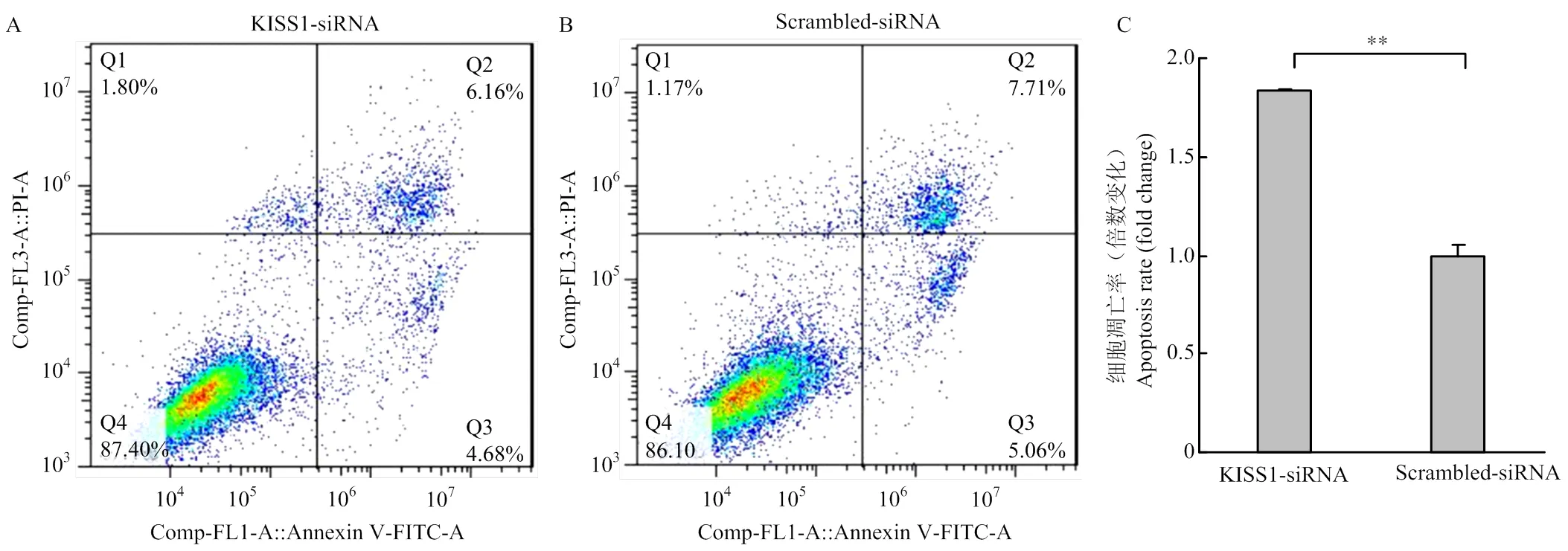
A.转染KISS1-siRNA的流式检测结果;B.转染Scrambled-siRNA的流式检测结果;C.干扰KISS1促进颗粒细胞凋亡
2.4 干扰KISS1的表达影响颗粒细胞的细胞周期
为探究对颗粒细胞周期的影响,流式检测结果如图4,单因素方差分析证实KISS1-siRNA组处于G1/G0期的颗粒细胞比例显著高于Scrambled- siRNA对照组的颗粒细胞(<0.01),即干扰后,颗粒细胞阻滞在分裂间期。
2.5 干扰KISS1的表达抑制颗粒细胞分泌E2
颗粒细胞的主要功能之一是分泌E2,为研究对颗粒细胞分泌E2能力的影响,ELISA法检测结果如图5,KISS1-siRNA组细胞上清中E2的浓度显著低于Scrambled-siRNA对照组(<0.01),即干扰的表达,可以抑制颗粒细胞分泌E2。
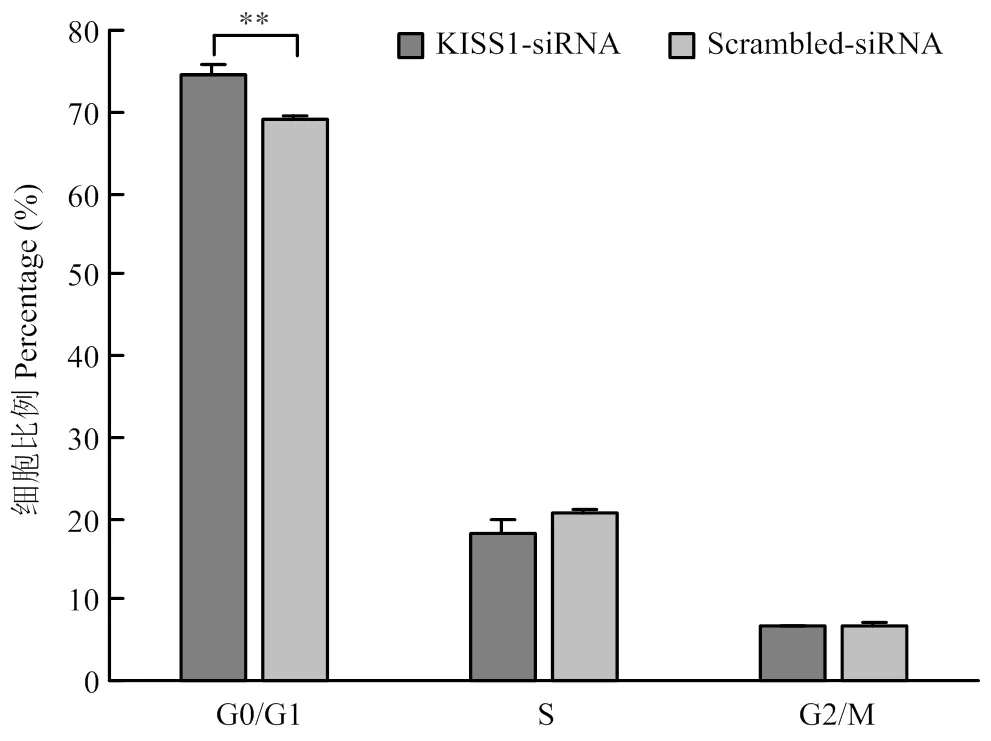
图4 干扰KISS1能够将颗粒细胞阻滞在分裂间期
2.6 干扰KISS1的表达能影响雌激素信号通路相关基因的表达
干扰能够影响颗粒细胞的凋亡和周期,并影响颗粒细胞分泌E2的能力,为进一步探究能否影响雌激素合成相关基因及雌激素受体的转录水平,qRT-PCR结果证实,干扰,雌激素受体的转录水平显著低于Scrambled-siRNA组(<0.05),的转录水平低于Scrambled-siRNA组,差异不显著(图6-A),说明干扰能够抑制和表达。此外,qRT-PCR结果证实,干扰后,雌激素合成通路基因(<0.05)、(<0.01)、(<0.05)和(<0.05)转录水平显著低于Scrambled-siRNA组,的转录水平低于Scrambled-siRNA组(图6-B),说明干扰能够影响雌激素合成通路基因转录水平。
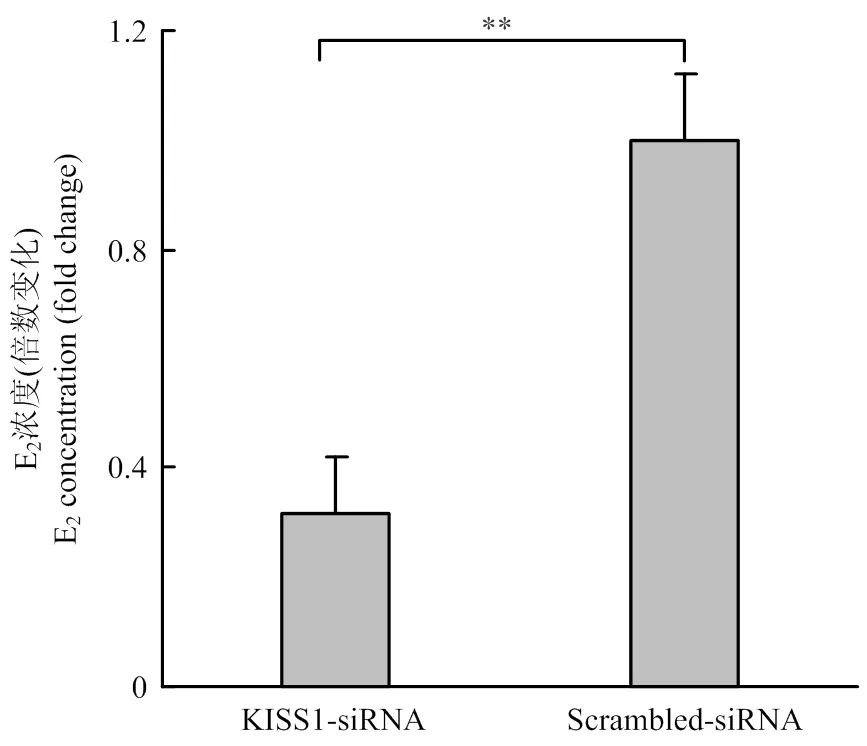
图5 干扰KISS1抑制颗粒细胞分泌E2
3 讨论
3.1 KISS1与PI3K信号通路的联系
猪的位于9号染色体[19],包含2个外显子,CDS区长度约为417 bp,编码138个氨基酸[20],广泛分布于人和动物的各个组织中,在人的胎盘中表达量最高[6, 21],在大鼠的下丘脑中表达量最高[22],在猪的下丘脑、垂体、卵巢等组织中都有不同水平的表达[20]。早期有关的研究主要集中在癌细胞的转移抑制[23],之后的研究更多集中在对哺乳动物中枢调节和神经内分泌的作用[24],近期已有研究证实,在哺乳动物的卵巢中表达,但关于在猪卵巢中表达调控机制的研究较少。此外,PI3K/AKT信号通路是调控原始卵泡激活和发育的经典信号通路,于是本研究首先探究了干扰对PI3K信号通路中部分基因转录水平的影响。又因为卵泡是卵巢的组成单位,圆形泡状卵泡位于卵巢皮质部,主要由卵母细胞、颗粒细胞和膜细胞组成,根据卵母细胞及颗粒细胞不同时期的生长状况,可将卵泡分为原始卵泡、初级卵泡、次级卵泡、三级卵泡及成熟卵泡。原始卵泡的卵母细胞仅包裹着单层扁平状的颗粒细胞,随着卵泡的发育,包裹卵母细胞的颗粒细胞逐渐增至数层,形态也由扁平状变为柱状,并在卵泡排卵前逐渐分化为包裹卵母细胞的卵丘颗粒细胞和紧贴卵泡内壁的壁层颗粒细胞[25-27]。颗粒细胞的发育优先于卵母细胞的发育[28],因而颗粒细胞的生长分化是原始卵泡生长和启动的关键因素,而颗粒细胞的凋亡是卵泡闭锁的主要标志,于是本研究将母猪卵巢颗粒细胞作为探究卵泡体外发育的细胞模型。干扰后,发现能够激活PI3K信号通路的转录水平显著降低(<0.05),抑制PI3K信号通路激活的转录水平也显著降低(<0.05),该结果初步说明干扰可能微调PI3K信号通路的基因转录水平,并影响PI3K信号通路活性。
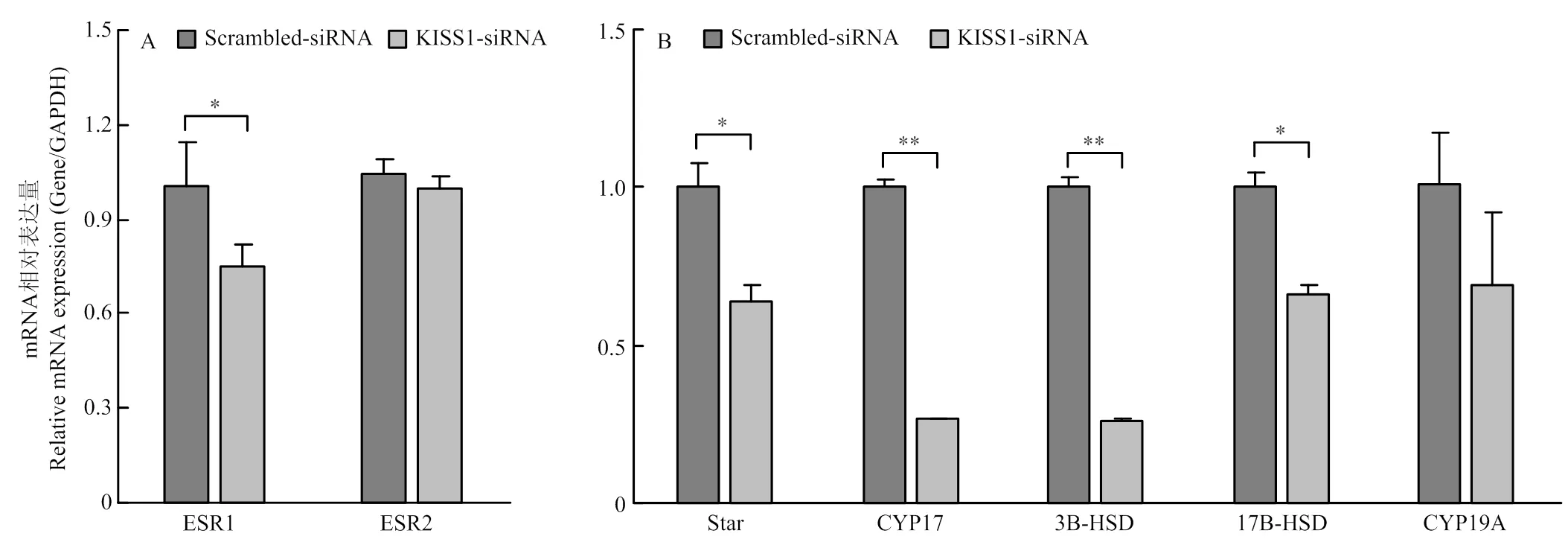
A. 干扰KISS1抑制ESR1和ESR2表达;B. 干扰KISS1抑制雌激素通路基因的表达
3.2 KISS1与颗粒细胞功能的联系
基于干扰能够影响PI3K/AKT信号通路标志基因的表达量,于是进一步检测干扰对颗粒细胞功能的影响。前期研究发现,过表达能够促进颗粒细胞增殖,抑制颗粒细胞凋亡[18];本研究发现,干扰,凋亡的颗粒细胞比例显著增加,这部分结果与前期研究结果相呼应,证明的转录水平能够影响颗粒细胞的增殖和凋亡,于是进一步研究干扰对颗粒细胞周期的影响。已知细胞周期分为G0/G1、S和G2/M期,其中G0/G1期为细胞处于阻留的状态,细胞在未受刺激时会暂时停止分裂,但DNA合成与细胞分裂的潜力仍然存在,在一定适宜刺激下,又可进入周期进行分裂增殖[29],G0/G1期阻滞是机体调节细胞周期的重要手段[30]。S期为DNA合成时期,DNA数目在此时期加倍,一般情况下细胞一旦进入S期,细胞分裂就会继续进行下去,直到下一周期[31]。本研究发现干扰,阻滞在G0/G1期的颗粒细胞显著高于对照组(<0.01),而处于S期的颗粒细胞则低于对照组,但差异不显著,细胞周期结合细胞凋亡的结果,也说明干扰能够显著影响颗粒细胞的功能。
3.3 KISS1与颗粒细胞E2分泌的联系
信号传导是下丘脑回路的一部分,该信号能够促性腺激素释放,进而促进卵巢中E2释放[32]、性器官发育[33]等,于是本研究拟通过干扰,探究与颗粒细胞E2分泌的联系,结果表明体外干扰颗粒细胞中的,培养基上清中E2的浓度显著降低(<0.01),该部分结果与前人研究结果一致。
同时已有研究表明,雌激素受体和在动物机体内具有重要的生理作用[34-35],E2与受体和结合才能发挥作用[36],且在卵巢发育的过程中,随着颗粒细胞的生长,的表达水平也随之增加[37-38]。当雌激素受体与其配体结合时,可协同PI3K通路,激活原始卵泡,促进卵泡成熟[39],但当小鼠体内的雌激素受体缺失时,小鼠血清中FSH、LH、E2等含量显著高于正常小鼠,小鼠排卵功能发生障碍[40]。综上所述,和基因的转录水平,能够反映颗粒细胞分泌E2的能力。此外,雌激素受体的表达除了可以调节相关激素的分泌,还能够升高雌激素合成相关基因和的转录水平,促进排卵[41]。于是本研究将Scrambled-siRNA和KISS1-siRNA转染至颗粒细胞,抽取细胞RNA,并使用qRT-PCR分析颗粒细胞中雌激素受体及E2信号通路关键基因的转录水平。结果证实,干扰,E2受体表达量显著下调,E2信号通路关键基因、、和也显著下调,该结果与ELISA结果一致,从分子水平佐证了干扰能够抑制颗粒细胞E2分泌。
4 结论
干扰能够抑制猪卵巢颗粒细胞中PI3K信号通路的激活,同时能够促进颗粒细胞的凋亡,将颗粒细胞阻滞于分裂间期。干扰能够抑制颗粒细胞中雌激素受体和及雌激素合成信号通路基因、、和的转录水平,抑制E2的分泌。
[1] VANDERHYDEN B C, ARMSTRONG D T. Role of cumulus cells and serum on thematuration, fertilization, and subsequent development of rat oocytes., 1989, 40(4): 720-728.
[2] MAALOUF S W, LIU W S, PATE J L. MicroRNA in ovarian function., 2016, 363(1). DOI: 10. 1007/s00441-015- 2307-4.
[3] EPPIG J J. Oocyte control of ovarian follicular development and function in mammals., 2001, 122(6): 829-838.
[4] UDA M, OTTOLENGHI C, CRISPONI L.disruption causes mouse ovarian failure by pervasive blockage of follicle development., 2004, 13(11): 1171-1181.
[5] WEST A, VOJTA P J, WELCH D R. Chromosome localization and genomic structure of themetastasis suppressor gene ()., 1998, 54(1): 145-148.
[6] LEE J H, MIELE M E, HICKS D J., a novel human malignant melanoma metastasis-suppressor gene.1996, 88(23): 1731-1737.
[7] HU K L, ZHAO H, CHANG H M. Kisspeptin/Kisspeptin receptor system in the ovary., 2017, 8: 365.
[8] GAYTAN F, GAYTAN M, CASTELLANO J M.in the mammalian ovary: distribution of kisspeptin in human and marmoset and alterations inmRNA levels in a rat model of ovulatory dysfunction., 2009, 296(3): E520-531.
[9] 郭美君. 高泌乳素血症通过/系统影响小鼠卵泡发育及排卵[D]. 南昌: 南昌大学, 2016.
GUO M J. Hyperprolactinemia affects the follicles development and ovulation by Kiss1/GPR54 system in mice[D]. Nanchang: Nanchang University. 2016. (in Chinese)
[10] 赖丽丹. 高泌乳素血症通过/系统对大鼠卵巢黄体细胞内分泌功能的影响及其机制[D]. 南昌: 南昌大学, 2016.
LAI L D. The effect and mechanism of hyperprolactinemia on endocrine function of rat luteal cell by Kiss1/GPR54 system[D]. Nanchang: Nanchang University, 2016. (in Chinese)
[11] 王笑, 王甄真, 陈雁. PI3K/AKT信号通路在维持血糖平衡中的作用. 生命科学, 2013, 25(2): 133-139.
WANG X, WANG Z Z, CHEN Y. The functions of PI3K/AKT signaling pathway in glucose homeostasis.2013, 25(2): 133-139. (in Chinese)
[12] CANTLEY L C. The phosphoinositide 3-kinase pathway., 2002, 296(5573): 1655-1657.
[13] ENGELMAN J A, LUO J, CANTLEY L C. The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism., 2006, 7(8): 606-619.
[14] JAGARLAMUDI K, LIU L, ADHIKARI D. Oocyte-specific deletion of Pten in mice reveals a stage-specific function of PTEN/PI3K signaling in oocytes in controlling follicular activation., 2009, 4(7): e6186.
[15] REDDY P, LIU L, ADHIKARI D. Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool., 2008, 319(5863): 611-613.
[16] FAN H Y, LIU Z, CAHILL N. Targeted disruption of Pten in ovarian granulosa cells enhances ovulation and extends the life span of luteal cells., 2008, 22(9): 2128-2140.
[17] 蔡竞. 基于PI3K/AKT信号通路研究新加归肾丸促卵泡发育的分子机制[D]. 成都: 成都中医药大学. 2013.
CAI J. Based on PI3K/AKT signaling pathway to study the molecular mechanism of Xinjiaguishen pill promoting follicular development[D]. Chengdu: Chengdu University of TCM. 2013. (in Chinese)
[18] XIN X, LI Z, ZHONG Y. KISS1 Suppresses apoptosis and stimulates the synthesis of E2 in porcine ovarian granulosa cells., 2019, 9(2). DOI: 10. 3390/ani9020054.
[19] TOMIKAWA J, HOMMA T, TAJIMA S. Molecular characterization and estrogen regulation of hypothalamicgene in the pig., 2010, 82(2): 313-319.
[20] 臧猛, 晁利刚, 张志强, 台玉磊, 王静, 武宇晓, 杨国宇. 猪基因克隆、序列分析. 江西农业学报, 2008, 20(11): 5-7.
ZANG M, CHAO L G, ZHANG Z Q, TAI Y L, WANG J, WU Y X, YANG G Y. Molecular cloning and sequence analysis of porcine gene KISS-1., 2008, 20(11): 5-7. (in Chinese)
[21] OHTAKI T, SHINTANI Y, HONDA S. Metastasis suppressor geneencodes peptide ligand of a G-protein-coupled receptor., 2001, 411(6837): 613-617.
[22] IRWIG M S, FRALEY G S, SMITH J T. Kisspeptin activation of gonadotropin releasing hormone neurons and regulation ofmRNA in the male rat., 2004, 80(4): 264-272.
[23] FUNES S, HEDRICK J A, VASSILEVA G. Thereceptor GPR54 is essential for the development of the murine reproductive system., 2003, 312(4): 1357-1363.
[24] PAPAOICONOMOU E, MSAOUEL P, MAKRI A. The role of kisspeptin/GPR54 in the reproductive system., 2011, 25(3): 343-354.
[25] HUNTER M G. Oocyte maturation and ovum quality in pigs., 2000, 5(2): 122-130.
[26] MCGEE E A, HSUEH A J. Initial and cyclic recruitment of ovarian follicles., 2000, 21(2): 200-214.
[27] SIMPSON E R, CLYNE C, RUBIN G. Aromatase-A brief overview., 2002, 64: 93-127.
[28] 魏泽辉, 贾存灵. 家禽卵泡选择过程中颗粒细胞的分子调控机制. 中国家禽, 2017, 39(21): 1-5.
WEI Z H, JIA C L. The molecular regulation mechanism of granulosa cells in the process of poultry follicle selection., 2017, 39(21): 1-5. (in Chinese)
[29] MISHIMA T, TODA S, ANDO Y. Rapid proliferation of activated lymph node CD4(+) T cells is achieved by greatly curtailing the duration of gap phases in cell cycle progression., 2014, 19(4): 638-648.
[30] CHEN H, XU X, WANG G. CDK4 protein is degraded by anaphase-promoting complex/cyclosome in mitosis and reaccumulates in early G1 phase to initiate a new cell cycle in HeLa cells., 2017, 292(24): 10131-10141.
[31] CROSSEN P E, PATHAK S, ARRIGHI F E. A high resolution study of the DNA replication patterns of Chinese hamster chromosomes using sister chromatid differential staining technique., 1975, 52(4): 339-347.
[32] GOTTSCH M L, CUNNINGHAM M J, SMITH J T. A role for kisspeptins in the regulation of gonadotropin secretion in the mouse., 2004, 145(9): 4073-4077.
[33] FINDLAY J K, BRITT K, KERR J B. The road to ovulation: The role of oestrogens., 2001, 13(7/8): 543-547.
[34] TORAN-ALLERAND C D. Minireview: A plethora of estrogen receptors in the brain: Where will it end?, 2004, 145(3): 1069-1074.
[35] BAKER L, MELDRUM K K, WANG M. The role of estrogen in cardiovascular disease., 2003, 115(2): 325-344.
[36] 杜彦博. 雌激素及其相关炎症因子对卵泡发育的影响[D]. 上海: 复旦大学, 2012.
DU Y B. The effects of estrogen and related inflammatory factors on the development of follicle[D]. Shanghai: Fudan University, 2012. (in Chinese).
[37] 屈超, 刘中洋, 袭荣刚, 王晓波. 雌激素信号通路概述. 生物技术通讯, 2014, 25(3): 448-450.
QU C, LIU Z Y, XI R G, WANG X B. Estrogen signaling review., 2014, 25(3): 448-450. (in Chinese)
[38] 岳占碰, 张学明, 马琳. 雌激素对哺乳动物卵泡发育的影响研究进展. 中国畜牧杂志, 2007(1): 41-43.
YUE Z P, ZHANG X M, MA L. The production of estrogens in mammalian follicle and its effect on follicular development., 2007(1): 41-43. (in Chinese)
[39] 罗峰, 谢琪璇, 秋山泰身, 秦俊文. 调节卵子发育成熟的信号转导通路. 生殖与避孕, 2011, 31(7): 495-501.
LUO F, XIE Q X, QIUSHAN T S, QIN J W. Signal transduction pathways that regulate egg development and maturation., 2011, 31(7): 495-501. (in Chinese)
[40] 詹晓庆, 王鲜忠, 张家骅. 雌激素受体和雌性生殖研究进展. 动物医学进展, 2005(12): 35-39.
ZHAN X Q, WANG X Z, ZHANG J H. Progress on estrogen receptor and female reproduction., 2005(12): 35-39. (in Chinese)
[41] 艾芳, 丘彦. 雌激素受体亚型与多囊卵巢综合征. 国际生殖健康/计划生育杂志, 2009, 28(3): 190-193.
AI F, QIU Y. Estrogen receptor subtypes and polycystic ovarian syndrome., 2009, 28(3): 190-193. (in Chinese)
Effect ofInterference on the Function of Porcine Granulosa Cells in Porcine Ovary
Lu SiYu1, HE YingTing1, Zhou XiaoFeng1, Xin XiaoPing1, Zhang AiLing2, Yuan XiaoLong1, ZHANG Zhe1, Li JiaQi1
(1Guangdong Provincial Key Laboratory of Agro-animal Genomics and Molecular Breeding/National Engineering Research Center for Breeding Swine Industry/College of Animal Science, South China Agricultural University, Guangzhou 510642;2Guangdong Development Center of Applied Ecology and Ecological Engineering in Universities/Biology and Food Engineering Institute,Guangdong University of Education,Guangzhou 510310)
【】As the basic structural and functional unit of ovary, the main functions of follicles are ovulation and hormone secretion. Granulosa cells proliferation can promote the development of follicles, while the excessive apoptosis of granulosa cells will inhibit the development of follicles, induce follicular atresia, reduce the estrus frequency and affect the reproductive capacity of female animals. Recent studies have found that theplays an important role in ovary. 【】This study was aimed to explore the effects ofon apoptosis, cell cycle and estrogen secretion of porcine granulosa cells, through interfering the expression of, so as to provide some useful information in molecular regulation mechanism ofon porcine granulosa cells. 【】To investigate the effect of knockdownon the transcription of key genes on phosphatidylinositol 3-kinase (PI3K) signaling pathway in porcine granulosa cells, KISS1-siRNA were designed and transfected to porcine granulosa cells, and then quantitative real time PCR (qRT PCR) was applied to detect the transcription ofThen, flow cytometry, Annexin V-FITC, and ELISA were utilized to explore the effects of KISS1-siRNA on granulosa cell cycle, apoptosis, and secretion of E2, respectively. Finally, qRT-PCR was applied to explore the effects of KISS1-siRNA on estrogen receptor and estrogen signaling pathway. 【】 In porcine granulosa cells, interferinggene could significantly decrease the transcription of(<0.05), while,anddecreased with no significant difference (>0.05). The mRNA levels of the genes, involving in activation of PI3K signaling pathway like,andwere also decreased with no significant difference (>0.05). Transfecting KISS1-siRNA to porcine granulosa cells could significantly promote cell apoptosis (<0.01), arrest cell cycle at G0/G1 phase (<0.01), and decrease the E2secretion (<0.01). After knockdown, the transcription of estrogen receptorand, as well as,,,andof estrogen pathway were also decreased significantly (<0.05). 【】 This study confirmed thatgene could participate in PI3K and estrogen signaling pathways. Interferingcould promote porcine granulosa cells apoptosis, arrest cell cycle at G0/G1 phase (<0.01), and decrease the E2secretion. It suggested thatplayed an important role in the division, growth and estrogen secretion of porcine granulosa cells.
sows; granulosa cells;; PI3K; E2

10.3864/j.issn.0578-1752.2020.23.018
2019-11-28;
2020-10-29
国家生猪现代农业产业技术体系(CARS-35)、国家自然科学基金青年项目(31902131)、广东省自然科学基金面上项目(2019A1515010676)、广东省扬帆计划(2014YT02H042)、广东省普通高校青年创新人才项目(2018KQNCX019)、广州市科技计划项目(201707010001)
陆思羽,E-mail:siyu_lu19@163.com。通信作者李加琪,E-mail:jqli@scau.edu.cn
(责任编辑 林鉴非)

