十倍体长穗偃麦草雄性育性基因ThMs1的克隆、表达及功能分析
衡燕芳,李健,王峥,陈卓,何航,邓兴旺,马力耕
十倍体长穗偃麦草雄性育性基因的克隆、表达及功能分析
衡燕芳1,李健2,王峥2,陈卓1,何航2,邓兴旺2,马力耕1
(1首都师范大学生命科学学院,北京 100048;2北京大学现代农业研究院,山东潍坊 261325)
【】从小麦隐性核雄性不育突变体与十倍体长穗偃麦草异附加系中,克隆雄性育性恢复基因,解析该基因的表达模式、编码蛋白的生物化学活性和生物学功能,鉴定新的小麦育性恢复基因,从而更好地应用于小麦杂交育种。通过基因组原位杂交(genomichybridization,GISH),鉴定与十倍体长穗偃麦草异附加系中小麦外源的染色体类型;通过同源克隆法在小麦-十倍体长穗偃麦草异附加系中克隆雄性育性基因,并稳定转化小麦进行基因功能互补验证;利用RT-PCR及实时荧光定量PCR分析检测基因的表达模式;进一步通过RNA原位杂交分析基因的组织细胞特异性表达特性;利用特异性抗体进行Western blot检测ThMs1蛋白在体内的表达情况;经SignalP软件分析预测蛋白结构;通过蛋白-脂质结合活性分析检测ThMs1蛋白是否具有脂类分子结合活性。证实小麦与十倍体长穗偃麦草异附加系细胞中含有偃麦草4Ag染色体;从小麦-十倍体长穗偃麦草异附加系中克隆了雄性育性基因,遗传转化功能互补试验证实能够完全恢复小麦突变体的雄性不育表型,基因的聚类分析表明只存在于禾本科植物中;通过RT-PCR和实时荧光定量PCR检测发现在减数分裂期的花药中特异表达,RNA原位杂交分析证实在小麦小孢子发生过程中特异表达;Western blot检测发现ThMs1在小麦减数分裂期的花药中表达;对ThMs1蛋白氨基酸序列进行结构预测发现,该蛋白具有推测的脂类结合分子结构域,ThMs1蛋白脂类分子结合试验表明ThMs1蛋白特异结合磷脂酸和磷酸化的磷脂酰肌醇。克隆了一个新的来自十倍体长穗偃麦草、可恢复小麦隐性核雄性不育突变体雄性育性的,该基因与小麦具有相似的分子结构、时空表达模式和脂结合活性,导致2个蛋白在小麦中也具有相似的生物学功能,可以替代普通小麦的功能调控小麦花粉育性,该结果为利用小麦通过分子设计建立小麦杂交育种体系(新一代杂交育种体系)提供了一个新的育性恢复基因。
普通小麦;小麦-十倍体长穗偃麦草异附加系;隐性核雄性不育;;;小麦杂交育种体系;分子设计育种
0 引言
【研究意义】小麦是全球范围内广泛种植的农作物,世界上约30%的人口以小麦为主食。随着全球人口的不断增加和耕地面积的不断减少,为了确保未来的全球粮食安全,急需将新一代杂交育种技术(分子设计杂交育种技术)引入小麦育种,利用杂种优势培育产量高、品质优、抗性好的新品种来满足全球人口对粮食的需求[1-5]。小麦是典型的自花授粉作物,实现新一代杂交育种的关键是筛选雄性不育突变体并克隆相关育性调控基因。十倍体长穗偃麦草具有抗病、抗寒、抗旱、耐贫瘠、长穗多花等多种优异性状[6-8],是小麦遗传改良中重要的野生近缘种质资源之一,克隆和利用偃麦草中的雄性育性调控基因,可以为远缘杂交育种提供基因资源及理论支撑。【前人研究进展】小麦雄性不育突变体筛选工作始于60年前,目前,人们在普通小麦中发现至少5个核基因突变导致的雄性不育突变体,它们被命名为—[9-10],其中,和是隐性突变体,、和是显性突变体。在水稻中的研究结果表明,克隆导致小麦雄性不育的基因是了解小麦雄性育性调控机制和建立新一代杂交育种体系的关键[4-5]。中国2个团队分别克隆和鉴定了小麦[11-12],发现普通小麦中是不表达的,在突变体中,由于启动子区插入一个转座子,导致在花药中表达,最终引起花粉母细胞和绒毡层降解导致雄性不育。国内马力耕和邓兴旺课题组与国外研究人员同时报道了小麦的克隆,发现特异存在于禾本科植物中,在小孢子母细胞特异表达,该基因突变导致雄配子发生障碍[13-14]。最近,也被克隆[15],其在小麦中有2个等位基因同时不同程度地发挥功能。小麦隐性雄性不育突变体基因的克隆和分子鉴定对了解小麦雄性育性调控机制极为关键,同时这些突变体以及育性基因也为分子设计杂交育种提供了宝贵的小麦基因资源和受体材料。【本研究切入点】小麦核雄性不育突变体稳定的不育特性及其隐性特征使得适合用于小麦分子设计杂交育种实践中,发掘雄性不育突变体的育性恢复基因是实现杂交育种的另一个关键因素。筛选鉴定除以外的新的育性恢复基因会为分子设计育种提供更多的选择。李振声先生等培育的“蓝粒小麦”携带了4Ag染色体,其着丝点及近着丝点区来自于十倍体长穗偃麦草的E基因组(EeEbEx),而染色体两臂的端部区域来自于St基因组,是一条重组染色体[16]。笔者此前以小麦雄性不育突变体为母本,以“蓝粒小麦”为父本,从杂交后代中筛选出雄性育性得以恢复的异附加系材料,表明该重组染色体上含有恢复育性的基因。本文以此异附加系为材料,通过同源克隆的方法获得来自十倍体长穗偃麦草、可恢复小麦隐性核雄性不育突变体雄性育性的,该工作的结果既可用于小麦杂交育种,又为利用远缘杂交技术发掘近缘种中的有利遗传资源提供了一种模式[17-20]。【拟解决的关键问题】本研究以小麦隐性核雄性不育突变体与十倍体长穗偃麦草异附加系为材料,克隆调控小麦雄性育性的,并进行转基因功能互补验证,进一步的基因表达分析及蛋白功能研究解析ThMs1和Ms1的关系,为该基因在小麦分子设计杂交育种中的应用奠定基础。
1 材料与方法
1.1 材料
普通小麦(L.,2n=6x=42,AABBDD)、雄性不育突变体小麦(L.,2n=6x=42,AABBDD)、小麦-十倍体长穗偃麦草异附加系、十倍体长穗偃麦草(,2n=10x=70,StStEeEbEx)。小麦-十倍体长穗偃麦草异附加系是以小麦隐性核雄性不育突变体为母本、以李振声先生等培育的“蓝粒小麦”为父本[7,16],在其杂交后代中选育出的稳定雄性可育株系。十倍体长穗偃麦草由中国农业科学院作物科学研究所张学勇研究员提供。
1.2 基因组原位杂交
基因组原位杂交流程参考Zhao等[20]方法。使用Dig Translation Mix(Roche)试剂盒标记十倍体长穗偃麦草基因组DNA探针。基因组原位杂交中探针与封阻DNA的比例为1﹕300,利用anti-digoxigenin- rhodamine(Roche)试剂盒检测杂交信号。杂交后染色体用含DAPI的抗荧光淬灭封片剂(Vector Laboratories)进行复染。用荧光显微镜(Zeiss Axio Imager M2)拍照保存。
1.3 基因克隆、RT-PCR和实时荧光定量PCR
使用TRI试剂(Takara Bio Inc.)提取材料减数分裂期花药的RNA,并用DNaseⅠ(Promega)去除基因组DNA污染。通过First-Strand cDNA Synthesis Kit(Thermo Fisher)合成cDNA。以cDNA为模板,基于小麦及其他物种已知序列设计引物(电子附表1)从小麦-十倍体长穗偃麦草中扩增。利用LA Taq(Takara Bio Inc.)进行RT-PCR,并通过2%琼脂糖凝胶电泳检测扩增产物。Primer 5.0软件设计靶向基因的特异性引物,利用SYBR Premix Ex(Takara Bio Inc.),经实时荧光定量PCR检测表达特征。用于表达分析的引物见电子附表1。
附表1 本研究所用引物
Table S1 The primers used in this study
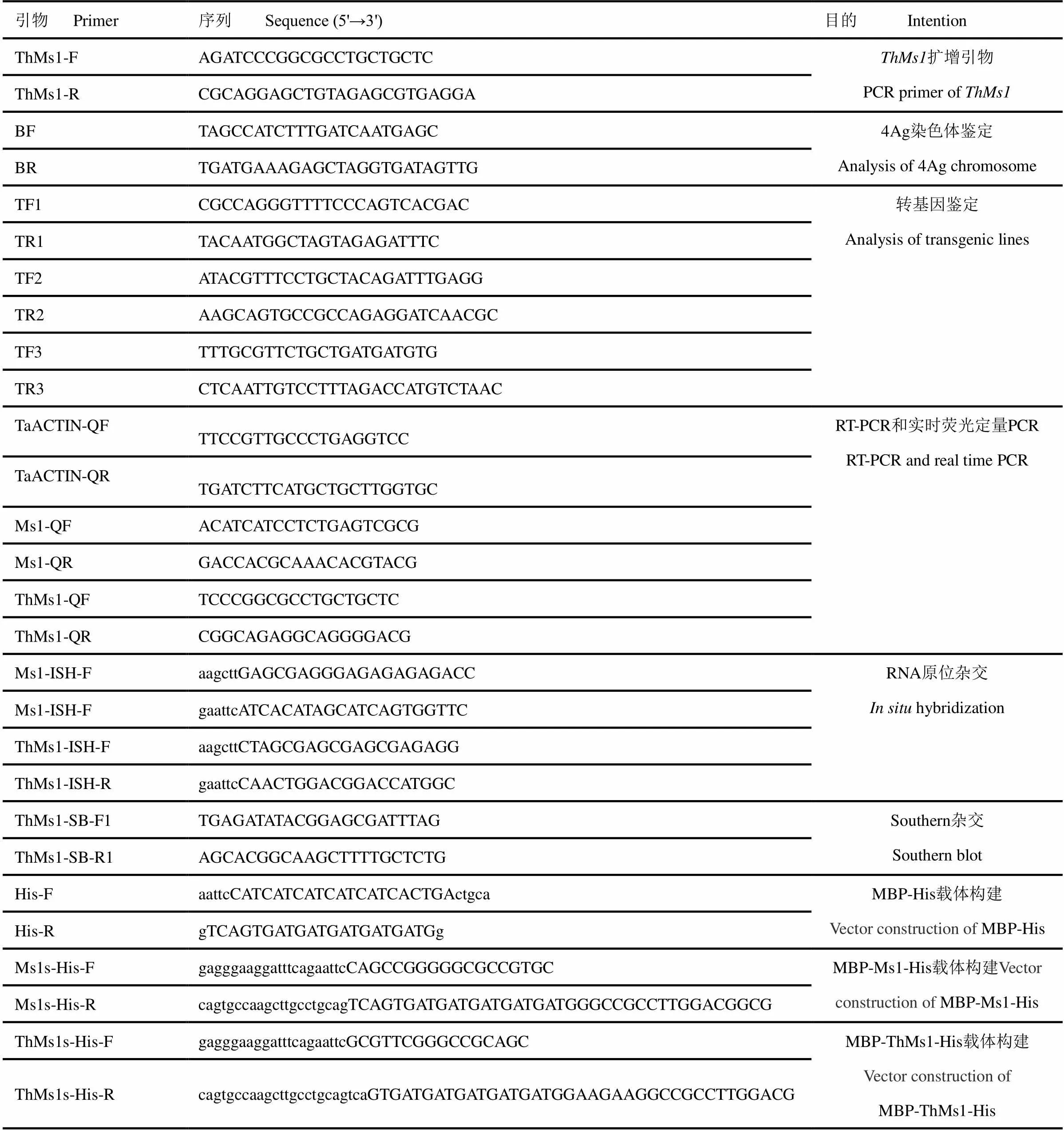
引物 Primer序列 Sequence (5'→3')目的 Intention ThMs1-FAGATCCCGGCGCCTGCTGCTCThMs1扩增引物PCR primer of ThMs1 ThMs1-RCGCAGGAGCTGTAGAGCGTGAGGA BFTAGCCATCTTTGATCAATGAGC4Ag染色体鉴定analysis of 4Ag chromosome BRTGATGAAAGAGCTAGGTGATAGTTG TF1CGCCAGGGTTTTCCCAGTCACGAC转基因鉴定analysis of transgenic lines TR1TACAATGGCTAGTAGAGATTTC TF2ATACGTTTCCTGCTACAGATTTGAGG TR2AAGCAGTGCCGCCAGAGGATCAACGC TF3TTTGCGTTCTGCTGATGATGTG TR3CTCAATTGTCCTTTAGACCATGTCTAAC TaACTIN-QFTTCCGTTGCCCTGAGGTCCRT-PCR和实时荧光定量PCRRT-PCR and real time PCR TaACTIN-QRTGATCTTCATGCTGCTTGGTGC Ms1-QFACATCATCCTCTGAGTCGCG Ms1-QRGACCACGCAAACACGTACG ThMs1-QFTCCCGGCGCCTGCTGCTC ThMs1-QRCGGCAGAGGCAGGGGACG Ms1-ISH-FaagcttGAGCGAGGGAGAGAGAGACCRNA原位杂交in situ hybridization Ms1-ISH-FgaattcATCACATAGCATCAGTGGTTC ThMs1-ISH-FaagcttCTAGCGAGCGAGCGAGAGG ThMs1-ISH-RgaattcCAACTGGACGGACCATGGC ThMs1-SB-F1TGAGATATACGGAGCGATTTAGSouthern杂交Southern blot ThMs1-SB-R1AGCACGGCAAGCTTTTGCTCTG His-FaattcCATCATCATCATCATCACTGActgcaMBP-His载体构建Vector construction of MBP-His His-RgTCAGTGATGATGATGATGATGg Ms1s-His-FgagggaaggatttcagaattcCAGCCGGGGGCGCCGTGCMBP-Ms1-His载体构建Vector construction of MBP-Ms1-His Ms1s-His-RcagtgccaagcttgcctgcagTCAGTGATGATGATGATGATGGGCCGCCTTGGACGGCG ThMs1s-His-FgagggaaggatttcagaattcGCGTTCGGGCCGCAGCMBP-ThMs1-His载体构建Vector construction of MBP-ThMs1-His ThMs1s-His-RcagtgccaagcttgcctgcagtcaGTGATGATGATGATGATGGAAGAAGGCCGCCTTGGACG
1.4 RNA原位杂交
按照Shitsukawa等[21]方法进行RNA原位杂交。将组织在甲醛-乙酸溶液(3.7%甲醛)中于4℃固定8 h。使用引物ThMs1-ISH-F/R和Ms1-ISH-F/R(电子附表1)扩增探针,并将扩增产物分别以正向和反向插入pEASY-T1载体(TransGen Biotech)。通过dⅢ(反义探针)和RⅠ(有义探针)消化,使载体线性化,将其用作模板以生成具有T7 RNA聚合酶的探针。把材料切成8 μm厚的部分进行原位杂交,并在42℃杂交过夜。利用BCIP/NBT碱性磷酸酶显色试剂盒显色,镜检拍照保存。
1.5 Southern blot
使用改良的CTAB方法从幼叶中提取基因组DNA后,参照Zhao等[20]方法进行杂交。使用核酸分析仪(NanoDrop 2000,Thermo Scientific)对纯化的DNA进行定量。基因组DNA(每个样品40 µg)在37℃用dⅢ和RⅠ(New England Biolabs,USA)完全消化,然后在4℃和35 V下经0.8%琼脂糖凝胶电泳。将分离的DNA转移到Hybond-N+尼龙膜(GE Healthcare)并通过UV交联固定。电子附表1中列出了用于探针扩增的引物,并用探针标记试剂盒(Roche)标记探针。用的特异性探针进行杂交,同时提高杂交温度(66℃)并进行充分洗脱,从而提高杂交信号的特异性,然后使用试剂盒(GE Healthcare,RPN2106)进行检测分析。
1.6 转基因功能互补验证
将基因组DNA插入经dⅢ酶切的pAHC20载体中,构建用于功能互补试验的::载体(电子附图1-A),包括该基因ATG上游2 271 bp、基因组序列1 878 bp和TGA下游628 bp。通过基因枪法将载体转入-4Ag单体异附加系(纯合突变体附加一条长穗偃麦草4Ag染色体)植株的幼胚,4Ag染色体在后代中存在分离,所以需要对转基因植株进行4Ag染色体的鉴定,用于鉴定的引物BF/BR见电子附表1,不含有4Ag染色体的转基因植株即为纯合突变基因型背景。
在转基因后代鉴定中,同时用TF1/TR1、TF2/TR2和TF3/TR3 3对引物(电子附表1)进行PCR,3对引物均为PCR阳性,说明的启动子、基因编码区和终止子都已整合到基因组中,鉴定为转基因阳性植株(电子附图1-B),对检测出的具有纯合突变且不带有4Ag染色体的转基因阳性植株进行表型鉴定。
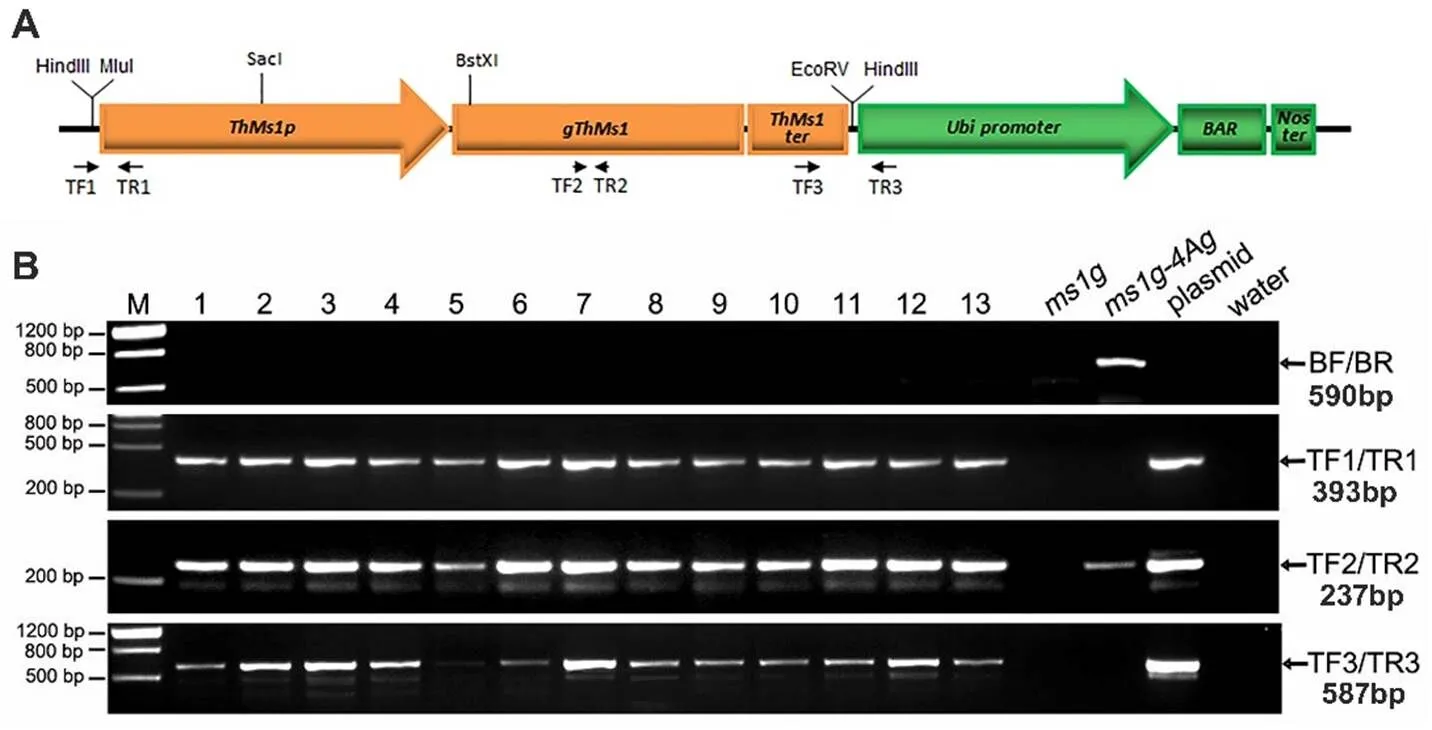
A:转基因载体;B:转基因株系的PCR鉴定
A: Transgenic vector of; B: Analysis of transgenic lines by PCR
附图1 转基因载体及转基因株系鉴定
Fig. S1 The structure of transgenic vector and analysis of transgenic lines
1.7 序列比对及系统进化树构建
用NCBI网站上提供的数据信息,获取不同物种中MS1同源性序列,或通过设计引物扩增同源序列。上述序列利用Clustal X 2.1进行多序列比对分析,然后利用MEGA 5.2.1软件通过Neighbour-joining(NJ)方法比对序列构建进化树。
1.8 脂质结合活性分析
利用SignalP软件进行蛋白结构预测[22],显示ThMs1蛋白具有8个半胱氨酸残基保守结构的脂结合结构域,将去掉信号肽和跨膜结构域的ThMs1、Ms1与6×His融合构建表达载体,进行原核表达融合蛋白,引物序列见电子附表1。融合蛋白在大肠杆菌BL21菌株中表达并纯化,PIP脂膜P-6001和P-6002购自Echelon Biosciences。参考Dowler等[23]方法进行蛋白-脂质结合活性检测。
2 结果
2.1 十倍体长穗偃麦草ThMs1的克隆
小麦隐性核雄性不育突变体和普通小麦相比,植株在株型、生育期等农艺性状上无明显差异,但在抽穗扬花期突变体穗部的颖壳呈张开状,而普通小麦的颖壳不张开完成自花授粉(图1-A)。进一步镜检发现,普通小麦的花药发育正常、花粉可育,而雄性不育突变体与普通小麦相比雌蕊发育正常,早期花药发育也无明显差异,但到花粉成熟时花药稍瘦小不开裂、花粉不育,后期不能正常受精结实(图1-A—图1-D)。通过基因组原位杂交(GISH)证实,在得到的附加系中,附加了十倍体长穗偃麦草4Ag染色体(图1-E),而且附加该染色体后使小麦雄性育性得到完全恢复(图1-A—图1-D)。
花药的组织切片观察显示,在小麦突变体中,花药不同发育时期的药室壁层结构与普通小麦相比无明显差异,绒毡层细胞的发生和降解过程与普通小麦相比也无明显差异,但突变体小孢子发育不正常(电子附图2)。在整个花药及花粉发育过程中,小麦-4Ag异附加系与普通小麦相比无显著差异(电子附图2),表明突变没有影响小麦孢子体组织的发育,但影响了小孢子的发育。对小孢子细胞核染色分析,发现突变体在小孢子发育的单核早期之前与普通小麦相比无明显异常,到单核晚期出现约28%的花粉皱缩现象,而且细胞核也呈凝聚状,到双核早期表型加剧,在突变体中处于双核晚期及三核期的花粉发育完全异常、花粉严重皱缩、细胞核降解,不能产生可育的三核成熟花粉(图1-F);小麦-4Ag异附加系中花药和花粉发育与普通小麦相比无明显差异(图1-F),表明长穗偃麦草的附加系中含有小麦育性恢复基因。
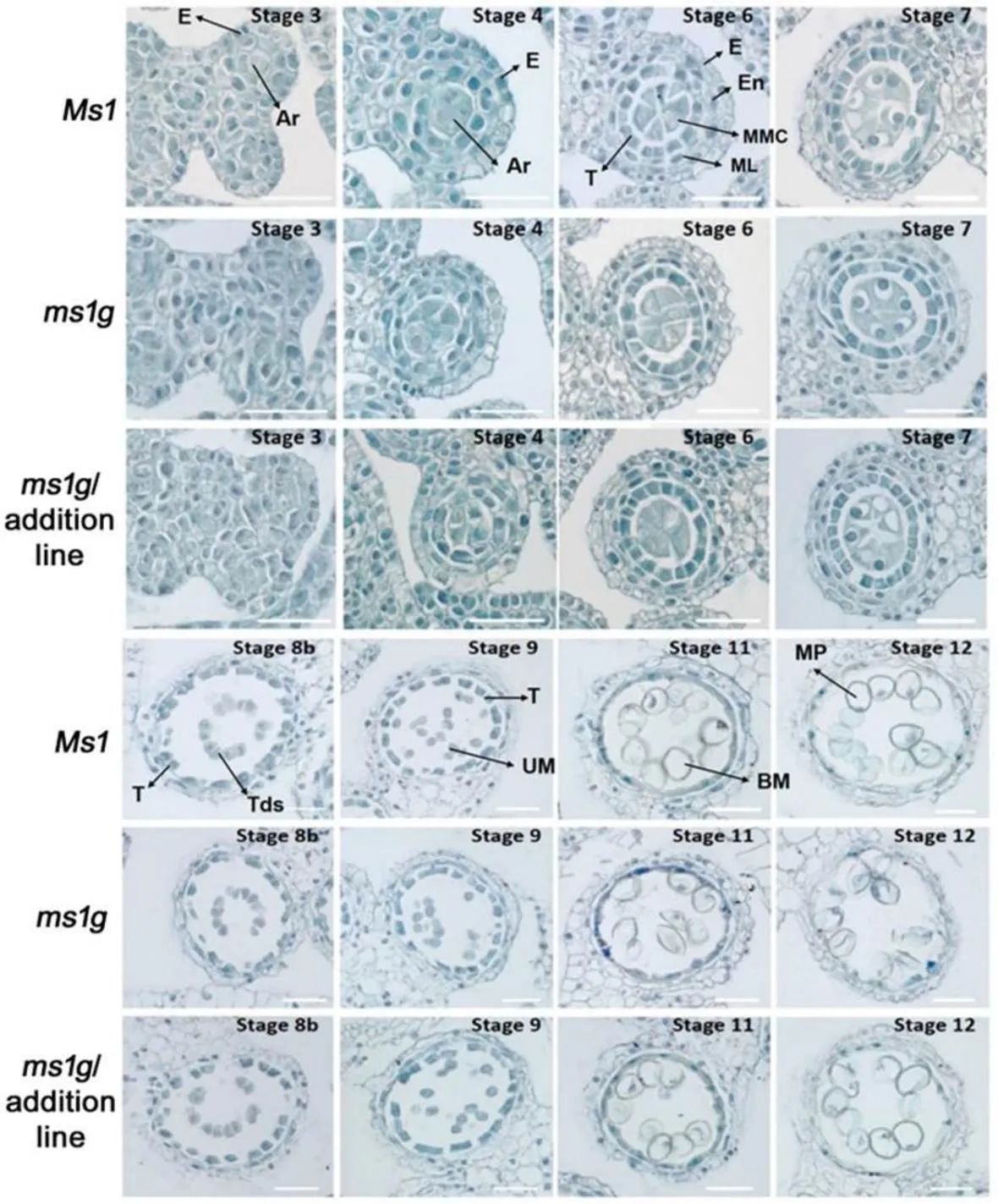
E:表皮层;Ar:孢原细胞;Sp:造孢细胞;En:内皮层;ML:中间层;T:绒毡层;MMC:小孢子母细胞;MC:减数分裂细胞;Tds:四分体;BP:双核期花粉;MP:三核期花粉。标尺=50 μm
E: epidermis; Ar: archesporial cell; Sp: sporogenous cell; En: endothecium; ML: middle layer; T: tapetum; MMC: microspore mother cell; MC: meiotic cell; Tds: tetrads; BP: bicellular pollen; MP: mature pollen. Bar=50 μm
附图2 普通小麦、突变体、/附加系中不同 时期花药组织石蜡切片观察
Fig. S2 Paraffin sections of anthers from bread wheat,,/addition line at different stages
依据小麦中的序列及禾本科其他物种中的相似序列比对结果,设计扩增引物,从小麦-十倍体长穗偃麦草异附加系中,克隆了来自十倍体长穗偃麦草的雄性育性恢复基因。与小麦4A4B4D染色体上3个同源基因、和(来自小麦B基因组)的基因组序列进行比对分析,显示与小麦的这三个同源基因在基因组序列上相似性分别为88.24%、82.91%和88.94%(电子附图3)。

附图3及小麦同源基因序列比对分析
Fig. S3 Sequence alignment ofand its orthologues in bread wheat
为了进一步检测小麦-4Ag异附加系和十倍体长穗偃麦草中的拷贝数量,设计了特异的探针(序列见附图3红框中所示),通过Southern blot在小麦-4Ag附加系和十倍体长穗偃麦草中分别检测到一条的特异杂交信号(图2);而在普通小麦和雄性不育突变体中都没有检测到特异的杂交信号,表明-4Ag附加系中含有一个拷贝,十倍体长穗偃麦草也含有一个拷贝(但可能还含有的同源基因)
2.2 ThMs1转基因功能验证
序列对比结果表明,是小麦的同源基因(电子附图3)。为验证的功能,构建用于功能互补试验的::载体(电子附图1-A),并将其转入-4Ag单体异附加系植株的幼胚所制备的愈伤组织中,独立进行2批转化。通过在转化载体上设计3对PCR引物鉴定转基因完整性,获得13株背景为纯合基因型的T0代转基因阳性植株,后期观察其花粉育性。可育的T0代转基因阳性植株自交结实得到的T1代株系继续PCR鉴定,获得5个独立的、背景为纯合,且不带有4Ag染色体、转基因可以稳定遗传的株系。上述转基因株系进行穗型、花药形态和花粉育性等观察,结果表明,在小麦中转入能够使突变体的花粉发育恢复正常,并正常结实(图3),表明是小麦的同源基因,而且在小麦体内能够完全替代小麦的功能;同时也说明对小麦的育性表型而言,虽然小麦-4Ag异附加系转入了一条染色体,但发挥恢复育性功能的只是一个基因。
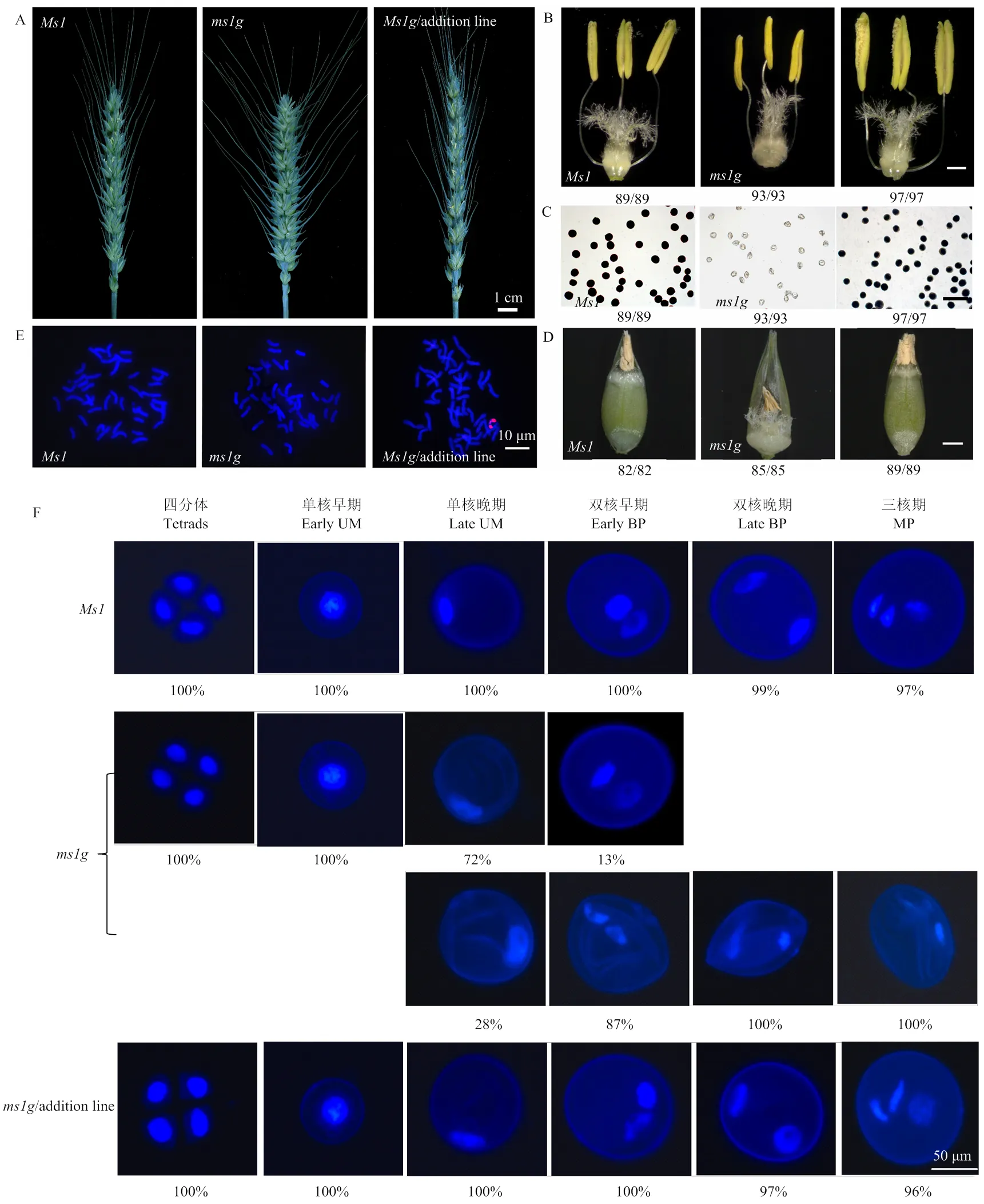
A:开花期小麦穗,标尺=1 cm;B:花丝伸长之后开裂的花药,标尺=1 mm;C:成熟花粉粒I2-KI染色,标尺=200 μm;D:授粉后15 d的种子,标尺=1 mm,B、C和D图下数字表示统计有此表型的株数及观察的总株数;E:基因组原位杂交分析,红色荧光代表附加染色体;标尺=10 μm;F:花粉DAPI染色,Bar=50 μm
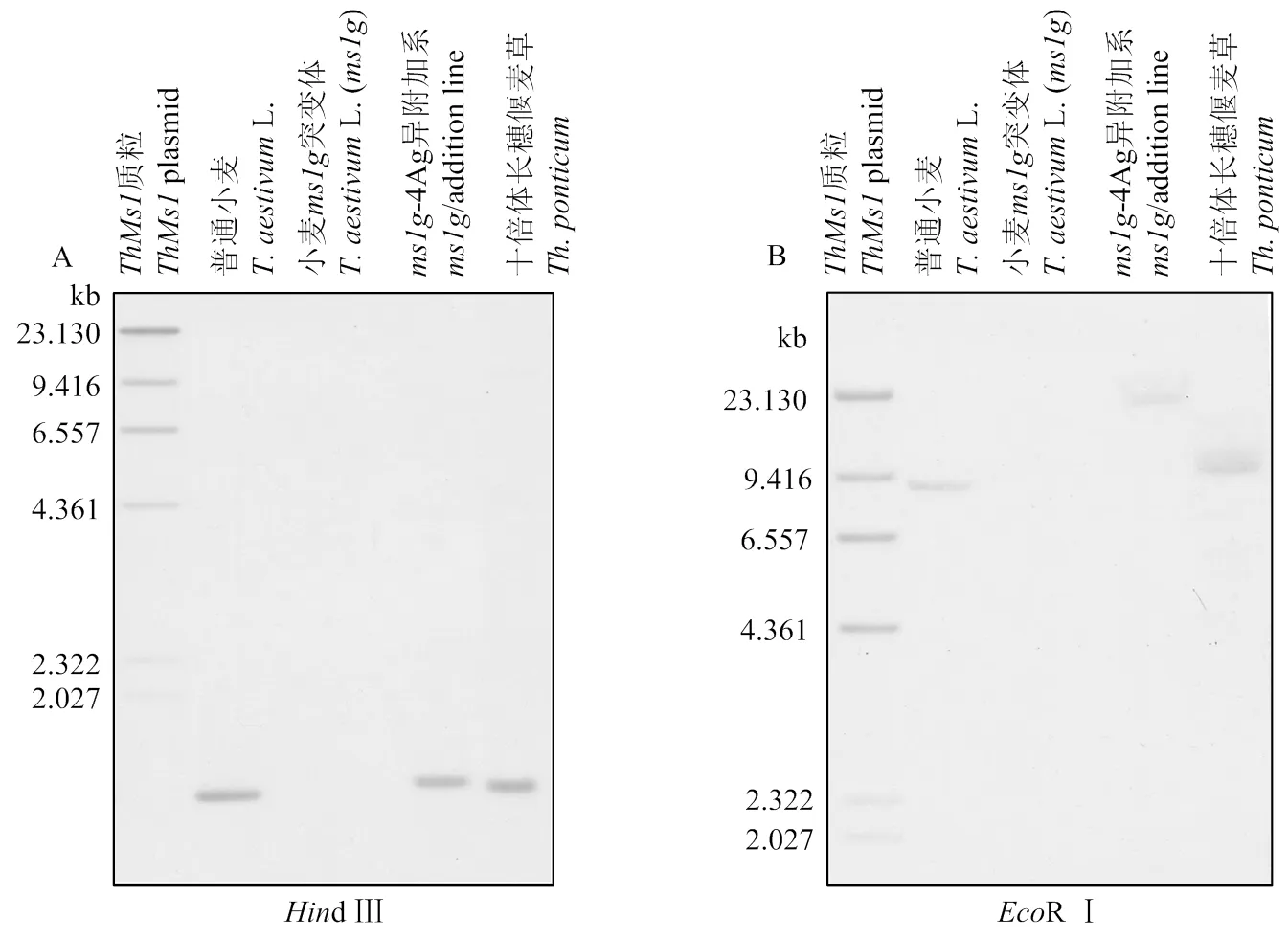
基因组DNA分别用HindⅢ(A)和EcoRⅠ(B)酶切处理 Genomic DNA was digested with HindⅢ(A) and EcoRⅠ(B), respectively

普通小麦、小麦雄性不育突变体ms1g、背景为ms1g纯合的T1代ThMs1转基因阳性株系。A:开花期小麦穗,标尺=1 cm;B:花丝伸长之后的花药,标尺=1 mm;C:开花后15 d的种子,标尺=1 mm;D:成熟花粉粒I2-KI染色,标尺=200 μm,B、C和D图下数字表示统计有此表型的株数及观察的总株数
2.3 ThMs1的表达检测及蛋白聚类分析
基因的表达模式对其发挥功能非常关键,通过以下3种方式检测在小麦-4Ag附加系中的表达模式并与小麦的表达模式比较:RT-PCR、qRT-PCR和RNA原位杂交。RT-PCR和qRT-PCR表达分析显示和在小麦根、茎、叶中无表达,在内外稃和雌蕊中也无表达;在发育的穗中有表达,尤其在减数分裂期的花药中表达量较高,在单核期的花药中有表达但表达量较低(图4-A—图4-D)。另外,小麦基因组中还含有的2个同源基因和,这两个基因在所检测的所有组织中均没有表达,表明这两个同源基因的表达可能被沉默了(图4-A和图4-B)。上述关于以及它的2个同源基因和表达模式与之前的报道一致[13],同时也表明十倍体长穗偃麦的在4Ag附加系中与小麦中的在小麦中具有非常相似的表达模式。
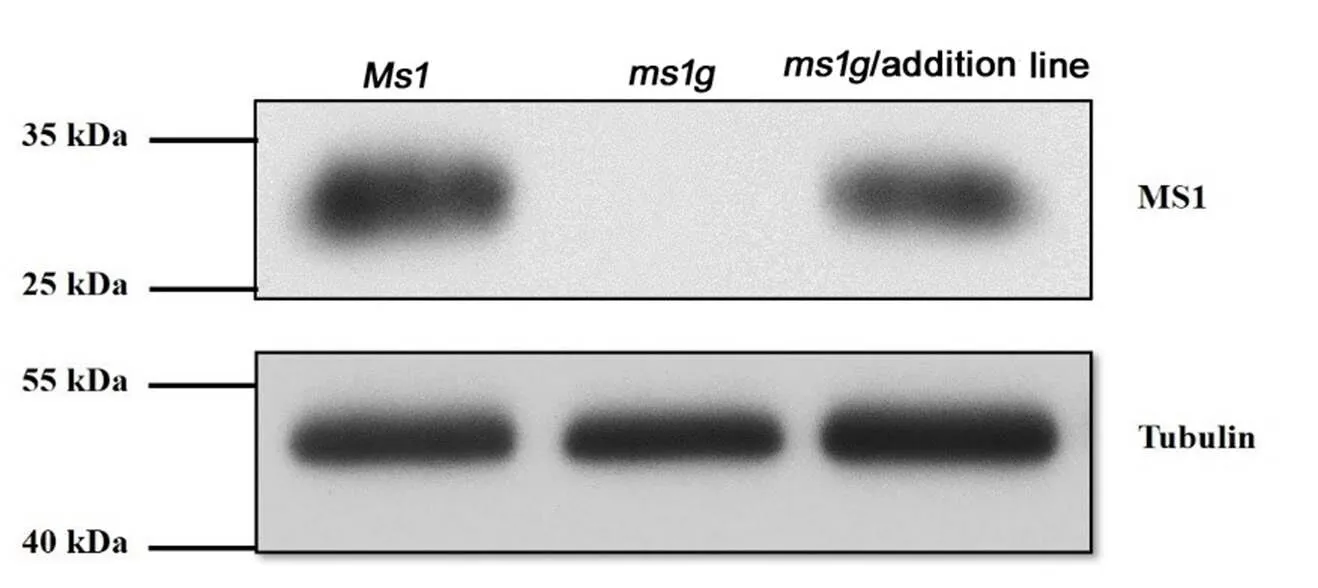
附图4 Ms1和ThMs1分别在普通小麦、4Ag附加系的减数分裂期花药中表达检测
Fig. S4 Analysis of expression of Ms1 and ThMs1 in developing anther during microspore meiosis from bread wheat and-4Ag addition line
进一步通过RNA原位杂交发现和在小孢子母细胞特异表达,两者具有相似的表达模式,它们在花药发育的第6期和第7期小孢子母细胞发育时表达量比较高,到花药发育的第8期四分体时期表达量明显下调(图4-E和图4-F),该表达模式与小麦的功能以及在小麦4Ag附加系中的功能一致,同时也很好地解释了为何在小麦4Ag附加系中可以替代小麦的功能(二者有非常相似的表达模式)。
Western blot检测发现Ms1和ThMs1蛋白分别在普通小麦和4Ag附加系的减数分裂期花药中表达,而雄性不育突变体中没有Ms1表达(电子附图4)。上述结果一方面说明制备的小麦Ms1抗体能够特异识别Ms1及其同源蛋白,同时也表明ThMs1和Ms1蛋白也有相似的表达模式。
为了解小麦和偃麦草的演化关系,将不同物种中同源序列进行比对(电子附图5)。通过聚类分析发现,只存在于禾本科植物中(电子附图6)。十倍体长穗偃麦草的ThMs1蛋白与普通小麦、四倍体小麦、二倍体小麦祖先种中的MS1蛋白亲缘关系较近,属于同一分支(电子附图6)。上述结果表明是禾本科植物进化过程形成的一个新基因,同时也说明禾本科植物雄性育性调控可能与双子叶植物如拟南芥以及禾本科植物以外的单子叶植物有不同之处。
Th:十倍体长穗偃麦草;Aet:节节麦;Ta:普通小麦;Tt:圆锥小麦;Tu:乌拉尔图小麦;Bradi:二穗短柄草;Brast:短柄藓;:大麦;:毛竹;:假稻属;:水稻;:结缕草;:芦苇;:淡竹叶;Sb:高粱;Si:谷子;Sevir:狗尾草;Pavir:柳枝稷。下同The same as below
附图5 ThMs1及其同源蛋白序列的比对分析
Fig. S5 Sequence alignment of ThMs1 and its orthologues in poaceae plants

Sequences were used to produce the phylogenetic tree shown in Fig. S4
聚类分析的序列同附图4
附图6 ThMs1及其同源蛋白的聚类分析
Fig. S6 Phylogenetic tree of ThMs1 and its orthologs in Poaceae plants
2.4 ThMs1蛋白具有脂结合活性
ThMs1蛋白结构预测显示中间有一个具有8个半胱氨酸残基保守结构的脂结合结构域(电子附图7)。鉴于ThMs1与Ms1同样具有预测的脂结合(lipid transfer protein,LTP)结构域,试图鉴定ThMs1是否具有脂分子结合活性,并以Ms1作对照。为此,首先在大肠杆菌中表达Ms1和ThMs1蛋白,蛋白可溶性检测发现经过IPTG诱导后能够在细菌中表达MBP-His、MBP-Ms1-His和MBP-ThMs1-His蛋白,进一步纯化了这三种融合蛋白(图5)。利用纯化的MBP-His、MBP-Ms1-His、MBP-ThMs1-His蛋白的脂结合试验表明,与Ms1类似,ThMs1蛋白可以结合磷脂酸(phosphatidic acid,PA)和磷酸化的磷脂酰肌醇(phosphatidylinositols,PIs),包括:磷脂酰肌醇-3-磷酸(PI(3)P)、磷脂酰肌醇-4-磷酸(PI(4)P)、磷脂酰肌醇-5-磷酸(PI(5)P)、磷脂酰肌醇-3,4-二磷酸(PI(3,4)P2)、磷脂酰肌醇-3,5-二磷酸(PI(3,5)P2)、磷脂酰肌醇-4,5-二磷酸(PI(4,5)P2)和磷脂酰肌醇-3,4,5-三磷酸(PI(3,4,5)P3),但不结合测试的其他脂类分子(图5),表明Ms1和ThMs1蛋白均特异结合磷脂酸和磷酸化的磷脂酰肌醇。
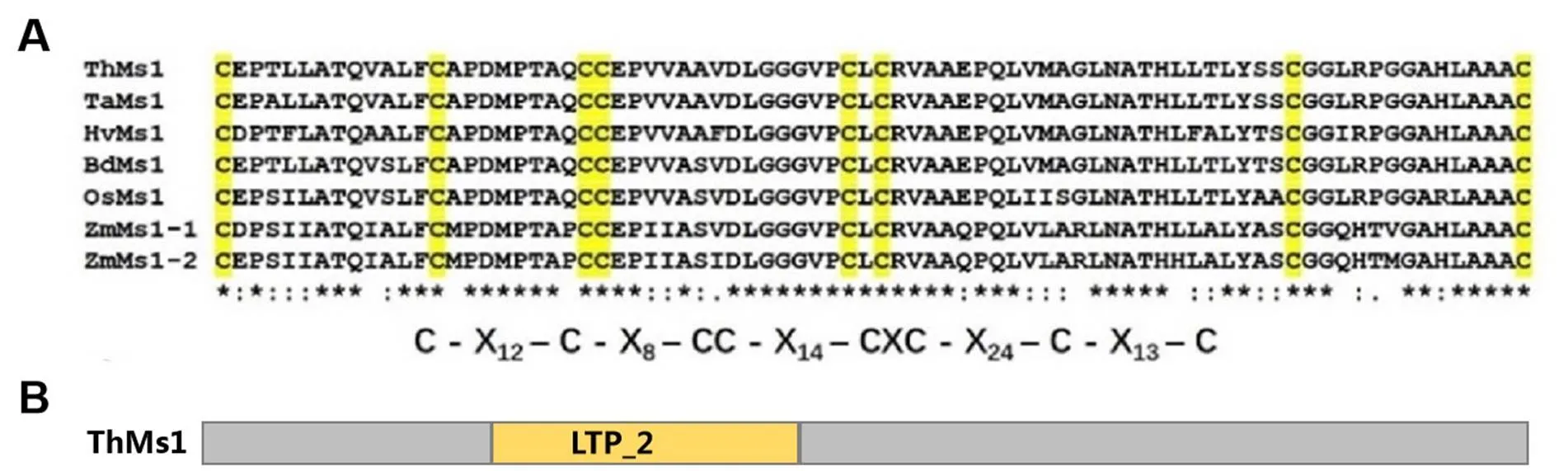
A:8个半胱氨酸残基保守结构;B:预测的脂结合序列
A: The conserved domain with 8 Cysteine residues; B: Predicted lipid binding domain
附图7 ThMs1蛋白结构预测
Fig. S7 The predicted structures of ThMs1
3 讨论
十倍体长穗偃麦草是小麦的野生近缘种,具有抗病、抗旱、长穗多花等多种优良性状,对小麦的遗传改良具有重要作用[6-8]。本研究发现来自十倍体长穗偃麦草基因组中的小麦雄性育性基因的同源基因具有与小麦相似的基因结构(电子附图3和电子附图7),而且在小麦中与小麦具有相似的组织细胞特异性表达模式(图4),ThMs1和Ms1蛋白都具有脂结合活性(图6),最终导致这两个基因也具有相似的生物学功能,ThMs1可以替代Ms1的功能恢复小麦雄性不育突变体的花粉育性缺陷(图1和图2)。
利用杂种优势制备杂交种是作物遗传育种的重要方向之一,玉米等主要农作物已经在杂交育种方面取得了成功并产生巨大的经济效益,目前种植的玉米品种主要是通过杂交育种制备的品种[24-25]。Freeman[26]首次报道了小麦的杂种优势,之后研究人员也证实杂交小麦的生产潜力[27-28],但由于小麦是自花授粉作物,无法实现通过人工去雄进行大规模杂交制种,所以利用雄性不育进行小麦杂交制种是实现小麦杂种优势利用的最佳选择[29-30]。过去几十年建立的小麦杂交育种体系各有缺陷:以细胞质雄性不育为基础的第一代“三系法”系统,受恢保关系的制约导致资源利用率低[31-32];以环境敏感型雄性不育为基础的“两系法”系统受光温条件影响较大、无法满足杂交种纯度要求[28, 33-34],导致目前全球杂交小麦种植面积比例很低;化学杀雄法制备杂交种,存在杀雄专一性不够、成本高、易污染环境等缺点[28,35]。分子设计杂交育种技术具有不育性稳定、控制不育性状的基因遗传行为简单易于开展优良性状的聚合育种等优点[4-5,36]。目前,利用此方法已成功实现了杂交水稻育种技术的新突破[4-5]。分子设计杂交育种技术也应该适用于小麦杂交育种实践,而实现小麦分子设计杂交育种技术的关键是筛选稳定的小麦雄性不育突变体及对应的育性恢复基因。本研究获得了一个新的小麦雄性育性恢复基因,该基因在突变体中能够完全替代小麦的功能恢复雄性育性(图1和图2)。因此,可以替代小麦作为育性恢复基因,应用于利用小麦隐性核雄性不育突变体制备小麦新一代杂交育种体系中。同时,由于十倍体长穗偃麦草以及该附加系中含有植物育性以及一些抗性基因,该附加系可以应用于小麦杂交育种体系中。为此,本文也提供了把十倍体长穗偃麦草控制重要农艺性状基因用于小麦育种的一种模式,即可以通过杂交把十倍体长穗偃麦草的某一条染色体导入小麦细胞或把某个控制重要农艺性状的基因转入到小麦基因组中。
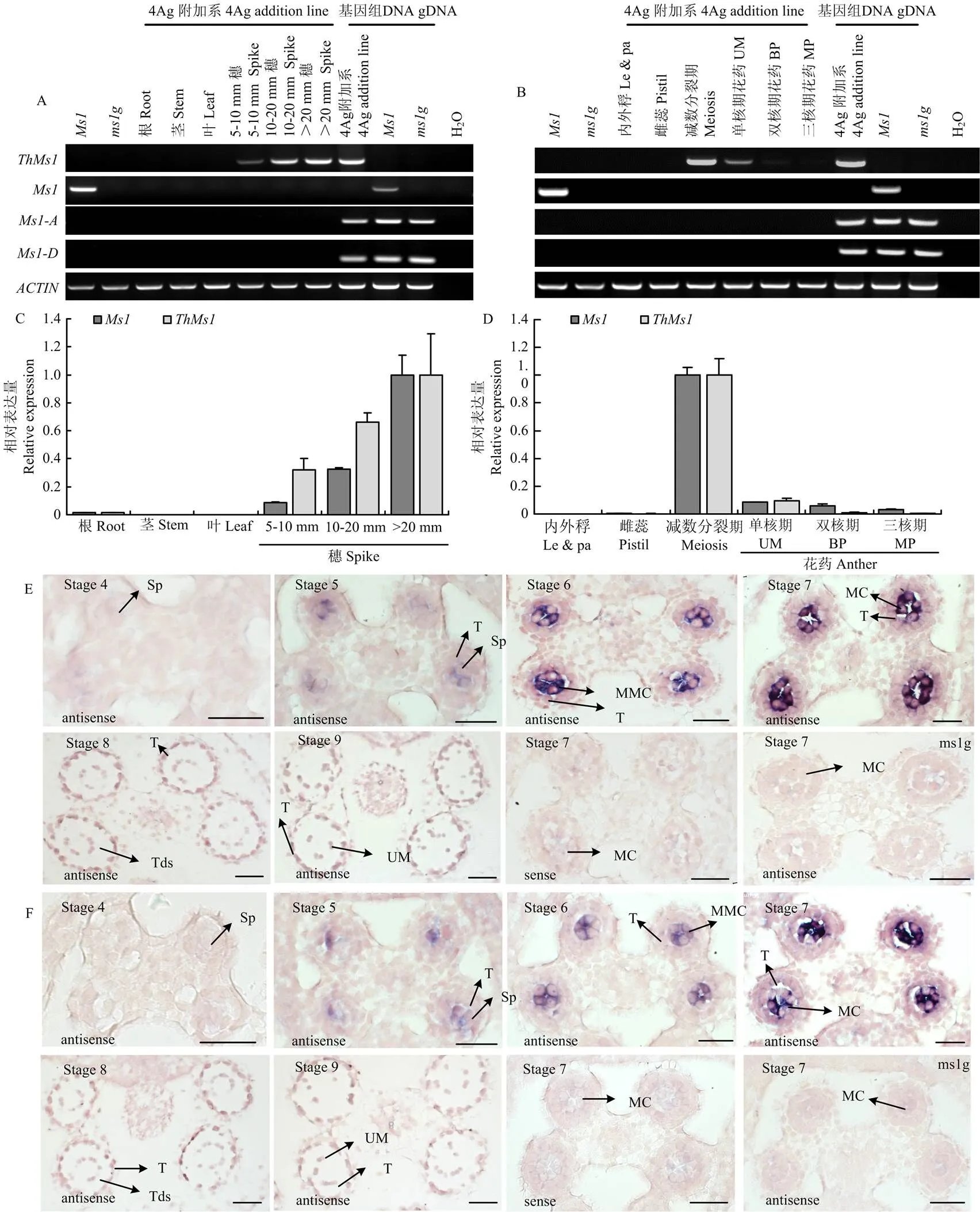
A、B:半定量PCR;C、D:实时荧光定量PCR;E、F:RNA原位杂交分析。Ms1在普通小麦中检测,ThMs1在4Ag附加系中检测。Sp:造孢细胞;T:绒毡层;MMC:小孢子母细胞;MC:减数分裂细胞;Tds:四分体;Le&pa:内外稃;UM:单核期花粉;BP:双核期花粉;MP:三核期花粉;标尺=50 μm
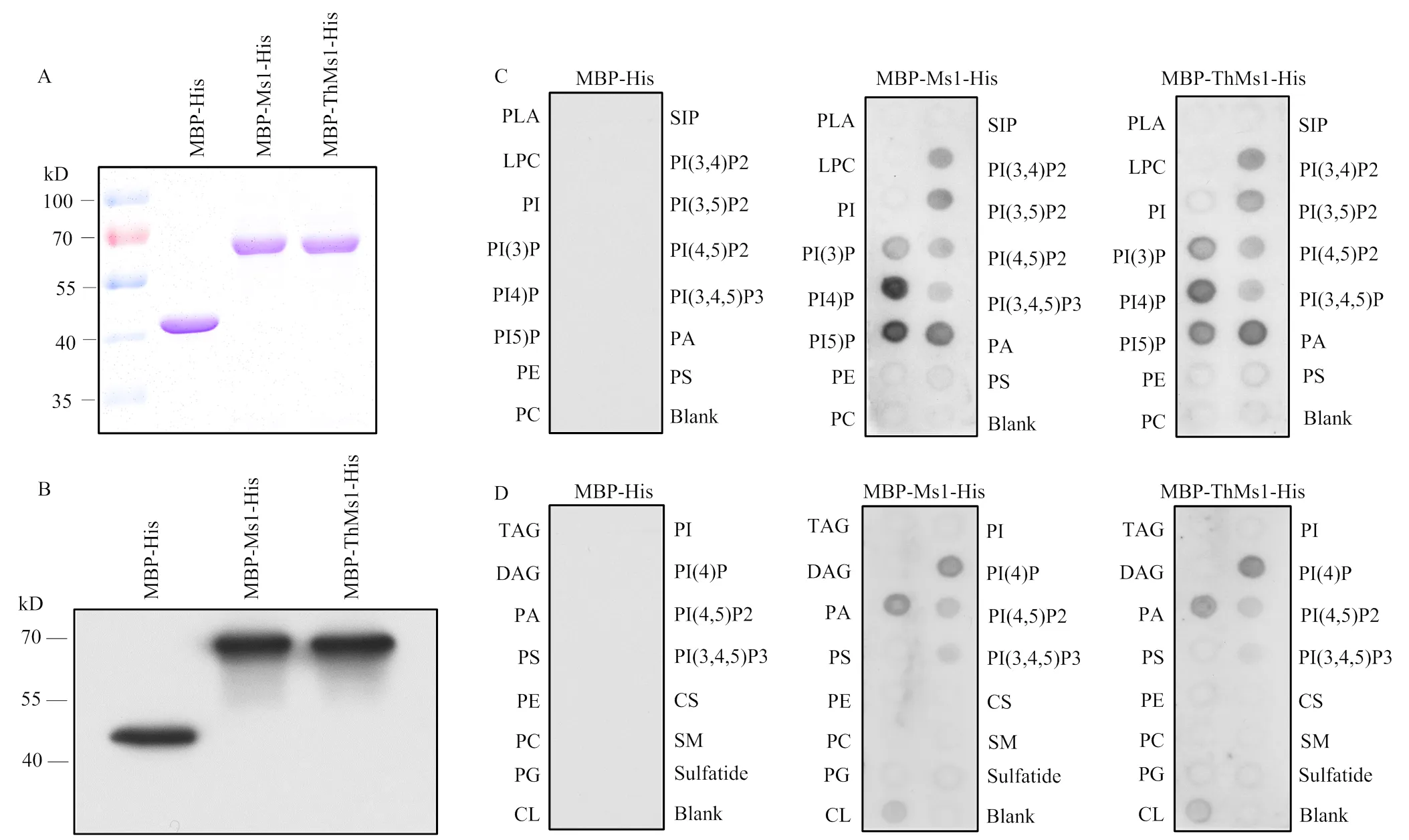
A、B:MBP-His、MBP-Ms1-His、MBP-ThMs1-His蛋白的纯化和检测;MBP-His、MBP-Ms1-His、MBP-ThMs1-His蛋白覆膜:脂膜P-6001(C)和脂膜P-6002(D)。CL:心磷脂;CS:胆固醇;DAG:二酰甘油;LPA:溶血磷脂酸;LPC:溶血磷脂酰胆碱;PE:磷脂酰乙醇胺;PG:磷脂酰甘油;PI:磷脂酰肌醇;PI(3)P:磷脂酰肌醇-3-磷酸;PI(4)P:磷脂酰肌醇-4-磷酸;PI(5)P:磷脂酰肌醇-5-磷酸;PI(3,4)P2:磷脂酰肌醇-3,4-二磷酸;PI(3,5)P2:磷脂酰肌醇-3,5-二磷酸酯;PI(4,5)P2:磷脂酰肌醇-4,5-二磷酸;PI(3,4,5)P3:磷脂酰肌醇-3,4,5-三磷酸;PS:磷脂酰丝氨酸;SM:鞘磷脂;S1P:鞘氨醇-1-磷酸;TAG:三酰甘油
4 结论
克隆了十倍体长穗偃麦草4Ag染色体上携带的,偃麦草中的在小麦体内与小麦具有相似的时空表达模式,2个蛋白也具有相似的生化活性和生物学功能。
[1] TILMAN D, CASSMAN K G, MATSON P A, NAYLOR R, POLASKY S. Agricultural sustainability and intensive production practices., 2002, 418: 671-677.
[2] FOLEY J A, RAMANKUTTY N, BRAUMAN K A, CASSIDY E S, GERBER J S, JOHNSTON M, MUELLER N D, O’CONNELL C, RAY D K, WEST P C, BALZER C, BENNETT E M, CARPENTER S R, HILL J, MONFREDA C, POLASKY S, ROCKSTRÖM J, SHEEHAN J, SIEBERT S, TILMAN D, ZAKS D P M. Solutions for a cultivated planet., 2011, 478: 337-342.
[3] IWGSC. A chromosome-based draft sequence of the hexaploid bread wheat (Triticum aestivum) genome.Science, 2014, 345: 1251788.
[4] Chang Z Y, Chen Z F, Wang N, Xie G, Lu J W, Yan W, Zhou J L, Tang X Y, Deng X W. Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene.,2016, 113: 14145-14150.
[5] 邓兴旺, 王海洋, 唐晓艳, 周君莉, 陈浩东, 何光明, 陈良碧, 许智宏. 杂交水稻育种将迎来新时代. 中国科学: 生命科学, 2013, 43: 864-868.
Deng X W, WANG H Y, TANG X Y, ZHOU J L, CHEN H D, HE G M, CHEN L B, XU Z H. Hybrid rice breeding welcomes a new era of molecular crop design., 2013, 43: 864-868. (in Chinese)
[6] Ceoloni C, Forte P, Kuzmanović L, Tundo S, Moscetti I, Vita D P, Virili M E, Ovidio R D. Cytogenetic mapping of a major locus for resistance to Fusarium head blight and crown rot of wheat on7EL and its pyramiding with valuable genes from ahomoeologous arm onto bread wheat 7DL., 2017, 130(10): 2005-2024.
[7] Zhang X Y, Li Z S, Chen S Y. Production and identification of three 4Ag (4D) substitution lines of: relative transmission rate of alien chromosomes., 1992, 83: 707-714.
[8] Wang S W, Wang C Y, Wang Y Z, Wang Y J, Chen C H, Ji W Q. Molecular cytogenetic identification of two wheat-substitution lines conferring stripe rust resistance., 2019, 39: 143-153.
[9] Klindworth D L, Williams N D, Maan S S. Chromosomal location of genetic male sterility genes in four mutants of hexaploid wheat., 2002, 42: 1447-1450.
[10] McIntosh R A, Yamazaki Y, Dubcovsky J, ROGERS J, MORRIS C, APPELS R, XIA X C. Catalogue of gene symbols for wheat//. Yokohama, Japan, 2013.
[11] Ni F, Qi J, Hao Q, Lyu B, Luo M, Wang Y, Chen F, Wang S, Zhang C, Epstein L, Zhao X, Wang H, Zhang X, Chen C, Sun L, Fu D. Wheatencodes for an orphan protein that confers male sterility in grass species., 2017, 8: 15121-15132.
[12] Xia C, Zhang L C, Zou C, Gu Y Q, Duan J L, Zhao G Y, Wu J J, Liu Y, Fang X H, Gao L F, Jiao Y N, Sun J Q, Pan Y H, Liu X, Jia J Z, Kong X Y. A TRIM insertion in the promoter ofcauses male sterility in wheat., 2017, 8: 15407-15416.
[13] Wang Z, Li J, Chen S X, Heng Y F, Chen Z, Yang J, ZhouK J, PeiJ W, HeH, Deng X W, Ma L G. Poaceae-specificencodes a phospholipid-binding protein for male fertility in bread wheat., 2017, 114: 12614-12619.
[14] Tucker E J, Baumanu U, Kouidri A, Suchecki R, Baes M, Garcia M, Okada T, Dong C, Wu Y, Sandhu A, Cigan A M, Whitford R. Molecular identification of the wheat male fertility geneand its prospects for hybrid breeding., 2017, 8: 869-879.
[15] Pallotta M A, Warner P, Kouidri A, Tucker E J, Mathieu B, Suchecki R, Watson-Haigh N, Okada T, Garcia M, Sandhu A, Singh M, Wolters P, Albertsen M C, CiganA M, Baumann U, Whitford R. Wheatmale-sterility is induced by recessive homoeologous A and D genome non-specific lipid transfer proteins., 2019, 99: 673-685.
[16] Liu L, Luo Q, Li H, Li B, Li Z, Zheng Q. Physical mapping of the blue-grained gene fromchromosome 4Ag and development of blue-grain-related molecular markers and a FISH probe based on SLAF-seq technology., 2018, 122: 1007-1017.
[17] 刘成, 韩冉, 汪晓璐, 宫文萍, 程敦公, 曹新有, 刘爱峰, 李豪圣, 刘建军. 小麦远缘杂交现状、抗病基因转移及利用研究进展.中国农业科学, 2020, 53(7): 1287-1308.
LIU C, HAN R, WANG X L, GONG W P, CHENG D G, CAO X Y, LIU A F, LI H S, LIU J J. Research progress of wheat wild hybridization, disease resistance genes transfer and utilization., 2020, 53(7): 1287-1308. (in Chinese)
[18] Zhang W, Cao Y P, Zhang M Y, Zhu X W, Ren S F, Long Y M, Gyawali Y, Chao S, Xu S, Cai X W. Meiotic homoeologous recombination-based alien gene introgression in the genomics era of wheat., 2017, 57: 1189-1198.
[19] Kuzmanovic L, Mandalà G, Tundo S, Ciorba R, Frangella M, Ruggeri R, Rossini F, Gevi F, Rinalducci S, Ceoloni C. Equipping durum wheat-recombinant lines with amajor QTL for resistance to fusarium diseases through a cytogenetic strategy., 2019, 10: 1324.
[20] Zhao J, Hao W W, Tang C G, Yao H, Li B C, Zheng Q, Li Z S, Zhang X Y. Plasticity inDNA sequences: a wheat 3 tall wheatgrass (decaploid) model., 2019, 100: 314-327.
[21] Shitsukawa N, Tahira C, Kassai K, Hirabayashi K, Shimizu T, Takumi S, Mochida K, Kawaura K, Ogihara Y, Muraia K. Genetic and epigenetic alteration among three homoeologous genes of a class E MADS Box gene in hexaploid wheat., 2007, 19: 1723-1737.
[22] Benning C. Mechanisms of lipid transport involved in organelle biogenesis in plant cells., 2009, 25: 71-91.
[23] Dowler S, Kular G, Alessi D R. Protein lipid overlay assay., 2002, 129: 16-26.
[24] Tester M, Langridge P. Breeding technologies to increase crop production in a changing world., 2010, 327: 818-822.
[25] Li S, Yang D, Zhu Y. Characterization and use of male sterility in hybrid rice breeding., 2007, 49: 791-804.
[26] Freeman G F. Heredity of quantitative characters in wheat., 1919, 4: 1-93.
[27] Singh S K, Chatrath R, Mishra B. Perspective of hybrid wheat research: A review., 2010, 80: 1013-1027.
[28] Whitford R, Fleury D, Reif J C, Garcia M, Okada T, Korzun V, Langridge P. Hybrid breeding in wheat: technologies to improve hybrid wheat seed production., 2013, 64: 5411-5428.
[29] Singh S P, Singh S P, Pandey T, Singh R R, Sawant S V. A novel male sterility-fertility restoration system in plants for hybrid seed production., 2015, 5: 11274-11288.
[30] Kim Y J, Zhang D. Molecular control of male fertility for crop hybrid breeding., 2018, 23: 53-65.
[31] Franckowiak J D, Maan S S, Williams N D. A proposal for hybrid wheat utilizing AegilopssquarrosaL. cytoplasm. CropScience, 1976, 16: 725-728.
[32] Wilson J A. Hybrid wheat breeding and commercial seed development. Plant Breeding Reviews, 1984, 2: 303-319.
[33] Perez-Prat E, van Lookeren Campagne M M. Hybrid seed production and the challenge of propagating male-sterile plants., 2002, 7: 199-203.
[34] 成功海, 龚德平, 郭西陵, 邱文兵, 何庆虎. C49S温光型两系杂种小麦在江汉平原生产应用中的几个问题. 麦类作物学报, 2005, 25: 147-148.
Cheng G H, Gong D P, Guo X L, Qiu W B, He Q H. Problems of the hybrid with Chongqing thermo-photo-sensitive male sterility wheat C49S in the plain of Jianghan. Mailei Zuowu Xuebao, 2005, 25: 147-148. (in Chinese)
[35] SINGH S P, SRIVASTAVA R, KUMAR J. Male sterility systems in wheat and opportunities for hybrid wheat development., 2015, 37: 1713-1720.
[36] Song S, Wang T, Li Y, Hu J, Kan R, Qiu M, Deng Y, Liu P, Zhang L, Dong H, Li C, Yu D, Li X, Yuan D, Yuan L, Li L. A novel strategy for creating a new system of third-generation hybrid rice technology using a cytoplasmic sterility gene and a genic male-sterile gene., 2020: 1-10.
Cloning, Expression and Functional Analysis of a Male Fertility Gene
HENG YanFang1, LI Jian2, WANG Zheng2, CHEN Zhuo1, HE Hang2, DENG XingWang2, MA LiGeng1
(1College of Life Sciences, Capital Normal University, Beijing 100048;2Peking University Institute of Advanced Agricultural Sciences, Weifang 261325, Shandong)
【】To clone a new male fertility gene,, from the-4Ag wheat-alien addition line, and characterize the expression pattern and biological function of【】4Ag chromosome fromin wheat-alien addition line was identified by GISH.was cloned from the wheat-alien addition line by homology-based cloning, and the analysis of the function of, further analyzing its tissue-specific expression by RNAhybridization. The expression of ThMs1 proteinwas detected by Western blot using specific anti-Ms1 antibodies. ThMs1 protein structure were predicted by SignalP software. The detection of lipid-binding activity of ThMs1 was performed by dot blot.【】The wheat-alien addition line harbored 4Ag chromosome from., the homolog of bread wheat male fertility gene, was cloned from the wheat-alien addition line. The functional complementation analysis confirmed that thecan completely restore the male fertility phenotype of the wheat. The phylogenetic analysis suggested that theonly exists in the Poaceae family. RT-PCR and qRT-PCR analysis confirmed thatgene was expressed in anthers during meiosis. RNAhybridization analysis revealed thatwas specifically expressed in microspore during wheat microsporogenesis. Western blot showed that ThMs1 was detected in wheat anther. The structure prediction analysis revealed that it has a predicted lipid binding domain, and protein lipid-binding experiments indicated that ThMs1 protein specifically binds PA and several phosphatidylinositols.【】A new male fertility gene,, was cloned from wheat-alien additiona line.exhibits similar expression pattern to that of.
bread wheat; wheat-alien addition line; recessive nuclear male sterility;;; wheat hybrid breeding system; molecular design

10.3864/j.issn.0578-1752.2020.23.001
2020-09-20;
2020-10-30
北京市自然科学基金委-北京市教委联合资助重点项目(IDHT20170513)
衡燕芳,E-mail:yanfangh@126.com。通信作者马力耕,E-mail:ligeng.ma@cnu.edu.cn
(责任编辑 李莉)

