内蒙古自治区3 500例新生儿遗传性耳聋基因位点筛查分析*
周雪原,马玉珍,李 灵,秦 磊,庞晓燕,侯东霞,冀小平△,王晓华▲
(1.内蒙古自治区妇幼保健院遗传优生科,内蒙古呼和浩特 010020; 2.内蒙古自治区人民医院生殖中心,内蒙古呼和浩特 010017)
耳聋是最常见的致残疾病,据全国第二次残疾人抽样调查显示,我国约有2 780万听力障碍人士,约占总残疾人数的33.5%[1]。耳聋与外界环境和遗传等多种因素有关,60%的耳聋与遗传有关[2]。有研究表明,80%的遗传性耳聋是由GJB2、SLC26A4、线粒体12SrRNA、GJB3功能基因突变引起[3-5]。本研究采用联合探针锚定聚合测序法检测遗传性耳聋常见的4个致病基因20个位点,了解内蒙古自治区新生儿遗传性耳聋基因突变情况,为本地区新生儿遗传病防治、预防出生缺陷提供数据支持。
1 资料与方法
1.1一般资料 选取2018年1月1日至6月30日在内蒙古自治区妇幼保健院正常分娩的3 500例新生儿为研究对象,所有研究对象家属均自愿让新生儿接受遗传性耳聋基因检测,并签署知情同意书。
1.2仪器与试剂 华大生物科技有限公司核酸纯化试剂、测序反应通用试剂盒(联合探针锚定聚合测序法)、遗传性耳聋基因检测试剂盒(联合探针锚定聚合测序法)、基因测序仪(BGISEQ-500)。
1.3方法
1.3.1标本采集 3 500例新生儿均采集足跟血,并制成干血斑,4 ℃保存备用。
1.3.2基因组DNA提取 使用干血斑核酸提取试剂盒提取基因组DNA。DNA水平经测定,在20~50 ng/μL为宜,-20 ℃暂存备用。
1.3.3文库制备 将提取基因组DNA标本经过打断修复,接头连接,PCR扩增进行文库制备。配制打断修复混合液,将基因组DNA打断修复。每个标本分别加入15 VL标签接头,接头与模板DNA结合,使每个模板都有特定标签并纯化。对模板进行PCR扩增,PCR扩增程序:94 ℃ 120 s,1个循环;94 ℃ 20 s,56 ℃ 30 s,60 ℃ 20 s,35个循环;72 ℃ 300 s,1个循环;12 ℃暂存。扩增产物纯化并测定其水平,≥2 ng/μL为合格。
1.3.4测序 针对新生儿进行的遗传性耳聋基因筛查仅针对常见的基因及其相关位点,如有突变,原则上召回并行相关基因突变位点测序,进一步给予临床指导。采用测序反应通用试剂盒(联合探针锚定聚合测序法)进行测序。
1.4统计学处理 数据分析应用遗传性耳聋基因分析软件,按照测序后数据分析标准流程操作,至少两人对测序数据进行分析整理,并核对。
2 结 果
2.1耳聋基因突变率统计 3 500例新生儿血液标本中,行遗传性耳聋4个基因20个位点筛查,总突变193例,总突变率为5.51%;杂合突变178例(含线粒体异质突变1例),杂合突变率为5.09%;纯合突变15例,纯合突变率为0.43%。其中GJB2、GJB3、SLC26A4均为杂合突变,线粒体12SrRNA异质突变1例,均质突变15例。见表1。
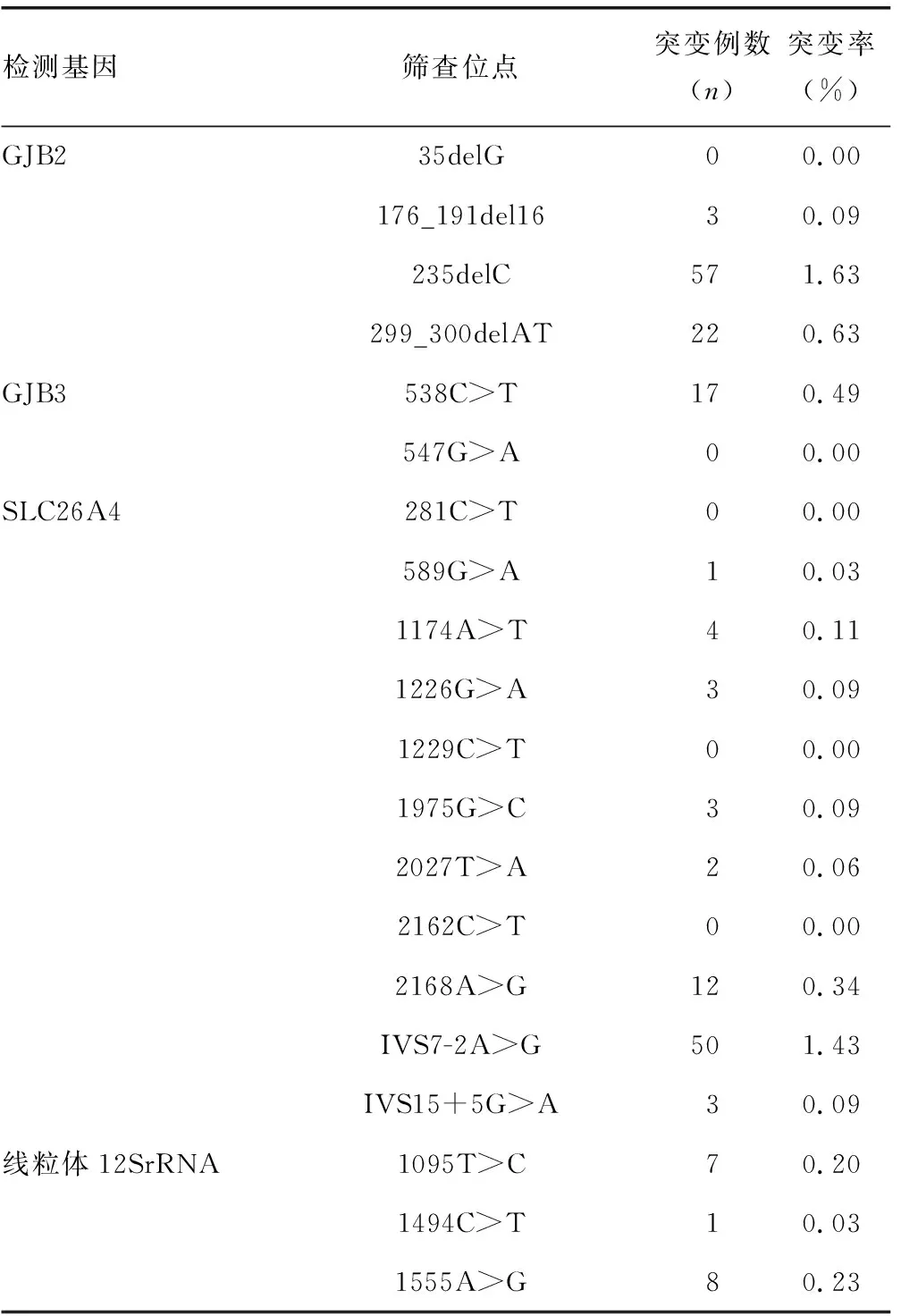
表1 耳聋基因筛查各位点突变率
2.2基因突变患儿随访情况 3 500例新生儿中有193例异常结果,其中常染色体显性遗传非综合征型耳聋相关GJB3基因杂合突变17例,均为538C>T位点突变;线粒体12SrRNA基因均质突变15例,异质突变1例。GJB3基因杂合突变与高频听力下降有关,可导致进行性或迟发型中度至极重度耳聋。对本次检测出的17例新生儿于2019年5月进行电话回访,家长表示1岁左右的受检者暂时未发现症状,建议患儿来耳鼻喉科例行体检,计划2020年5月再回访一次,持续监测受检者听力损伤情况。线粒体12SrRNA基因突变15例,均电话告知若受检者就医需提醒医生,该受检者对氨基糖苷类药物敏感,可出现“一针致聋”情况。2018年11月15例线粒体12SrRNA基因均质突变受检者母亲、同胞、母亲同胞姐妹、祖母等家族女性都做相应突变基因验证,发现除1例均质突变受检者无联系方式未回访,14例受检者中,有5例存在家族遗传史,其中2个家族为均质突变遗传,另3个家族有均质突变和异质突变病例;其余9例为新生儿突变,母亲和同胞等家族女性检测结果均正常,受精卵发育过程中出现相关基因突变。本研究对线粒体12SrRNA基因突变的家族分析,会在相应的家族统计文章中详细体现。
3 讨 论
据国内耳聋基因流行病学调查显示,我国遗传性耳聋基因大部分由4个基因突变引起:GJB3、GJB2、SLC26A4、线粒体12SrRNA,较常见的遗传性耳聋突变基因为GJB2,其次为SLC26A4、线粒体12SrRNA、GJB3[6-9]。携带有遗传性耳聋基因突变位点的女性在孕期可通过羊水穿刺对胎儿进行耳聋基因检测。对胎儿进行耳聋基因突变情况及出生后干预评估,可避免下一代致聋或携带致病基因,有效降低生育耳聋新生儿的风险。携带有线粒体12SrRNA相关突变位点的准妈妈,可有效防止“一针致聋”,并对其子女做好药物防护。有地方性研究发现新生儿耳聋基因阳性率高达4.98%[10-13]。本研究共检测随机时间段出生的3 500例新生儿,有193例新生儿存在单杂合耳聋基因突变,总突变率为5.51%,排除易感基因突变位点增多的因素,内蒙古自治区新生儿遗传性耳聋基因异常携带率明显高于其他文献报道[10-13],本研究有一定临床参考价值。
GJB2基因突变导致的耳聋为语前、双侧、对称性耳聋,听力损失程度变异较大,可由轻度到极重度,但多数为重度或极重度耳聋,GJB2基因和先天性耳聋有着密切关系。GJB2基因主要以常染色体隐性遗传方式向后代传递,此类遗传方式可通过分别获取来自父母的致聋基因引起耳聋。GJB2基因突变是常见的耳聋基因,GJB2基因同一位点纯合突变或两个不同位点杂合突变均可致聋[14]。本研究检测GJB2基因携带者有82例,杂合突变率为2.34%,携带者不会发病,但要密切关注,如果有听力损失方面的临床症状,建议做进一步耳聋基因检测,排除其他罕见耳聋基因位点突变。同时携带GJB2基因不同位点突变的夫妻,其子女发病风险为1/4,携带风险为1/2,正常概率为1/4。由于GJB2基因突变致聋符合人工耳蜗移植条件,可在出生18个月后进行人工耳蜗移植,避免由聋致哑。
GJB3基因的相关突变临床多表现为高频听力受损的进行性语后聋。GJB3基因是在我国本土克隆的第一个疾病相关基因。本研究中GJB3基因突变17例,单杂合突变率0.49%,与全国基因突变率基本一致[15-16]。GJB3基因突变可导致常染色体显性或隐性遗传非综合征型耳聋,GJB3基因编码连接蛋白,547G>A为错义突变,使连接蛋白31(Cx31)183号谷氨酸变为赖氨酸;538C>T为无义突变,使180号碱基位置突然编码终止。GJB2基因编码的连接蛋白26与GJB3基因编码的Cx31相互作用也可能引发耳聋。如果患者GJB3基因有突变,发现听力下降需及时到耳鼻喉科就诊,避免延误病情。
SLC26A4是俗称的“一巴掌致聋”基因,这个基因异常会导致后天迟发型耳聋,以及临床上常见的大前庭水管综合征。本研究中SLC26A4单杂合突变率为2.23%,与国内地方统计数值基本一致[17]。SLC26A4基因异常者主要表现为听力渐进性下降,如剧烈运动、头部磕碰等颅内压剧烈变化的情况下听力会出现明显下降[18]。该基因遵循隐性遗传的方式,大部分患儿的父母听力正常,患儿出生时听力正常,偶然一次玩耍、生病、打架之后致聋,如果提前预知其危险性,可避免或延缓耳聋的发生,将耳聋推迟至语言系统发育完善后。因此,尽早检测SLC26A4基因对儿童发育至关重要。
12SrRNA基因是线粒体基因,是俗称的“一针致聋”基因,携带该基因突变者使用一次性剂量的氨基糖苷类抗菌药物,如链霉素、庆大霉素等,便可致耳聋。本研究中有线粒体12SrRNA基因突变16例,突变率0.46%,与国内其他地方统计值基本一致[19]。该基因为线粒体基因,遵循母系遗传的方式。母亲为耳聋型药物的敏感人群,子女及其后代均为药物性耳聋人群。药物性耳聋基因的筛查能达到查出1人,预警10人的效果。
4 结 论
新生儿行遗传性耳聋基因检测具有重要而深远的意义,本研究发现,内蒙古自治区4种常见耳聋基因20个位点突变率(总突变率为5.51%)略高于全国(总突变率为4.98%)和我国其他地区突变率,下一步考虑在本地区将新生儿筛查数扩大,再统计遗传性耳聋基因突变率,观察是否有下降趋势。新生儿遗传性耳聋基因检测在内蒙古自治区持续推广非常必要。

