胃泌素17、胃蛋白酶原联合13C呼气试验在健康体检人群胃癌筛查中的应用研究
顾洁玲,周小丽
(江苏省泰州市人民医院消化内科,江苏泰州 225300)
胃部疾病是临床常见的消化道疾病,其中胃癌在世界范围内的发病率、病死率分别居恶性肿瘤的第5位和第3位,并且我国是胃癌的高发国家,每年的胃癌新发病例约占全球新发病例的43%,远高于平均水平[1]。胃癌对人类的身心健康、生命安全威胁较大,研究指出早期胃癌患者的5年生存率可达到90%,而中晚期胃癌的5年生存率却低于40%。由此可见,提高胃癌的早期诊断率,对于降低胃癌病死率具有重要意义[2]。但是我国早期胃癌的诊断仅能达到10%,远低于发达国家。目前,临床对于胃癌的确诊仍主要依靠组织病理学检查和胃镜检查,但其均为侵入性检查,且检查费用较高,患者依从性较差,故难以作为胃癌的普查手段。有研究显示,血清胃泌素17(G-17)、胃蛋白酶原(PG)和幽门螺杆菌(Hp)感染均与胃癌的发生有着密切联系,三者联合检测可较为全面地反映胃黏膜形态、功能变化及病变程度[3]。本院在胃癌筛查中联合应用G-17、PG和13C呼气试验取得了较为满意的成效,现将其应用情况报道如下。
1 资料与方法
1.1一般资料 选取本院2017年2月至2019年2月接诊的1 246例参与胃癌筛查的健康体检者作为研究对象,其中男660例,女586例;年龄40~76岁,平均(58.63±10.72)岁。纳入标准:年龄≥40岁;自愿接受胃癌筛查;对本研究知情同意并签署了知情同意书。排除标准:有胃癌手术史;有肾脏疾病史;近期应用过抑酸药物或抗菌药物;存在凝血功能障碍。本研究通过本院医学伦理委员会批准后进行。
1.2方法 胃癌筛查项目包括G-17、PG-Ⅰ、PG-Ⅱ血清学检测及13C呼气试验,对于血清学检测或13C呼气试验结果阳性者,均行无痛胃镜检查或组织病理学检查予以确诊。
1.2.1血清学检测 采血前,要求受试者空腹12 h,采集静脉血3 mL,离心处理(转速3 000 r/min、10 min)后保留血清,置于—20 ℃的冰箱中保存待检。采用荧光免疫层析法进行G-17、PG-Ⅰ、PG-Ⅱ水平检测,并计算PGR(PG-Ⅰ/PG-Ⅱ)值。各项检测均严格按照操作说明书及相关行业标准进行,仪器经过校准且运行良好。
1.2.213C呼气试验 受试者在禁食、禁饮2 h后,或空腹状态下接受13C呼气试验,用以判定Hp感染情况。试剂盒由深圳市中核海德威生物有限公司提供。受试者先向底气袋内吹满气体,再服用1粒含尿素13C的胶囊,然后静坐30 min,再向样气袋内吹满气体,最后对气体进行检测。
1.2.3胃镜及病理检查 受试者空腹状态下进行无痛胃镜检查,检查前,静脉注射0.2 g丙泊酚。胃镜检查若发现可疑病变,则在胃窦部、胃体部及病灶处采集1~2块活检组织,活检组织用37%~40%甲醛固定后送检。根据胃镜检查结果、黏膜染色及形态学特点分为正常组、浅表性胃炎组、萎缩性胃炎组、胃溃疡组、胃癌及癌前病变组,以各部位最严重病变病理诊断作为最终诊断结果。
1.2.4阳性判定标准 阳性界定值:G-17>7 pmol/L或<2 pmol/L为阳性;PG-Ⅰ>240 μg/L或<60 μg/L为阳性;PG-Ⅱ>27 μg/L为阳性;PGR<6为阳性;13C呼气试验检测值≥4判定为Hp阳性。PG-Ⅰ、PGR均为阳性则判定为PG阳性;联合检测中,任意一项为阳性即判定为阳性。

2 结 果
2.1各项目筛查阳性率比较 1 246例健康体检者中,参与G-17、PG、13C呼气试验单项检测及联合检测的人数分别有403、403、385、362例。G-17、PG、13C呼气试验单项检测及联合检测的检出率分别为46.90%、43.92%、48.05%、64.09%。联合检测的阳性率明显高于G-17、PG、13C呼气试验单项检测,差异有统计学意义(χ2=8.719、9.215、7.958,P<0.05)。
2.2胃镜及病理检查结果 142例受试者无痛胃镜或病理检查结果显示,正常42例、浅表性胃炎47例、萎缩性胃炎20例、胃溃疡19例、胃癌及癌前病变14例。
2.3不同胃黏膜病变类型的G-17、PG检测结果比较 胃癌及癌前病变组的G-17水平明显高于正常组、浅表性胃炎组、萎缩性胃炎组、胃溃疡组,而胃癌及癌前病变组的PG-Ⅰ、PGR水平明显低于正常组、浅表性胃炎组、萎缩性胃炎组、胃溃疡组,差异有统计学意义(P<0.05);胃癌及癌前病变组的PG-Ⅱ水平明显高于正常组,而低于胃溃疡组,差异有统计学意义(P<0.05)。见表1。

表1 不同胃黏膜组织病变类型的G-17、PG检测结果比较
2.4G-17、PG、13C呼气试验单项及联合检测在不同胃黏膜病变中的阳性率比较 正常组的G-17、PG、Hp及联合检测阳性率最低,胃癌及癌前病变组的G-17、PG、Hp及联合检测的阳性率最高,且胃癌及癌前病变组的联合检测阳性率高于G-17、PG、Hp单项检测阳性率,差异有统计学学意义(P<0.05)。见表2。
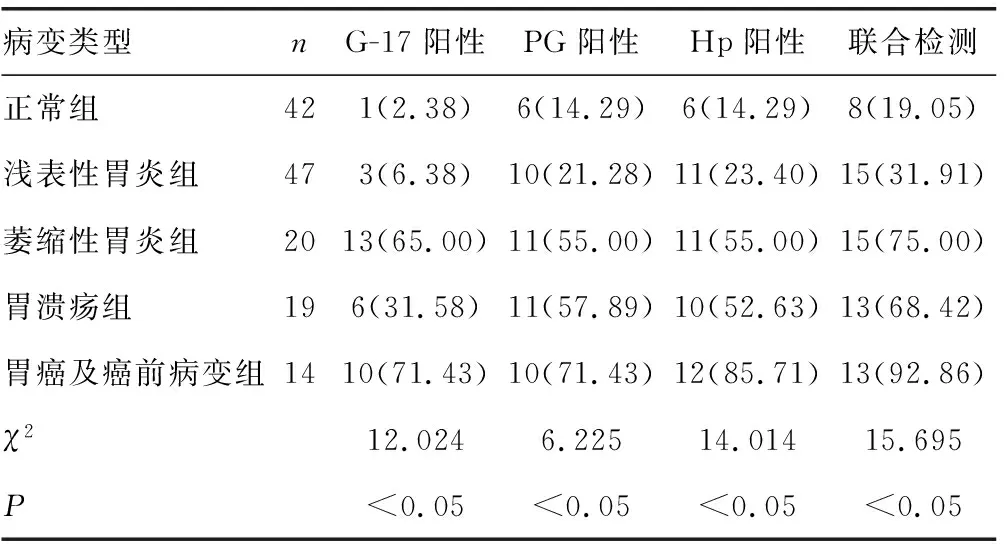
表2 G-17、PG、13C呼气试验单项及联合检测在不同胃黏膜病变中的阳性率比较[n(%)]
2.5G-17、PG、13C呼气试验联合检测诊断胃癌及癌前病变 根据G-17、PG、13C呼气试验结果,将142例接受了无痛胃镜或病理检查的受试者分为3组:A组(G-17、PG、Hp检测结果均为阴性)、B组(G-17、PG、Hp任意一项检测结果为阳性)、C组(G-17、PG、Hp检测结果均为阳性)。比较A、B、C 3组的患癌率,结果发现,B、C两组的患癌率均明显高于A组,差异有统计学意义(P<0.05),C组的患癌率明显高于B组,差异有统计学意义(P<0.05)。见表3。
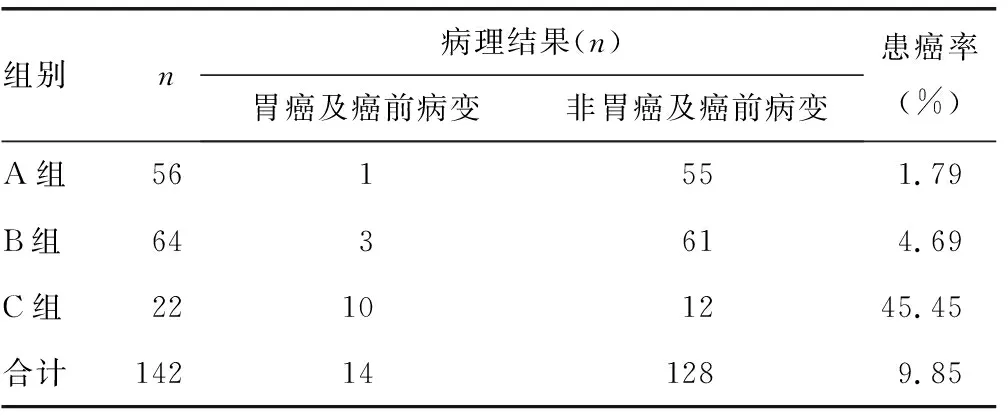
表3 G-17、PG、13C呼气试验联合检测对胃癌及癌前病变检出情况
3 讨 论
胃癌具有起病隐匿的特点,50%以上的胃癌患者在患病初期都无特异性或报警症状出现,多数患者就诊时已出现严重症状,此时多已发展为中晚期,预后效果通常不理想。早期诊断、积极治疗是提高胃癌患者生存质量,延长患者生存时间的唯一有效途径。国外有学者指出,血清G-17、PG和Hp-IgG抗体联合检测能够较好地反映胃黏膜功能、状态,为临床筛查胃癌高风险人群提供可靠依据[4]。
G-17主要是由幽口前庭的胃泌素分泌细胞分泌的多肽物质,能促进正常胃肠道黏膜生长,刺激胃肠胰蛋白酶合成[5]。有研究报道,在胃癌中,G-17可促进癌细胞生长及转移[6-7]。本研究结果显示,胃癌及癌前病变患者的G-17水平及阳性率均明显高于浅表性胃炎、萎缩性胃炎、胃溃疡患者。PG由胃黏膜细胞分泌,可分为Ⅰ、Ⅱ两个亚型,其在酸性条件下可转变为具有活性的胃蛋白酶,而高PG-Ⅱ和低胃蛋白酶原受体是胃癌的独立危险因素[8-9],其中PGR为PG两亚型的比值。本研究中,胃癌及癌前病变组的PG-Ⅰ、PGR水平明显低于浅表性胃炎组、萎缩性胃炎组及胃溃疡组,而胃癌及癌前病变组的PG-Ⅱ水平明显高于正常组,差异有统计学意义(P<0.05)。目前,临床研究已证实Hp是活动性胃炎、消化性溃疡、胃黏膜相关淋巴瘤及胃癌的致病因素[10],并且Hp感染还会影响PG的合成、分泌[11]。本研究显示,胃癌及癌前病变组的Hp检出率明显高于其他胃黏膜病变类型组,差异有统计学意义(P<0.05)。
基于G-17、PG、Hp在胃癌及癌前病变中起着重要作用,为提高胃癌及癌前病变的检出率,降低漏诊率,本研究进一步展开研究发现,G-17、PG、13C呼气试验联合检测对胃癌及癌前病变组的检出率明显高于G-17、PG、13C呼气试验单项检测,并且联合检测出的患癌率也明显高于G-17、PG、13C呼气试验单项检测。出现以上结果可能存在多种原因,其中包括部分萎缩性胃炎患者由于其胃黏膜结构和功能发生改变,分泌功能降低,从而造成了PG、G-17水平的异常,故被联合检测诊断为异常[12-13]。虽然胃癌及癌前病变患者尚未发展为胃癌,但其是发生胃癌的高危人群,有必要定期进行胃镜检查,以监测病情变化。作为胃癌的广谱筛查手段,笔者认为应当最大限度地筛查出胃癌及高危人群,故G-17、PG、Hp联合检测以任意一项为阳性作为阳性判定标准可用于胃癌筛查,当三者均阳性时,尤其应该提高警惕。
血清G-17、PG-Ⅰ、PG-Ⅱ联合13C呼气试验有助于发现胃黏膜病变,提高胃癌及癌前病变的检出率,再加上其具有操作简单、无创、可重复性好等优点,可作为胃癌高危人群筛查的理想手段。

