ALDH2基因rs671单核苷酸多态性位点发生(A→G)RNA编辑*
夏万松,夏 英,2,韦四喜,周春欢,杜 洪,袁 婷,金 泳,黄 海△
(1.贵州医科大学医学检验学院,贵州贵阳 550004;2.贵州中医药大学第一附属医院检验科,贵州贵阳 550001;3.贵州医科大学附属医院临床检验中心,贵州贵阳 550004;4.贵航贵阳医院检验科,贵州贵阳 550009)
乙醛脱氢酶2(ALDH2)rs671单核苷酸多态性(SNP)被鉴定为活性纯合ALDH2 rs671(GG)、非活性杂合ALDH2 rs671(GA)、非活性纯合ALDH2 rs671(AA)[1]。ALDH2 rs671SNP存在于世界近十分之一人口中,是人类最常见的变异,约5.4亿人携带ALDH2 rs671SNP[2]。携带ALDH2 rs671SNP的个体饮酒后会出现酒精代谢障碍的表现,如面部潮红和心率增加[3-4]。重要的是ALDH2 rs671SNP除了会引起酒精反应外,还能影响某些药物的代谢,危及携带者的健康。ALDH2 rs671SNP可增加胃癌、食管癌、上呼吸道鳞状细胞癌的患病风险[5-9]。此外,ALDH2 rs671SNP与多种非癌症疾病相关,是心肌梗死[10-11]、非酒精性脂肪肝病(NAFLD)的危险因素[12]。ALDH2 rs671SNP也可以明显增加髋部骨折风险[13]。然而,目前的研究较为局限,仅在DNA水平研究个体的ALDH2 rs671SNP与疾病的相关性,关于携带ALDH2 rs671SNP的个体ALDH2基因在信使RNA(mRNA)水平的改变研究尚比较少见。因此,本研究探讨了ALDH2 rs671SNP的个体ALDH2基因在mRNA水平的改变,为进一步揭示ALDH2 rs671SNP影响人类健康的机制提供基础。
1 资料与方法
1.1一般资料 将贵州医科大学附属医院体检中心的48例体检者作为研究对象,收集所有研究对象外周抗凝全血标本,其中男24例,女24例;年龄20~40岁。本研究经贵州医科大学附属医院医学伦理委员会批准。
1.2仪器与试剂 红细胞裂解液购于北京索莱宝科技有限公司,DNA及总RNA提取试剂盒、TRIZOL reagent、DNA纯化试剂盒购于生工生物工程(上海)股份有限公司,实验所需引物合成及聚合酶链反应(PCR)产物测序也由生工生物工程(上海)股份有限公司完成,反转录试剂盒购于TaKaRa公司,Taq DNA聚合酶购于美国Vazyme Biotech公司。ABI Pro FlexTM梯度PCR扩增仪购于赛默飞世尔科技(中国)有限公司,琼脂糖水平电泳仪购自北京六一仪器厂,GeneGnome凝胶成像分析仪购自伯乐生命医学产品(上海)有限公司。
1.3方法
1.3.1位置特异性引物设计 于美国国家生物技术信息中心(NCBI)数据库下载ALDH2基因的基本信息。设计上游引物671-F3734(位于内含子11)和下游引物671-R165(位于内含子12)可特异性扩增含ALDH2 rs671SNP位点的片段。设计上游引物F1455(位于外显子11)和下游引物R1740(位于外显子13)可特异性扩增含ALDH2 rs671SNP位点对应的互补脱氧核糖核酸(cDNA)的片段。所有引物序列如下,671-F3734:5′-GTCCTGGGAGTGTAACCCAT-3′;671-R165:5′-CCCAGCAGGTCCTGAACTTC-3′;F1455:5′-GGACAAGGCCAATTACCTGT-3′;R1740:5′-ATTCAGCACGCAAGGATCAT-3′。
1.3.2DNA及总RNA提取、总RNA反转录为cDNA 根据红细胞裂解液产品说明书裂解人外周抗凝全血红细胞,分别用于提取DNA和总RNA。根据DNA和总RNA提取试剂盒说明书提取人外周抗凝全血白细胞 DNA和总RNA。取5 μg总RNA按照反转录试剂盒说明书进行反转录获得第一链RNA反转录cDNA。
1.3.3PCR扩增及测序 为了扩增位于外显子12的ALDH2 rs671SNP位点,以上游引物671-F3734和下游引物671-R165进行PCR扩增可鉴定受试者的ALDH2 rs671SNP;以上游引物F1455和下游引物R1740进行PCR扩增可鉴定ALDH2 rs671SNP位点对应的cDNA序列。引物示意图见图1A。PCR体系(25 μL):2×Green Taq Mix 12.5 μL,上下游引物各1.0 μL,模板1.0 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环后72 ℃延伸4 min。PCR产物经浓度为1.5%的琼脂糖凝胶进行电泳分离,根据DNA纯化试剂盒说明书回收目的片段后进行测序。以DNA为模板的PCR产物用上游引物671-F3734进行测序,以cDNA为模板的PCR产物用上游引物F1455进行测序。
2 结 果
2.1PCR扩增白细胞的DNA和cDNA 用上游引物671-F3734和下游引物671-R165对白细胞的DNA进行PCR扩增的部分结果见图1B。用上游引物F1455和下游引物R1740对白细胞的cDNA进行PCR扩增的部分结果见图1C。

注:A为ALDH2 mRNA及引物示意图,仅展示ALDH2变异体1(Variant,V1)的3′端的3个外显子,▭代表外显子(E),▭下方的数字表示外显子碱基对(bp)的长度,▼指示ALDH2 rs671SNP位点,→的位置表示引物的位置;B为PCR扩增白细胞的DNA琼脂糖凝胶电泳部分结果;C为PCR扩增白细胞的cDNA琼脂糖凝胶电泳部分结果。图1 来自白细胞的DNA和cDNA PCR扩增产物电泳图
2.2PCR产物测序的结果 用上游引物671-F3734和下游引物671-R165对白细胞的DNA进行PCR扩增,PCR产物纯化后用上游引物671-F3734进行Sanger测序的结果见图2A,通过测序结果可鉴定受试者的ALDH2 rs671SNP。用上游引物F1455和下游引物R1740进行PCR扩增白细胞的cDNA,PCR产物纯化后以上游引物F1455进行Sanger测序的结果见图2B。在图2A和图2B中,当DNA在ALDH2 rs671SNP位点表现为杂合“GA”或纯合“AA”时,cDNA在对应的位点表现为鸟苷(G),显示出DNA与cDNA测序结果不符的情况。
2.3ALDH2 rs671(GG、GA、AA)3种基因型的基因频率和cDNA的表现型 48例受试者ALDH2 rs671(GG、GA、AA)3种基因型的基因频率见图3A。在所研究的人群中,基因型为ALDH2 rs671(GG)的基因频率最高,基因型为ALDH2 rs671(AA)的基因频率最低(仅发现1例)。对48例受试者ALDH2 rs671SNP位点对应的cDNA的核苷酸序列进行计算,cDNA均表现为“G”,结果见图3B。
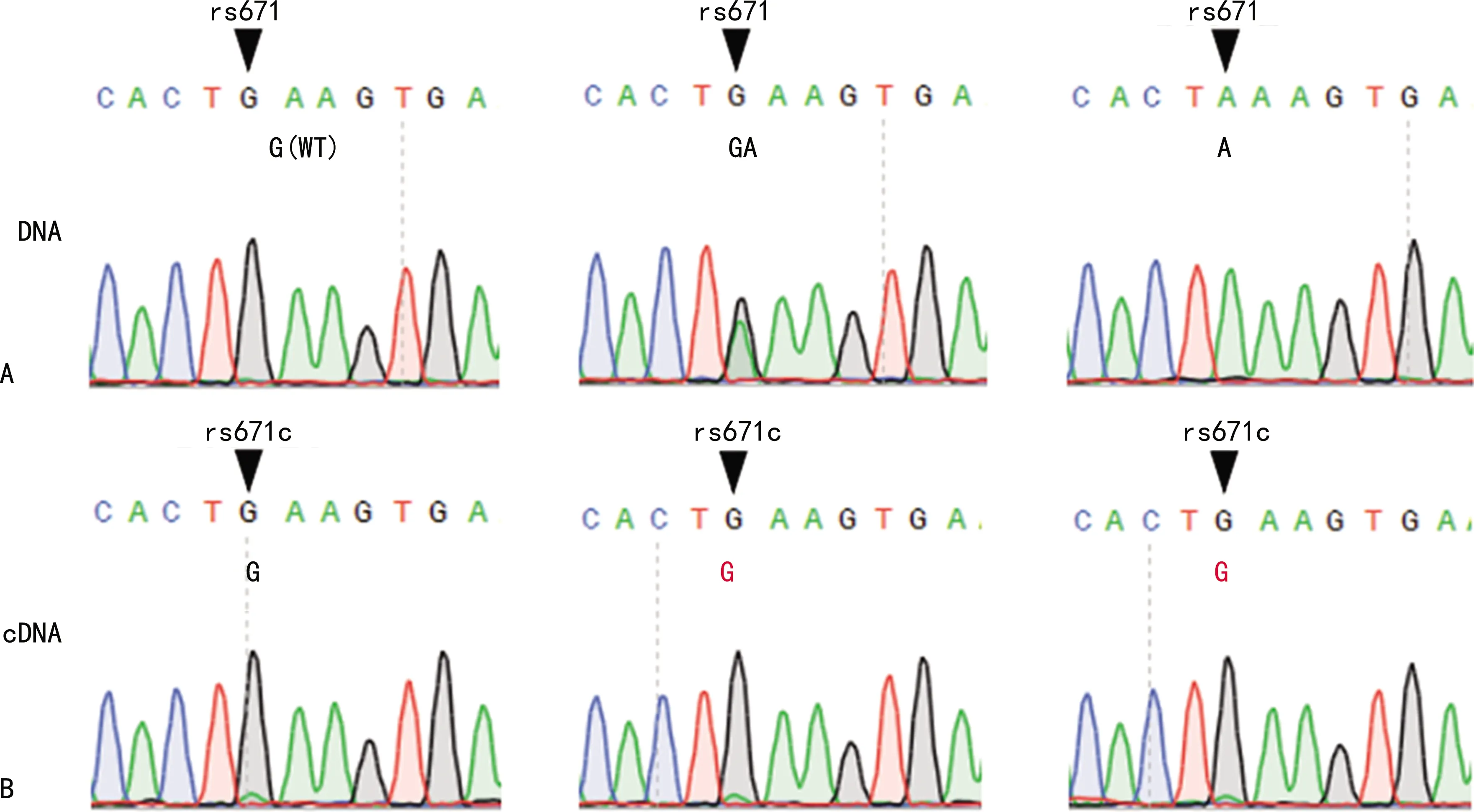
注:A为以白细胞的DNA进行PCR扩增后测序的结果,▼指示ALDH2 rs671SNP位点;B为以白细胞的cDNA进行PCR扩增后测序的结果,▼指示ALDH2 rs671SNP位点对应的cDNA的位点。图2 配对DNA与cDNA的测序结果
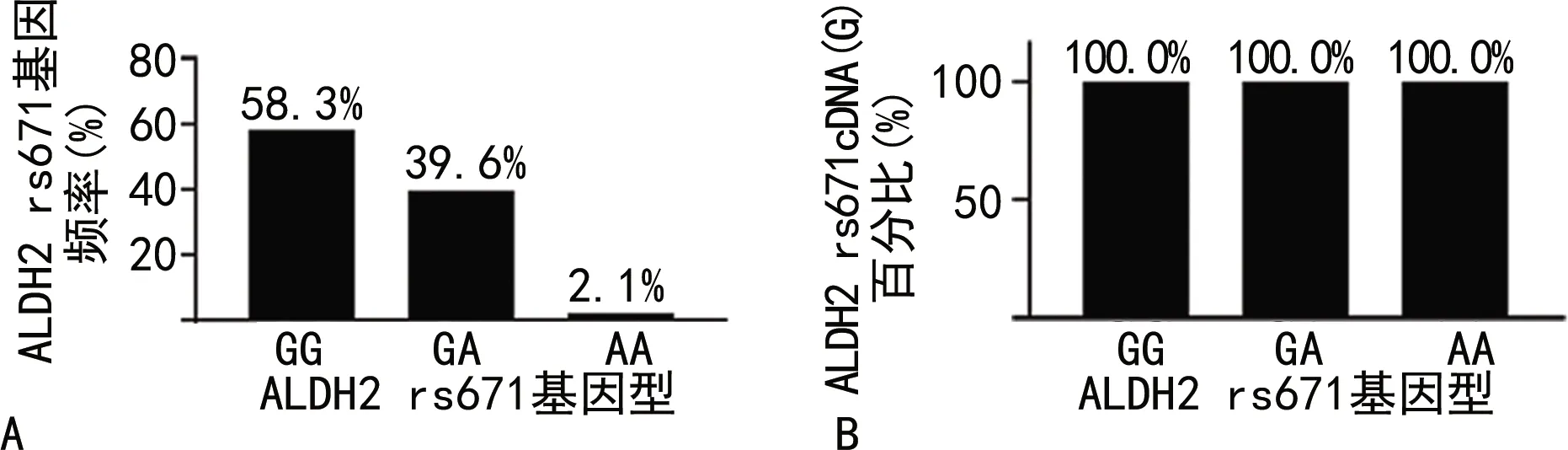
注:A为ALDH2 rs671(GG、GA、AA)3种基因型的基因频率;B为ALDH2 rs671(GG、GA、AA)3种基因型的cDNA表现型。图3 ALDH2 rs671(GG、GA、AA)的基因频率和cDNA的表现型
3 讨 论
ALDH2蛋白质是以四聚体的形式在体内发挥催化功能,基因型为杂合ALDH2 rs671(GA)的个体,主要是ALDH2蛋白质第504位谷氨酸→赖氨酸(504E→504K)的改变[14-15]。然而,这种改变会导致ALDH2蛋白质四聚体的稳定性下降,从而降低ALDH2蛋白质对乙醛的催化活性[16-17]。本研究的受试者中,基因型表现为杂合ALDH2 rs671(GA)的19例受试者,ALDH2 rs671SNP位点对应的cDNA都表现为“G”,并未检测到腺苷(A)(图2B),理论上ALDH2 mRNA翻译出的蛋白质并不会出现ALDH2(504E→504K)的改变。矛盾的是,LAI等[18]报道基因型为杂合ALDH2 rs671(GA)的个体ALDH2蛋白质催化活性不到正常活性的1/2。因此,推测基因型表现为杂合ALDH2 rs671(GA)的受试者,ALDH2蛋白质催化活性明显降低并不完全是因为ALDH2(504E→504K)的改变。一种原因可能是仅ALDH2的等位基因(G)被转录,等位基因(A)不被转录,ALDH2 mRNA的量相对减少,造成ALDH2蛋白质的量相对不足,导致机体对乙醛的代谢活性出现异常。尽管未检测这些受试者ALDH2蛋白质对乙醛的催化活性。对于基因型表现为杂合ALDH2 rs671(GA)的受试者,也许机体认为等位基因(A)对于机体是“不利的”,因此,不转录等位基因(A),而仅转录等位基因(G)。
RNA编辑被定义为一种协同/转录后修饰机制,通过在RNA水平上插入、删除或替换核苷酸,导致RNA序列与其模板DNA之间的差异来改变序列信息;这种修饰可以发生在编码区,从而重新编码氨基酸,具有典型的矫正功能;在哺乳动物中,由作用于RNA的腺苷脱氨酶(ADAR)催化的腺苷→肌苷(A→I)编辑是最常见的RNA编辑类型[19-20]。这种类型的RNA编辑在DNA水平表现为“A”,而对应的cDNA却表现为“G”,DNA与cDNA测序时出现A→G不符的情况[21-22]。在进行蛋白质翻译时,由于I通常被识别为G,因此A→I编辑也称为A→G编辑[23]。本研究中的48例受试者中基因型表现为罕见的纯合ALDH2 rs671(AA)的受试者,ALDH2 rs671SNP位点对应的cDNA也表现为“G”(图2B),DNA与cDNA测序出现A→G不匹配。因此,推测基因型表现为罕见的纯合ALDH2 rs671(AA)的个体ALDH2 mRNA发生了(A→G)RNA编辑。有研究表明,基因型表现为纯合ALDH2 rs671(AA)时,ALDH2蛋白质的催化活性仅为正常活性的1%~5%[24]。然而,通过RNA编辑这种转录后的修饰机制,可以使原本DNA水平上异常的纯合ALDH2 rs671(AA)在RNA水平矫正为正常的“G”,这是RNA编辑典型的矫正功能,在进化上也是一种非常好的现象。
4 结 论
48例受试者中,19例基因型表现为杂合ALDH2 rs671(GA)的个体,ALDH2 rs671SNP位点对应的cDNA都表现为“G”,基因型表现为罕见的纯合ALDH2 rs671(AA)的个体,ALDH2 mRNA发生(A→G)RNA编辑,这些结果为ALDH2 rs671SNP如何影响人类健康的机制提供了新的见解。

