SAHA靶定组织蛋白酶V诱导乳腺癌MDA-MB-231细胞自噬
周 慧,韩 翰, 周伟强
(沈阳医学院 1. 组织学与胚胎学教研室、2. 生物化学与分子生物学教研室、3. 病原生物学教研室,辽宁 沈阳 110034)
癌症已经严重威胁全世界人类生存和社会发展,据世界卫生组织国际癌症研究所发布的最新报告显示,乳腺癌是全球女性最常见的癌症,其发病率在女性癌症中位居首位。2018年,全球约有209万乳腺癌病例和62.7万因乳腺癌而死亡病例[1]。三阴乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌中一类高度异质性的疾病,因无特异性治疗靶点,故其主要治疗手段仍是化疗[2],但是,化疗药物在临床上存在药物种类少、副作用大、耐药性强等缺点[3-4],因此亟待进一步探索更有效的治疗药物。
辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)作为第二代组蛋白去乙酰化酶抑制剂,通过抑制组蛋白去乙酰化酶活性,诱导组蛋白过乙酰化,从而改变染色质的结构和基因转录,参与细胞分化、调亡、自噬和坏死等一系列生物学效应[5]。
组织蛋白酶V (cathepsin V,CTSV )是一种溶酶体蛋白水解酶,属于半胱胺酸蛋白酶体系,是11种人半胱氨酸组织蛋白酶(B、C、F、H、L、K、O、S、V、W、X/Z)中的一员[6]。有研究证明[7-8],组织蛋白酶家族蛋白在SAHA诱导的自噬中起到重要作用,而作为组织蛋白酶家族主要成员的CTSV在自噬过程中是否也起到相关作用还未有报导。本文将SAHA作用于MDA-MB-231细胞,探讨CTSV在SAHA诱导乳腺癌细胞自噬中的作用机制,有着重要的理论和实验意义。
1 材料与方法
1.1 材料人乳腺癌细胞株MDA-MB-231(EGC076)由本实验室冻存;Leibovitz’s L-15培养基(KGM41300)和青链霉素(KGY0023)购自凯基生物公司,胎牛血清(A3160902)购自美国Thermo公司;SAHA(1604-1)购自美国Biovision公司;High Pure RNA Isolation kit试剂盒(1182866500)购自德国Roche Diagnostics公司;Power SYBR Green PCR Master mix(4367659),ECL化学发光试剂盒(B2162617)购自美国Life Technologies公司;抗体购自英国Abcam公司;CTSV小干扰RNA(small interfering RNA,siRNA)(SC-44526-SH)购自美国Santa Cruz公司;其他的化学试剂购自美国Sigma-Aldrich公司和上海生工生物有限公司。
1.2 仪器多功能酶标仪(美国Thermo Scientific);湿式转膜仪、垂直电泳槽(美国 Bio-Rad);凝胶成像系统(上海Tanon);倒置显微镜(日本Olympus);-80 ℃超低温冰箱(美国Thermo Scientific);微量核酸蛋白浓度测定仪(美国Thermo Scientific);荧光定量PCR仪(美国Thermo Scientific);低温离心机(美国Thermo Scientific)。
1.3 方法
1.3.1细胞培养 人乳腺癌MDA-MB-231细胞培养于含10 %胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素的Leibovitz′s L-15培养基中,置于37 ℃,5% CO2培养箱中培养。将MDA-MB-231细胞接种于96孔板(1×107·L-1)和6孔板(5×108·L-1)各孔中,经过无血清培养基同步化处理后,用于下列实验。
1.3.2细胞活力检测 将不同浓度的SAHA(0、0.5、1、2、5、10、20、50 μmol·L-1)与MDA-MB-231细胞共同孵育24 h,经胰酶消化,收集2×105个细胞加入450 μL Count&Viability reagent,室温避光静置后应用Muse细胞分析仪检测细胞活力。
1.3.3CTSV-siRNA转染 取6.6 μL CTSV-siRNA与125 μL无血清培养基混合,室温放置5 min。取3.75 μL Lipofectamine 3000与125 μL无血清培养基混合,室温放置5 min。将上述两者混匀,室温放置5 min。将转染复合物与6孔板中的MDA-MB-231细胞混合,培养24 h后进行后续实验。
1.3.4RNA提取和Real-time PCR 将SAHA与MDA-MB-231细胞共同孵育24 h,按照RNA提取试剂盒说明进行,合成第一链cDNA后应用SYBR Green方法进行Real-time PCR,以GAPDH为内参进行反应,检测mRNA水平。每个样品设3个复孔,数据分析采用2-ΔΔCT方法。ULK1引物序列:Forward为5′-GTAAACTGGGGTCGCATTGT-3′,Reverse为5′-TGGATCCAAGGCTCTAGGTG-3′;ATG3引物序列:Forward为5′-TTTGGCTATGATGAGCAACG-3′,Reverse为5′-GTGGCAGATGAGGGTGATTT-3′; ATG4B引物序列:Forward为5′-GAGCTGCCAAGTCCAGAT TC-3′,Reverse为5′-CCAGGATTTTCAAAGGGACA-3′; ATG4C引物序列:Forward为5′-CCTTGGCTCTTTTT GGCTTA-3′,Reverse为5′-AGGATGCCTTGCTTCTTC AA-3′; ATG5引物序列:Forward为5′-GCAAGCC AGACAGGAAAAAG-3′,Reverse为5′-GACCTTCAG TGGTCCGGTAA-3′; ATG7引物序列:Forward为5′-GAACATGGTGCTGGTTTCCT-3′,Reverse为5′-CAT CCAGGGTACTGGGCTAA-3′;ATG9A引物序列:Forward为5′-GTCAGCTGCGTGGACTATGA-3′,Reverse为5′-GACTTGAGCAGGCAAAAAGG-3′;ATG10引物序列:Forward为5′-GCATTGTAGGGCCAGTTGTT-3′,Reverse为5′-GCTGGCCAGGTAAACTCTTG-3′;ATG12引物序列:Forward为5′-AGGTCTGTAGTC GCGGAGAA-3′,Reverse为5′-GTTCCCGGCTAGT CATTCAA-3′;Beclin 1引物序列:Forward为5′- AGG TTGAGAAAGGCGAGACA-3′,Reverse为5′-GCTTT TGTCCACTGCTCCTC-3′;GAPDH引物序列:Forward为5′- ACAGTCAGCCGCATCTTCTT-3′,Reverse为5′- ACGACCAAATCCGTTGACTC-3′。
1.3.5Western blot检测 将SAHA与MDA-MB-231细胞共同孵育24 h,提取总蛋白,并用BCA法测定蛋白含量。取等量蛋白样品煮沸10 min,经SDS-聚丙酰胺凝胶电泳,转膜,封闭过夜,洗膜,一抗孵育,洗膜,二抗孵育,ECL化学发光法显影。Tanon化学发光成像分析系统检测结果。
1.3.6细胞免疫荧光法 将SAHA与MDA-MB-231细胞共同孵育24 h,用PBS清洗细胞,4 %甲醛室温固定10 min,缓冲液室温封闭2 h。将含有LC3抗体的自噬体检测试剂在4 ℃下与细胞孵育过夜,用荧光共聚焦显微镜对细胞成像并观察自噬信号。
1.3.7自噬通量阻滞试验 将SAHA和不同剂量的Bafilomycin A1(0~40 nmol·L-1)孵育MDA-MB-231细胞24 h。Western blot检测自噬抑制的最佳剂量。然后用CTSV-siRNA转染细胞,在Bafilomycin A1存在下培养。用Western blot法测定自噬通量,检测p62蛋白水平,用Muse细胞分析仪检测细胞活力测定SAHA药理作用。
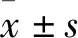
2 结果
2.1 SAHA抑制乳腺癌细胞增殖将不同浓度的SAHA与MDA-MB-231细胞孵育24 h后测定细胞活力。结果显示:不同剂量的SAHA处理后,细胞活力明显下降。尤其是在2 μmol·L-1SAHA处理的MDA-MB-231细胞中,与对照组相比,活细胞比率从96.1 %下降到59.2 %(Fig 1)。结果表明,SAHA能明显抑制MDA-MB-231细胞的增殖。
2.2 SAHA增加乳腺癌细胞CTSV的表达SAHA处理后CTSV的mRNA和蛋白水平明显升高。随着SAHA剂量的增高,CTSV的最高mRNA水平可达到对照组的214.04倍,CTSV的蛋白水平也明显升高。该结果证明,SAHA可以促进乳腺癌细胞中CTSV的基因和蛋白水平高表达(Fig 2)。此外,结合SAHA的毒副作用,我们最终确定了SAHA对MDA-MB-231细胞作用的最佳剂量为2 μmol·L-1。

Fig 1 Muse cell analysis for 24 hours SAHA dose-response effects on breast cancer cells (n=3)
2.3 CTSV-siRNA转染降低乳腺癌细胞中CTSV的基因和蛋白水平用Real-time PCR和Western blot检测CTSV-siRNA转染MDA-MB-231细胞后CTSV的mRNA水平和蛋白表达水平。结果显示:CTSV-siRNA转染乳腺癌细胞后,与对照组相比,CTSV-siRNA组CTSV的基因和蛋白水平均明显降低。另外,SAHA可以明显升高乳腺癌细胞中CTSV的基因和蛋白水平,当SAHA和CTSV-siRNA联合作用后能够恢复由CTSV-siRNA干扰引起的CTSV基因和蛋白水平的降低(Fig 3)。该结果证明,CTSV-siRNA转染可有效降低乳腺癌细胞中CTSV的水平。
2.4 SAHA-CTSV激活乳腺癌细胞自噬标志物LC3的表达用荧光共聚焦显微镜观察了SAHA-CTSV对LC3表达的诱导作用。结果表明,SAHA强烈触发细胞自噬,随着SAHA的诱导,标记LC3分子的荧光块分布在细胞质的大部分区域;而CTSV-siRNA转染后,细胞荧光亮度降低,呈散簇状,仅位于细胞膜周围。最后,当SAHA作用于CTSV敲除细胞时,荧光的分布比未经SAHA处理的细胞更为有限,仅在细胞膜周围扩散,但荧光的分布和亮度仍强于未经SAHA处理的细胞(Fig 4)。该结果表明,SAHA-CTSV促使MDA-MB-231细胞发生自噬。
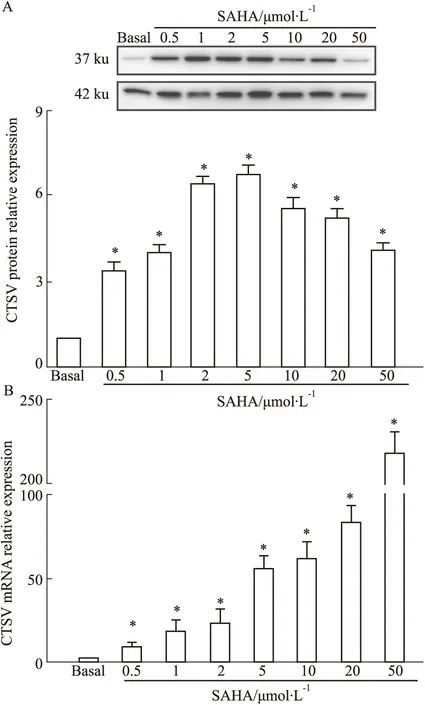
Fig 2 Assays for CTSV expressions induced by different doses of SAHA for 24 hours treatment n=3)A: Western blot assay for MDA-MB-231 cells; B: Real-time PCR assay for MDA-MB-231 cells. *P<0.05 vs Basal.

Fig 3 Effect of SAHA on breast cancer cells accompanied by increase of CTSV function n=3)A: Western blot assay for MDA-MB-231 cells; B: Real-time PCR assay for MDA-MB-231 cells. (CVi: CTSV siRNA). *P<0.05 vs Basal, #P<0.05 vs SAHA.
2.5 SAHA-CTSV诱导自噬相关ATGs分子和LC3的变化为了进一步探讨SAHA-CTSV诱导乳腺癌发生自噬的机制,我们采用Real-time PCR和Western blot检测SAHA-CTSV介导的自噬过程中相关ATG和LC3的改变。结果显示,在MDA-MB-231细胞中,SAHA单独处理可促进ULK1(ATG1)、ATG4B、ATG4C、ATG5、ATG7、ATG9A、ATG10和Beclin1的mRNA表达。然而,当SAHA被特异性siRNA敲除CTSV功能的细胞处理时,ULK1、ATG4B、ATG10和Beclin1的活性被强烈抑制(Fig 5)。对于蛋白的分析,SAHA增多了MDA-MB-231细胞Beclin1的表达量,并伴有LC3B升高和mTOR降低。CTSV-siRNA的加入逆转了SAHA效应(Fig 6)。该结果表明,CTSV在SAHA诱导的MDA-MB-231细胞自噬过程中起到重要作用。
Fig 4 Fluorescence microscopy for SAHA-CTSV induced autophagy (n=3) (CVi: CTSV siRNA).

Fig 5 The mRNA expressions of autophagy-related ATGs induced by SAHA-CTSV in breast cancer cells n=3)*P<0.05 vs Basal, #P<0.05 vs SAHA (CVi: CTSV siRNA).

Fig 6 Effect of SAHA-CTSV on protein expressions of ATGs and LC3, Western blot assay for MDA-MB-231 cells (n=3)(CVi: CTSV siRNA).
2.6 Bafilomycin A1阻断SAHA-CTSV自噬通量时不能发挥抗肿瘤作用为验证SAHA-CTSV对乳腺癌细胞自噬的诱导作用,通过Bafilomycin A1阻断自噬的传递。首先,筛选了不同剂量的Bafilomycin A1对SAHA诱导的MDA-MB-231细胞自噬的抑制作用。使用不同剂量的Bafilomycin A1(0、5、10、20、40 nmol·L-1)与SAHA处理的MDA-MB-231细胞孵育24 h。通过Western blot分析,可以看到,在5 nmol·L-1Bafilomycin A1或高于该剂量的情况下,p62蛋白的表达与单用SAHA相比明显增加。接下来,将5 nmol·L-1Bafilomycin A1和SAHA与经CTSV-siRNA转染的MDA-MB-231细胞共培养24 h。发现如果自噬被阻断,SAHA不能通过CTSV发挥抗肿瘤的药理作用。Muse细胞分析仪测定细胞活力结果也证实,在Bafilomycin A1的作用下,乳腺癌细胞虽然与SAHA共培养,但与SAHA单独培养相比,活细胞数量增加。此外,CTSV基因敲除进一步削弱了SAHA对细胞的影响(Fig 7)。该结果表明,SAHA诱导的MDA-MB-231细胞自噬过程中,CTSV起到重要作用。

Fig 7 The anti-tumor effect of SAHA-CTSV in environment that autophagic flux was blocked by Bafilomycin A1 n=3)*P<0.05 vs Basal, #P<0.05 vs SAHA (CVi: CTSV siRNA, BA1: Bafilomycin A1).
3 讨论
自噬是一种保护细胞存活的机制,细胞需要适当的自噬调节[9]。研究表明,自噬在癌症的发展和治疗中也起着“双刃剑”的作用[10]。一方面,自噬可以为癌细胞提供足够的营养,另一方面,当长期和过量的药物作用于细胞时,自噬可以导致不可逆转的死亡过程[11]。
研究证实,SAHA对乳腺癌细胞的增殖、细胞活力、凋亡和细胞周期进程有明显影响[12]。进一步的研究发现,SAHA也可能与其他形式的细胞死亡有关,包括自噬性细胞死亡[13]。Fig 6表明,SAHA能明显促进MDA-MB-231细胞LC3的表达,说明自噬与 SAHA诱导的细胞死亡有关。同时,我们还发现SAHA处理乳腺癌细胞时,CTSV基因和蛋白的表达增加过多。当我们使用CTSV特异性siRNA敲除CTSV mRNA功能时,SAHA诱导的LC3表达明显受到抑制,细胞死亡过程也受到抑制。该结果提示CTSV在SAHA诱导的乳腺癌细胞自噬中起关键作用。由于CTSV是组织蛋白酶家族成员,是溶酶体酶复合物的重要组成部分,而溶酶体是自噬溶酶体的重要组成部分,推测SAHA通过CTSV调节细胞死亡过程。
为进一步揭示SAHA诱导自噬发生发展的潜在机制,我们检测自噬相关基因和蛋白的表达。我们发现,在SAHA的作用下,ATG4和Beclin1在乳腺癌细胞中的表达明显改变,LC3B蛋白含量的增加伴随着mTOR表达的降低。最后,我们用Bafilomycin A1阻断自噬通量,并测定p62表达的变化,以阐明SAHA-CTSV轴在乳腺癌细胞中的作用。随着Bafilomycin A1的加入,SAHA和CTSV-siRNA联合转染的细胞活力均明显增加。提示SAHA-CTSV轴通过对乳腺癌细胞的自噬作用发挥抗肿瘤作用。
综上阐明了SAHA诱导的乳腺癌细胞自噬是由CTSV介导的。SAHA通过CTSV激活自噬标记分子ATG和Beclin1,诱导LC3表达异常增加。通过mTOR转导,SAHA最终促进自噬溶酶体的合成并引发细胞死亡。我们的研究结果为进一步探索自噬的分子机制,特别是细胞死亡如何应对抗乳腺癌药物过度自噬,以及其他代谢和信号过程如何协调这一过程奠定了实验基础。

