徐长卿丹皮酚对骨癌痛大鼠镇痛作用的研究
赫锦锦,方 东
(1. 河南大学第一附属医院药学部,河南 开封 475000;2. 河南大学药学院药理学教研室,河南 开封 475004)
原发性骨肿瘤或其他部位肿瘤(乳腺癌、前列腺癌、肺癌)的骨转移都会导致骨癌痛的发生,严重影响病人的生活质量[1]。临床上用于骨癌痛的药物主要是阿片类药物,然而这类药物具有耐受性和成瘾性,因此临床上亟需开发镇痛效果好、成瘾性低的镇痛药物[2-3]。
萝藦科植物徐长卿的干燥根、根茎及带根全草可用于风湿痹痛、腰痛、跌打损伤痛等痛证的治疗,疗效明显[4-5]。大量研究表明,徐长卿最主要的药理成分是丹皮酚[6-7],然而,徐长卿丹皮酚(Paeonol of Cynanchum paniculatumhas, Paeonol)是否具有抗骨癌痛的作用还不清楚,因而本研究采用乳腺癌诱发的骨癌痛大鼠模型评价徐长卿丹皮酚抗骨癌痛的作用,并探讨其作用机制。
1 材料与方法
1.1 药品与试剂徐长卿丹皮酚(货号:H111081)购于阿拉丁公司(上海,中国),兔源TRPV1多克隆抗体(货号:ab6166),小鼠源transferrin receptor单克隆抗体(货号:ab1086)购于英国Abcam公司,小鼠源β-actin单克隆抗体(货号:TA-09)购于中杉金桥(北京,中国);辣根过氧化物酶标记的山羊抗兔IgG(货号:sc-2054),辣根过氧化物酶标记的山羊抗小鼠IgG(货号:sc-2973)购于Santa Cruz公司(MN, USA)。
1.2 实验动物健康雌性Sprague-Dawley大鼠购于北京维通利华实验动物技术有限公司。大鼠初始体质量为(160~180) g,分笼饲养于SPF级动物房中,动物房室温控制在(23±2) ℃,相对湿度控制在70%±10%,大鼠自由饮水和饮食。
1.3 骨癌痛大鼠模型的建立将复苏后的大鼠乳腺癌MRMT-1细胞培养在含有10%胎牛血清的RPMI 1640培养基中,当细胞处于对数生长期时进行传代培养,收集传代2次后的细胞用于骨癌痛模型的建立。用PBS缓冲液将收集的MRMT-1细胞稀释成1×1010个·L-1的细胞悬液,用微量进样器将4 μL上述细胞悬液(4×104个)接种于大鼠左后肢胫骨骨髓腔内,建立骨癌痛大鼠模型,对照组大鼠给予等量的PBS溶液。
1.4 机械痛阈值的测定按照Chaplan等[8]报道的“up and down”方法,测定大鼠左后肢的机械痛阈(paw withdrawal threshold,PWT)。首先将大鼠放置在用于测定机械痛的有机玻璃笼中,并保持室内安静以防大鼠出现躁动。当大鼠安静后,用一系列标准化的von Frey hair刺激大鼠左后肢足垫中部,每次刺激持续时间约5 s,观察大鼠是否出现缩足反应,不同刺激之间相隔5 min以上,以消除上一次刺激对大鼠的影响,根据“up and down”方法计算50%缩足阈值。
1.5 热辐射痛阈值的测定将大鼠置于有机玻璃套筒(18 cm × 6 cm × 6 cm) 内,使其适应30 min,待大鼠安静后开始测试。将热辐射光源对准大鼠左侧足垫正下方,开启光源并计时,出现抬足现象为阳性反应,大鼠出现阳性反应后立即关闭热辐射光源,记录该次大鼠的抬足潜伏期(paw withdraw latency,PWL)。为了保证测试结果的准确性,每只大鼠左后肢至少重复测量3次,每次测试间隔5 min以上,最后取3次PWL的平均值记为大鼠的热辐射痛阈。
1.6 大鼠DRG中蛋白的提取及Western blot实验总蛋白的提取:大鼠断头处死后,迅速取出左侧L4,L5的背根神经节(dorsal root ganglion,DRG)置于1.5 mL EP管中,加入100 μL RIPA裂解液,以25%的强度超声破碎DRG至无组织块出现,将其放置在冰上继续裂解30 min,然后12 000 r·min-1离心10 min,取上清,采用BCA法进行蛋白定量,取40 μg总蛋白进行Western blot 实验。
膜蛋白的提取:取大鼠L4,L5 DRG置于玻璃研磨器中,加入800 μL膜成分提取液(0.3 mol·L-1Sucrose,10 mmol·L-1Tris,2 mmol·L-1EDTA,1 mmol·L-1PMSF,1 mmol·L-1DTT,10 mg·L-1Leupeptin),按照Black等[9]的方法进行超高速离心得到膜成分,之后用含有1% Triton X-100的RIPA裂解液冰上裂解1 h,12 000 r·min-1离心10 min后取上清,定量,取20 μg膜蛋白进行Western blot 实验。
Western blot实验:每组样品取等量的蛋白在10%的SDS-PAGE分离胶中以120 V的电压进行电泳分离2 h。电泳结束后,再通过200 mA的电流转膜2 h,将蛋白转移到PVDF膜上。然后取出PVDF膜置于5%脱脂奶中室温封闭1 h。封闭之后,使用5%脱脂奶分别稀释TRPV1抗体(1:1 000)、β-actin抗体(1 ∶2 000)、transferrin抗体(1 ∶1 000),4 ℃孵育上述抗体过夜。一抗孵育完成后,再在室温下用相应的二抗孵育1 h,采用ECL试剂盒显色,用Quantity One软件分析条带光密度值。
1.7 电生理记录大鼠DRG神经元的兴奋性和TRPV1电流大鼠DRG神经元的急性分离:断头处死大鼠,快速取出左侧L4和L5 的DRG,置于预冷的DMEM培养基中,快速洗涤2次,加入1.5 mL胶原酶,37 ℃消化45 min;然后弃去胶原酶,用DMEM洗涤2次,加入1.5 mL胰酶,继续消化10 min。当胰酶消化结束后,加入含10%胎牛血清的DMEM培养基终止消化,1 000 r·min-1离心5 min,弃去上清,然后加入新鲜的DMEM完全培养基,用抛光后的巴斯德管吹打DRG,使神经元分散至培养基中。最后将分散后的神经元接种在24孔培养板中(24孔板中提前放置有多聚赖氨酸包被过的盖玻片),置于37 ℃、5% CO2的培养箱中继续培养2 h后进行电生理实验。
全细胞膜片钳记录:选取直径小于25 μm的DRG神经元,在电流钳模式下,将神经元钳制于0 pA,记录各组神经元的静息膜电位(resting membrane potential,RMP),此后采用阶梯式给予一系列去极化电流,每次跃迁5 pA,持续100 ms,直至诱发出第一个动作电位,即为动作电位的去极化电流阈值(current threshold,CT),并同时记录动作电位爆发的阈值(threshold of action potential,TP)。然后给予恒定去极化电流(300 pA, 500 ms)刺激DRG神经元,记录相同刺激下每个神经元爆发动作电位的个数。最后在电压钳模式下,将神经元的电压钳制在-70 mV,执行TRPV1受体激动剂辣椒素(Capsaicin,CAP)灌流给药步骤(细胞外液2 s,激动剂3 s,细胞外液20 s),记录TRPV1电流。实验中采用EPC-10膜片钳放大器和Patch master软件来记录和分析DRG神经元的电活动。
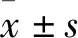
2 结果
2.1 徐长卿丹皮酚对骨癌痛大鼠痛行为的影响大鼠造模后d 14测定大鼠机械痛阈和热痛阈,d 15腹腔注射不同浓度的Paeonol,连续给药3 d后,再次测定大鼠的机械痛阈和热痛阈。实验结果显示,Paeonol能明显提高骨癌痛大鼠的机械痛阈和热辐射痛阈,并且具有剂量依赖性(Fig 1)。
2.2 徐长卿丹皮酚对骨癌痛大鼠DRG神经元兴奋性的影响以往的研究表明,骨癌痛大鼠的DRG神经元兴奋性会明显增强,这也是骨癌痛的外周敏化机制[10]。因此,本研究首先急性分离给药3 d后的骨癌痛大鼠的DRG神经元,然后采用膜片钳技术记录DRG神经元的电生理参数。结果表明,Paeonol(100 mg·kg-1)能明显增加骨癌痛大鼠DRG神经元静息膜电位的绝对值,上调骨癌痛大鼠DRG神经元诱发动作电位的去极化电流阈值、动作电位爆发的阈值(Fig 2)。同样,Paeonol(100 mg·kg-1)也能降低300 pA去极化电流诱发的DRG神经元动作电位发放的频率(Fig 3)。这些结果表明,Paeonol能降低骨癌痛大鼠DRG神经元的兴奋性。

Fig 1 Effects of Paeonol of Cynanchum paniculatum on development of bone cancer pain of ratsNote that Paeonol of Cynanchum paniculatum could increase both the paw withdrawal threshold;(A) paw withdrawal latency (B) in a dose-dependent manner in bone cancer pain rats. n=8).*P<0.05, **P<0.01 vs normal saline group
2.3 徐长卿丹皮酚对骨癌痛大鼠DRG上TRPV1蛋白表达的影响大量研究发现,TRPV1在骨癌痛大鼠DRG神经元上的表达明显上调,并且介导了DRG神经元的兴奋性和骨癌痛的发生[1, 11],因此本研究检测了Paeonol(100 mg·kg-1)对骨癌痛大鼠DRG上TRPV1总蛋白和膜蛋白表达的影响,实验结果显示,连续给药3 d后,Paeonol能够明显抑制骨癌痛大鼠DRG上TRPV1总蛋白和膜蛋白的表达(Fig 4),这提示Paeonol很可能是通过下调TRPV1蛋白的表达进而抑制神经元兴奋性和骨癌痛的发生。

Fig 2 Effects of Paeonol of Cynanchum paniculatum on DRG neurons hyperexcitability in bone cancer pain of ratsA: Representative of the first action potential evoked by depolarizing current pulse recorded from the DRG neurons;B: Paeonol of Cynanchum paniculatum reversed bone cancer-induced the decrease of the absolute values of resting membrane potential(RMP) in bone cancer pain rats; C: Bone cancer-induced the decreased values of current threshold (CT) was reversed by Paeonol of Cynanchum paniculatum; D: Paeonol of Cynanchum paniculatum attenuated the increased absolute values of threshold potential (TP) induced by bone cancer pain. n=25-26)*P<0.05, **P<0.01 vs Normal, #P<0.05, ##P<0.01 vs Normal saline.

Fig 3 Numbers of AP in DRG neurons decreased by Paeonol of Cynanchum paniculatum in bone cancer pain of ratsA: Representative of evoked discharges by a-500 ms, 300 pA depolarizing current pulse; B: Analysis of the evoked AP numbers. Note that the number of the evoked AP was significantly reduced in Paeonol-treated group. n=24-26) **P<0.01 vs Normal, ##P<0.01 vs NS (Normal saline).
2.4 徐长卿丹皮酚对骨癌痛大鼠DRG上TRPV1电流的影响Paeonol对TRPV1功能的影响尚不清楚,因此本研究采用膜片钳技术记录了TRPV1电流的变化。实验结果显示,连续3 d给予Paeonol(100 mg·kg-1)后,骨癌痛大鼠DRG神经元上TRPV1的电流密度也明显降低(Fig 5)。

Fig 5 Effects of Paeonol of Cynanchum paniculatumon TRPV1 currents in DRG neurons in bone cancer pain ratsA: Representative currents evoked by application of capsaicin (0.5 μmol·L-1 for 3 seconds) to DRG neurons in rats; B: Paeonol of Cynanchum paniculatum significantly decreased TRPV1 currents in DRG neurons in bone cancer pain rats. n=20) **P<0.01 vs Normal, ##P<0.01 vs NS (Normal saline), 1-way ANOVA.

Fig 4 Effects of Paeonol of Cynanchum paniculatum on protein expression of TRPV1 in DRGs in bone cancer of rats Note that Paeonol of Cynanchum paniculatum reversed bone cancer-induced the up-regulation of TRPV1 total protein (A) and membrane protein (B) expression. β-actin and TfR (transferrin receptor) was used as an internal control. n=6) **P<0.01 vs Normal, ##P<0.01 vs Normal saline.
3 讨论
徐长卿味辛、性温,无毒,归肝、肾经,临床上常用于各种痛症的治疗,例如徐长卿内服或外用在治疗牙痛、胃痛、腹痛、风湿性关节痛、痛经等方面有良好的止痛效果,但到目前为止还没有文献对徐长卿发挥镇痛作用的成分和作用机制进行报道。本研究中,我们首次证明Paeonol可以通过下调TRPV1的表达进而抑制神经元的兴奋性,从而治疗骨癌痛。
然而,我们并没有探讨Paeonol下调TRPV1表达的机制,有文献报道,丹皮酚具有抗炎、抗氧化的作用[12],特别是在神经系统,丹皮酚可以抑制TNF-α、IL-1β、IL-6等炎症因子的表达[14-15],而TNF-α、IL-6可以通过MEK/ERK、PI3K/AKT等多条信号通路上调TRPV1蛋白的表达和功能的敏化,并且在骨癌痛的发生发展过程中,这些炎症因子的表达也明显上调[11, 15],因此我们推测Paeonol很可能是通过抑制炎症反应,进而抑制TRPV1蛋白表达和功能的敏化。
除了TRPV1受体,在外周DRG神经元上还有很多受体或离子通道参与了骨癌痛的外周敏化,例如Nav1.8通道及KCNQ通道等[16]。在本研究中我们发现使用Paeonol后,DRG神经元膜电位绝对值增大,而TRPV1对细胞膜电位影响并不明显,因此我们推测Paeonol也可能会通过调节Nav1.8通道及KCNQ通道的表达或功能进而发挥抗骨癌痛的作用,当然这些假说还需要实验验证。
——从一道浙江选考生物学试题谈起

