离子液体辅助研究“双丹方”中活性成分量的关系*
唐一梅,扈本荃,张 梦
(西安医学院药学院 药物研究所,陕西 西安 710021)
药对作为复方配伍的最小单位,是解决复方配伍后复杂物质变化的恰当切入点。双丹方由丹参、丹皮两味药组成,两味药功效相须为用,但有关其配伍作用机制还不清楚。
郑晓晖课题组[1-2]研究了双丹方中丹参对丹皮、丹皮对丹参药代动力学的影响。丹参与丹皮配伍后,丹皮中丹皮酚吸收入血加快,作用时间延长,丹皮酚在心、肝、脑、肺、肾中的浓度较丹皮组(单味药)明显升高,结果验证了君药丹参不仅对主证起治疗作用,而且具有引经作用;丹皮与丹参配伍给药后,可明显促进丹参素吸收入血,使其体内作用时间延长,生物利用度提高。上述的药代动力学研究结果表明,丹参与丹皮配伍后,两味药发挥了协同作用。
离子液体(Ionic Liquids,ILs)是由有机阳离子和无机/有机阴离子组成的熔融盐,在室温或较低温度下(一般低于100℃)呈液态[3]。离子液体与常见盐水体系和传统有机溶剂相比较,其具有热稳定性好[4]、蒸气压低[3]、溶解能力强[5-7]、可设计性等优点[8],在有机合成[9-11]、电化学[12-14]、医药科学[15-19]等领域得到了广泛应用,离子液体也可用于分离技术方面[19-22],研究表明,可依据性质需要进行离子液体结构设计,离子液体可作为辅助溶剂,用于物质的分离分析[23-25]。
作者以离子液体作为辅助溶剂,干预双单方中活性成分丹参、丹皮酚的提取量,以单味药提取液作为溶剂提取分析另一味药活性成分提取量的变化,从分子水平上,阐明君药与臣药之间存在相互作用,源于活性成分之间存在的相互作用。
1 实验部分
1.1 原料、试剂与仪器
丹参:产地陕西,牡丹皮药材:产地河南,经西安医学院张彦副教授鉴定,分别粉碎,过筛,孔内径为(250±9.9)μm,待用。
甲基-3-丁基-咪唑溴([BMIM]Br)、1-甲基-3-辛基咪唑溴离子液体([OMIM]Br):自制;六氟磷酸钾(KPF6):CP,萨恩化学技术有限公司;丹参素标准品:纯度≥98%,批号B20254-2,丹皮酚对照品:纯度≥98%,批号Y27F7Y17002,上海源叶生物科技有限公司;乙醇、甲酸:分析纯,国药集团化学试剂有限公司;甲醇:色谱纯,美国Fisher公司。
高效液相色谱仪:G1312B 1260 Infinity二元液相色谱系统,G1329B 1260 Infinity自动进样器,G1316A 1260 Infinity柱温箱,G4212B 1260 Infinity DAD检测器1260,美国Agilent公司;集热式恒温加热磁力搅拌器:DF-101S,郑州长城科工贸有限公司;超声波清洗器:SB-5200DT,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 供试品溶液的制备
1.2.1.1 丹参供试品溶液的制备
称取丹参3.0 g于100 m L圆底烧瓶中,m(溶剂)∶m(药材)=8∶1,回流2次,每次1.5 h,合并滤液(丹参提取液记为DS)挥发至约2 mL,甲醇定容至10 m L容量瓶中,得丹参供试品溶液,记为DS-1(见表1)。称取干燥丹参3.0 g于100 m L圆底烧瓶中,m(溶剂)∶m(药材)=8∶1,V(离子液体)∶V(水)=1∶9;采用离子液体浸泡丹参药材后加水提取、离子液体-水混合浸泡丹参后提取2种方式;2种提取体系分别回流2次,每次1.5 h,合并滤液;离子液体-水混合后提取液,按照n(离子液体)∶n(KPF6)=1∶1加入KPF6,置于水浴加热反应1 h,抽滤,分液;将上层溶液旋蒸浓缩至约10 m L,浓缩液分别加质量分数80%乙醇2次,合并滤液浓缩至约2 mL,甲醇定容至10 mL容量瓶中,得丹参供试品溶液,记为DS-2、DS-3(见表1)。

表1 不同溶剂体系提取丹参素、丹皮酚
1.2.1.2 丹皮供试品溶液的制备
称取丹皮1.5 g于100 m L圆底烧瓶中,m(溶剂)∶m(药材)=10∶1,回流2次,时间分别为10、15 min,合并2次滤液(丹皮提取液记为DP),吸取2 m L滤液定容至10 m L容量瓶中,得丹皮供试品溶液,记为DP-1(见表1)。称取丹皮1.5 g于100 mL圆底烧瓶中,m(溶剂)∶m(药材)=10∶1,V(离子液体)∶V(水)=1∶3;采用离子液体浸泡丹皮后加水提取、离子液体-水混合浸泡丹皮后提取2种方式;2种提取体系分别回流2次,时间分别为10、15 min,合并滤液;离子液体-水混合后提取液,按照n(离子液体)∶n(KPF6)=1∶1加入KPF6,置于水浴加热反应1 h,抽滤,分液,吸取2 m L滤液定容至10 m L容量瓶中,得丹皮供试品溶液,记为DP-2、DP-3(见表1)。
1.2.1.3 丹参-丹皮供试品溶液的制备
分别称取丹参3.0 g(3份)于100 m L圆底烧瓶中,加丹皮提取液,V(DP)∶V(水)=1∶1,m(溶剂)∶m(药材)=8∶1,加热回流2次,每次1.5 h,合并2次滤液,得丹参-丹皮提取溶液,记为DD,浓缩甲醇定容至10 m L,得丹参-丹皮供试品溶液(未醇沉),记为DS-DP-1、DS-DP-2和DSDP-3(见表1);丹参-丹皮提取溶液旋蒸浓缩至约10 m L,醇沉2次,滤液水浴挥发至约2 m L,甲醇定容至10 m L容量瓶中,得丹参-丹皮供试品溶液(醇沉),记为DS-DP-4、DS-DP-5和DS-DP-6(见表1)。
1.2.1.4 丹皮-丹参供试品溶液的制备
称取丹皮1.5 g于100 m L圆底烧瓶中,加入丹参第一次回流提取液,V(DS)∶V(水)=1∶1,m(溶剂)∶m(药材)=10∶1,加热回流2次,时间分别为10、15 min,合并2次滤液,得丹皮-丹参提取溶液,记为DP-DS,精密吸取2 m L滤液定容至10 m L容量瓶中,得丹皮-丹参供试品溶液,记为DP-DS-1、DP-DS-2和DP-DS-3(见表1);称取丹皮1.5 g于100 m L圆底烧瓶中,加入丹参第二次回流提取液,同上步骤,得丹皮-丹参供试品溶液,记为DP-DS-4、DP-DS-5和DP-DS-6(见表1)。
1.2.2 对照品溶液的配制
1.2.2.1 丹参素对照品溶液的配制
精密称定丹参素对照品0.005 00 g,甲醇定容于10 m L容量瓶中,得质量浓度为500.00μg/m L的丹参素对照品溶液。
1.2.2.2 丹皮酚对照品溶液的配制
精密称取丹皮酚对照品0.010 12 g,定容于25 m L容量瓶中,得质量浓度为404.80μg/m L的丹皮酚对照品溶液。
1.2.3 色谱条件
1.2.3.1 丹参素色谱条件
色谱柱:Agilent HC-C18(2)(250 mm×4.6 mm,5μm);流动相:V(水)∶V(甲醇)=80∶20;流速0.8 m L/min;柱温:30℃;检测波长:280 nm;进样量:10μL。
1.2.3.2 丹皮酚色谱条件
色谱柱:Agilent HC-C18(2)(250 mm×4.6 mm,5μm);流动相:V(水)∶V(甲醇)=40∶60;流速:0.8 m L/min;柱温:30℃;检测波长:274 nm;进样量:10μL。
1.2.4 标准曲线的绘制
精密吸取1.2.2.1的丹参素对照品溶液4.00、2.00、1.00、0.80、0.40 m L分 别 置 于5 m L容 量 瓶中,甲醇稀释定容,得系列质量浓度的丹参素标准溶液;分别精密吸取10μL进样,记录质量浓度和峰面积A。以峰面积A为纵坐标,ρ(丹参素)为横坐标进行回归计算,得线性回归方程为A=4.092 8ρ+14.686(r=1)。结果表明,ρ(丹参素)=80~500μg/m L具有良好的线性关系。
精密吸取1.2.2.2的丹皮酚对照品溶液0.25、0.50、1.00、1.50、2.00、2.50 m L置10 m L容 量 瓶中,甲醇稀释定容,得系列质量浓度的丹皮酚标准溶液;分别精密吸取10μL,依次进样,记录峰面积A。以峰面积A为纵坐标,ρ(丹皮酚)为横坐标进行回归计算,得线性回归方程为A=35.794ρ+241.31(r=0.998 0)。结果表明,ρ(丹皮酚)=20.44~408.8μg/m L具有良好的线性关系。
1.2.5 含量测定
根据«中国药典»2015版附录«药品质量标准分析方法验证指导原则»要求,采用外标法测定供试品中待测成分的含量,方法学考察符合测定要求,测定结果见图1~图3,以峰面积计算丹参素和丹皮酚的质量分数,见表2。

图1 水溶液、离子液体-水溶液体系中丹参、丹皮单味药供试品溶液色谱图
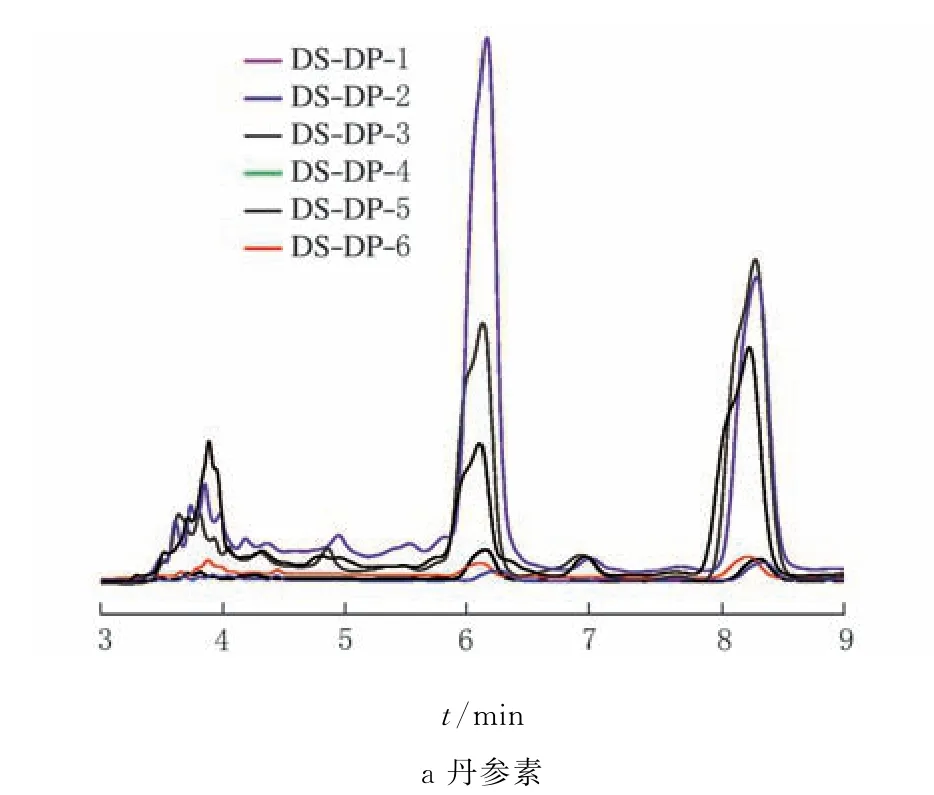

图2 丹参-丹皮供试品溶液色谱图

图3 丹皮-丹参供试品溶液色谱图
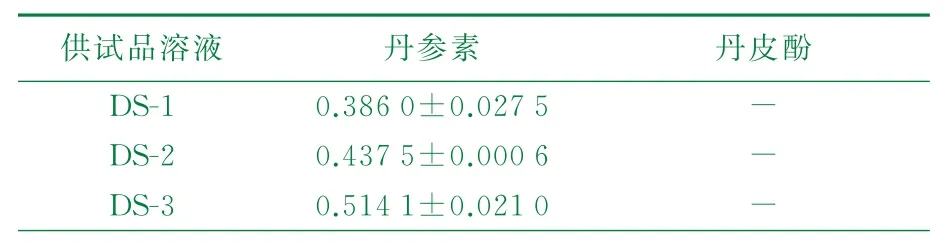
表2 丹参素、丹皮酚含量检测结果(n=5) w/%

续表
2 结果与讨论
2.1 [BMIM]Br离子液体对丹参素提取量的影响
由图1、表2可知,[BMIM]Br-水提取法与传统水提法比较,[BMIM]Br浸泡30 min水提取法与[BMIM]Br-水提取法比较w(丹参素)明显增高,前者w(丹参素)均明显高于后者。由于在[BMIM]+中,咪唑环上活泼氢与丹参素结构中羰基能够产生强的氢键相互作用[26],同时,Br-也能与丹参素分子结构中的羟基形成氢键,因此,[BMIM]Br均利于水溶性成分丹参素从丹参药材中转移至离子液体-水体系中,导致丹参素的提取率提高[27]。
2.2 [OMIM]Br离子液体对丹皮酚提取量的影响
课题组前期已完成丹皮酚活性提取条件的优化,结果表明,离子液体[OMIM]Br能够提高丹皮酚的提取率[28]。由图1、表2可知,[OMIM]Br-水回流提取法与[OMIM]Br浸泡30 min-水回流提取法和传统水回流提法比较,丹皮酚提取量明显降低。[OMIM]Br与丹皮酚之间具有强的相互作用力,提取时间较短,使得丹皮酚不能完全释放。
2.3 丹皮提取液对丹参素提取量的影响
由图2、表2可知,伴随着丹皮提取液中w(丹皮酚)的降低,丹参水溶性成分w(丹参素)均明显降低。原因可能在于丹参素和丹皮酚分子之间存在弱的相互作用。
2.4 丹参提取液对丹皮酚提取量的影响
由图3、表2可知,随着提取液中w(丹参素)的增加,丹皮主要活性成分丹皮酚提取量明显增加。
由图2、图3及表2可知,双单方中丹参活性成分丹参素与丹皮活性成分丹参素提取量之间具有正相关性。原因可能在于丹参素和丹皮酚分子之间存在弱的相互作用,促进了丹皮中丹皮酚的释放,丹皮酚促进了丹参中丹参素的释放。从中医理论的角度讲,双丹方中体现中药“相须”关系,丹参为君药,丹皮为臣药,可起协同作用,能加强药效[1-2],这种协同作用可能源于活性分子之间弱的相互作用力。
2.5 不同提取体系对丹参素与丹皮酚的影响
醇沉过程对丹参素、丹皮酚提取均产生不利影响。丹参-丹皮体系与丹皮-丹参体系,醇沉前丹参素和丹皮酚的提取量均高于醇沉后的提取量。
丹参-丹皮体系与丹皮-丹参体系相比,丹皮酚提取量明显降低。丹皮酚提取量降低可能源于3个方面。丹皮酚加热易于挥发,丹皮提取液加入到丹参-丹皮提取体系中,延长了丹皮酚的挥发时间,导致丹皮酚测定量降低;水提醇沉过程会包覆小分子,导致丹皮酚测定量降低;丹皮酚的水溶性差也可能使丹皮酚在醇沉过程中损失大,导致丹皮酚提取量降低。
随着双丹方中丹皮酚提取量的增高,丹参水溶性成分丹参素的提取量明显增高;随着丹参素提取量的增高,丹皮酚的提取量明显增高。结果表明,丹参中丹参素提取量与丹皮中丹皮酚提取量之间存在正向相关性。由于溶剂与溶质之间存在一定相互作用时,溶质在溶剂中的溶解度会相对较高,因此,药材中活性成分提取量低,与物质体系中化合物之间的相互作用有关,表明丹参素和丹皮酚分子之间可能存在弱的相互作用,即药对配伍之后,两者在分子水平上的物质基础变化密切相关,两者存在相互影响。
3 结 论
离子液体能够溶解纤维素,破除细胞壁,提高传质能力,因此,能够辅助提高中药材活性成分的提取率。在双丹方药对中,活性成分丹参素的提取量与丹皮酚的提取量成正相关性,从化合物相互作用的角度证明了君药和臣药物质之间存在协同作用,源于物质基础体系中活性成分之间可能存在相互作用,进一步印证了双丹方药代动力学结果。

