生长分化因子11对甲醛诱导的海马神经细胞凋亡的影响
职瑾 段斌 吴松笛 王清
甲醛是一种化学分子结构最简单的醛,由于其具有活跃的化学反应性,甲醛常被用于食品包装材料、建筑材料和各类装饰材料 (油漆、涂料、壁纸等)的制造[1-3]。由此可见甲醛从衣食住行各个方面暴露于人类的生产生活中,人类群体中各个年龄段都遭受甲醛毒性的危害[4]。近年来,环境中甲醛的暴露对人类神经行为的影响受到广泛关注,也注意到内源性甲醛的升高与神经退行性疾病如阿尔茨海默症密切相关[5]。本研究将以HT22 细胞为神经细胞模型,从凋亡和脂质氧化物水平这2 个方面探讨甲醛诱导的神经毒性。但目前对于甲醛诱导神经毒性的具体机制报道较少。生长分化因子11 (growth differentiation factor-11,GDF11),来源于转化生长因子 β (transforming growth factor,TGF-β)超家族,被称为 “返老还童蛋白”[6]。GDF11 广泛表达于多种组织器官中,并通过调控细胞增殖、凋亡等参与机体胚胎发育,肌肉功能[7]。GDF11 是否影响甲醛诱导的神经毒性,本文将做进一步的探讨。
材料与方法
一、试剂和仪器
HT22 细胞来源于鼠类海马细胞系 (辽宁清晨生物科技有限公司);GDF11 基因片段的真核表达重组质粒pcDNAs/GDF11 (广州卡芬生物科技有限公司);胎牛血清 (广州达源生物公司);DMEM (广州特普生物公司);冻存液(山东佰业生物科技公司);DCFDA 细胞活性氧 (reactive oxygen species,ROS)检测试剂盒 (山东龙力生物科技有限公司);Bax 抗体,Bcl-2 抗体 (广州赛诚生物公司);GDF11 抗体(南京诺尔曼科技有限公司);caspase3 活性检测试剂盒 (上海碧云天生物技术研究所);Cytoflex 流式细胞仪(美国Beckm Coulter 公司)。
二、方法
(一)HT22 细胞培养和转染
1.HT22 细胞培养:当HT22 细胞生长铺满瓶壁90 %左右时,进行细胞传代。弃掉细胞培养液,然后使用tip 头吸取1 mL 含0.25 %的胰蛋白酶进行消化,在倒置显微镜下观察HT22 细胞轴突回缩时,立即将细胞转移至培养箱中,迅速加入新鲜培养液终止消化,用长tip 头将HT22 细胞从瓶壁上吹打下来(吹打次数一般约为60 次)。制成单细胞悬液后,将细胞悬液分至3 瓶培养瓶中进行接种培养。
2.HT22 细胞转染:HT22 细胞转染操作严格依照Lipofectamine 2000 转染试剂说明书用pcDNAs/GDF11 转染HT22 细胞,构建稳定表达GDF11 基因的HT22 细胞(GDF11 组)。GDF11 基因细胞稳定表达后,用蛋白免疫印迹法检测HT22 细胞株中GDF11 蛋白的表达量,以验证GDF11 转染HT22 细胞的效果。
(二)细胞计数试剂盒 (cell counting kit-8,CCK- 8)法检测HT22 细胞活力
把HT22 细胞分为对照组 (细胞未做任何处理)、甲醛组 (50、100、200 μmol/L 甲醛处理细胞)和GDF11+甲醛组(GDF11 转染细胞后用100 μmol/ L甲醛处理)。100 μmol/L 处理海马细胞,细胞活力值为56.24±0.62,选择此浓度为最适宜浓度,并进行后续实验。CCK-8 试剂盒用来检测细胞的活力。待HT22 细胞处于对数生长期时,用tip 头吸取1 mL 胰酶消化,吹打管将HT22 细胞吹打成单细胞悬液,然后将单细胞悬液以每孔100 μL,密度为0.5×104个/mL 均匀接种在96 孔板中。每个组别设置2 个平行对照,将种好细胞的96 孔板平放于37 ℃,5 % CO2的培养箱中培养。待孔底均匀铺HT22 细胞均为60 %时,根据实验方案要求给予HT22 细胞相应方式处理,再次放回培养箱中继续培养12 h 后,弃掉96 孔板中的培养液,使用预冷PBS洗涤板底2 次,轻轻用吸水滤纸吸出板底残余的液体。避光环境中,每孔快速各加入10 μL CCK-8试剂,将96 孔板放于培养箱中4 h 后,立即使用酶标仪以450 nm 的波长,检测每孔的OD 值。
HT22 细胞活力= (甲醛组或GDF11+甲醛组OD 均值/对照组OD 均值)×100%
(三)HT22 细胞蛋白的提取过程
提前溶解RIPA 裂解液,待其充分溶解后,取适量RIPA 裂解液和苯甲基磺酰氟混合均匀置于冰上备用。取出培养箱中的细胞,弃掉培养液。然后每瓶HT22 细胞加2 ~ 3 mL 预冷的PBS,轻轻摇动60 s 洗涤HT22 细胞瓶壁后,弃去洗涤液。重复以上操作2 次。将瓶倒扣在吸水纸上使吸水纸吸干培养液 (或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。待培养瓶内无残余液体时,加入适量配好的裂解液把培养瓶置于冰上。每瓶HT22 细胞加100 μL 的裂解液,均匀铺满细胞侧,于冰上静置裂解30 min。然后用刮勺将贴壁HT22 细胞轻柔刮下。将刮下的细胞碎片混合物移至1.5 mL 离心管中。4 ℃下以10 000×g离心10 min 后取上清。最后用BCA 蛋白定量试剂盒定量后,分装出每次蛋白的用量,放于-80℃保存,尽量保证在1 个月内使用完,避免蛋白反复冻融。
(四)蛋白免疫印迹法检测Bax、Bcl-2 蛋白表达水平
收集样本并使用BCA 蛋白质定量法评估总数蛋白质浓度。然后将定量的蛋白质用PBS 稀释同样倍数。每个样品的蛋白质提取相同的体积然后使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。采用湿式传递系统将蛋白质转移到PVDF 薄膜上,在室温下,使用5%脱脂牛奶封闭2 h 后,膜分别与对应的一抗Bax (1:1 000),Bcl-2 (1:1 000),4 ℃孵育过夜。第2天,用TBST 清洗膜,每次10 min,洗3 次,用二抗稀释1:5 000 孵育2 h。最后,用同样的方式使用TBST洗膜(3×10 min),并用荧光增强检测系统检测蛋白的表达。
(五)DCFDA 染色流式细胞仪检测HT22 细胞内ROS 水平
待HT22 细胞处于对数生长期时,以1.5×106个/mL 均匀接种于6 孔板中,放于5 %CO2、37 ℃的培养箱中进行培养,待细胞密度为70 %左右,依照实验要求给予不同组别相应的处理后,弃上清,用0.25 %的胰酶适度消化后,使用新鲜培养基终止消化,然后用长tip 头轻轻吹打贴壁细胞,制成细胞悬液,从离心管中移取100 μL 细胞悬液至1.5 mL 的离心管中,再加入20 μmol/L 的DCFDA 溶液,置于37 ℃恒温箱中继续孵育30 min。孵育完成后不需要洗涤细胞,尽快在流式细胞仪上检测每管的荧光值。
(六)caspase-3 活性检测试剂盒检测HT22 细胞中caspase-3 活性水平
取对数生长期细胞以 (2 ~ 5)×106个/mL 密度均匀接种于96 孔板中,每组设置2 ~ 3 个复孔,待细胞密度为50 %左右,根据分组进行处理24 h。之后吸取细胞培养液,备用。用胰酶消化贴壁细胞,并收集至备用的细胞培养液中。在4 ℃下,600×g离心5 min 后,收集细胞,小心吸除上清,PBS 洗涤1 次。同前吸尽上清后,加入100 μL 裂解液 (建议加入1 %蛋白酶抑制剂),重悬沉淀,冰上裂解15 min。在4 ℃ 下,16 000×g离心 10 min。之后将上清转移到预冷的离心管中。严格根据说明书配置反应体系,之后在酶标仪上以A405 波长检测每孔的OD 值,以此反映caspase-3 活性。
三、统计学分析方法
采用SPSS 18.0 软件进行统计分析,GDF11 蛋白、Bax 蛋白、Bcl-2 蛋白、caspase-3 活性、细胞活力的实验数据采用± s表示。两组间的比较采用独立样本t检验,多组间比较采用单因素方差分析,甲醛组与对照组比较以及GDF11 +甲醛组与甲醛组比较均采用LSD-t检验,以P< 0.05 为差异具有统计学意义。
结 果
一、GDF11 转染后HT22 细胞中GDF11 蛋白的表达
GDF11 转染后HT22 细胞中GDF11蛋白表达结果显示,与对照组比较,GDF11 转染HT22细胞后,GDF11 组蛋白表达水平(130.00±1.21比270.00±2.13)升高,差异具有统计学意义(t=98.987,P< 0.001,图1)。
二、不同浓度甲醛对HT22 细胞活力的影响
不同浓度甲醛干预处理24 h 后HT22 细胞活力结果显示,与对照组比较,50、100、200 μmol/ L 甲醛处理后细胞活力[(100.00±1.26)%比 (82.15±2.18)%、(56.24±0.62)%、(23.14±0.24)%]均降低,差异具有统计学意义 (LSD-t= 26.402,94.265,359.994,P均 < 0.001,图2)。
三、GDF11 对甲醛干预的HT22 细胞活力的影响
GDF11 转染前和GDF11 转染后,甲醛对HT22 细胞活力的影响结果显示,与对照组比较,100 μmol/ L 甲醛组HT22 细胞活力下降,差异具有统计学意义(LSD-t= 95.939,P< 0.001)。与甲醛组比较,GDF11 +甲醛组HT22 细胞活力升高,差异具有统计学意义(LSD-t= 26.717,P< 0.001)。(表1)

图1 GDF11 转染后HT22 细胞中GDF11 蛋白表达的情况

图2 不同浓度甲醛干预对HT22 细胞活力的影响
四、GDF11 转染对HT22 细胞中凋亡相关蛋白Bax、Bcl-2 表达的影响
与对照组比较,甲醛组Bax 蛋白表达水平升高、Bcl-2 蛋白表达水平降低,差异有统计学意义(LSD-t= 195.392,54.384,P均 < 0.001)。GDF11 转染后有效逆转甲醛诱导的Bax、Bcl-2 蛋白的表达异常 (LSD-t= 19.359,176.000,P< 0.001)。(图3,表1)

图3 GDF11 对甲醛干预的HT22 细胞Bax 和Bcl-2 蛋白表达水平的影响
五、GDF11 对甲醛处理的HT22细胞中caspase-3 活性的影响
GDF11转染前后,HT22细胞中caspase-3活性的结果显示,甲醛 (100 μmol/L)处理细胞HT22 细胞24 h 后,与对照组比较,HT22 细胞中caspase-3 活性升高。与甲醛组比较,GDF11 +甲醛组HT22 细胞caspase-3 活性降低,差异具有统计学意义 (P<0.001,表1)。
六、GDF11 对甲醛处理的HT22 细胞内ROS 水平的影响
GDF11 转染前后,HT22 细胞中ROS 水平的结果显示,与对照组比较,甲醛 (100 μmol/L)处理细 胞HT22 细 胞24 h 后,HT22细胞中ROS 水 平(1099.32±75.47 比2802.17±126.49)增加 (LSD-t=153.554,P< 0.001)。与甲醛组比较,GDF11 +甲醛组HT22 细胞中ROS 水平 (2802.17±126.49 比1305.36±68.45)水平降低 (LSD-t= 154.187,P<0.001)。(图4)
讨 论
甲醛是环境中严重的污染物质,广泛存在于人类的日常生活中。长期暴露于甲醛的环境中,会对人类的皮肤、生殖系统、心血管系统、免疫系统和神经系统等各个系统造成严重损害[4,8-10]。由于中枢神经系统对外界刺激极度敏感,暴露于甲醛环境中会对人类或动物的神经功能造成严重损害[11],因此环境中甲醛污染对人类健康的影响越来越受到关注。同时,人体在代谢过程中也会产生甲醛,但人体本身对甲醛的产生和代谢具有一定的调控能力[7]。随着机体衰老,人体对甲醛的调控能力下降,受到外界刺激时,体内甲醛极易异常升高,这被认为是某些神经退行性疾病如阿尔茨海默症发病的诱因,但目前对甲醛诱导神经毒性的具体机制仍不明确。GDF11 属于TGF-β 超家族的成员之一,参与调控细胞的增殖、分化和凋亡等功能[12]。近年来,发现GDF11 具有抵抗衰老的作用[13]。有文献报道,通过连体共生实验,为年轻小鼠和年老小鼠建立一个共生的血液环境,4 周后,年老小鼠的认知能力明显提升,又进一步通过检测分析发现年老小鼠脑中神经发生增加,海马区神经细胞之间联系增加,从而提高认知能力[14]。由此分析,认识到GDF11 具有神经保护作用,同时也大胆猜想GDF11 是否会对甲醛诱导的细胞凋亡有影响。
表1 GDF11 对甲醛干预的HT22 细胞活力及Bax 和Bcl-2 蛋白表达灰度值的影响 ( ± s)
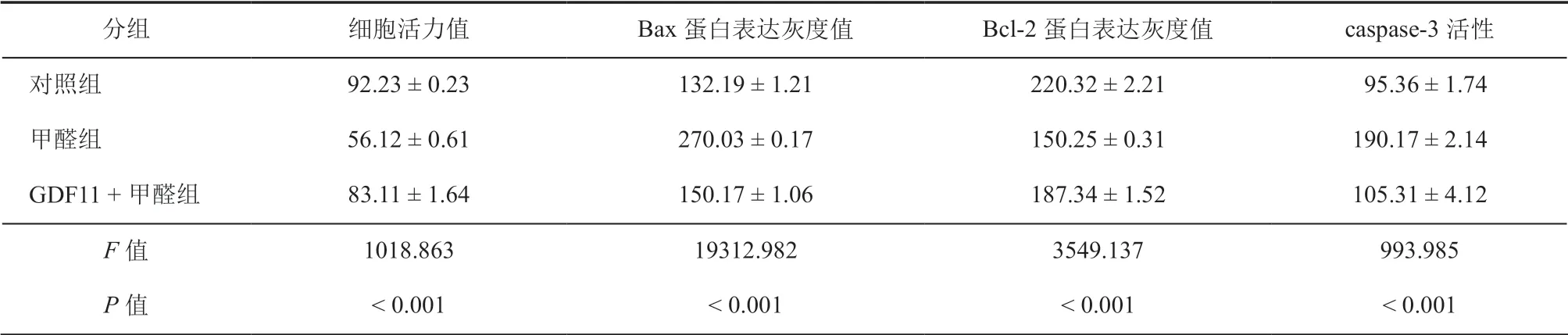
表1 GDF11 对甲醛干预的HT22 细胞活力及Bax 和Bcl-2 蛋白表达灰度值的影响 ( ± s)
分组 细胞活力值 Bax 蛋白表达灰度值 Bcl-2 蛋白表达灰度值 caspase-3 活性对照组 92.23 ± 0.23 132.19 ± 1.21 220.32 ± 2.21 95.36 ± 1.74甲醛组 56.12 ± 0.61 270.03 ± 0.17 150.25 ± 0.31 190.17 ± 2.14 GDF11 +甲醛组 83.11 ± 1.64 150.17 ± 1.06 187.34 ± 1.52 105.31 ± 4.12 F 值 1018.863 19312.982 3549.137 993.985 P 值 < 0.001 < 0.001 < 0.001 < 0.001
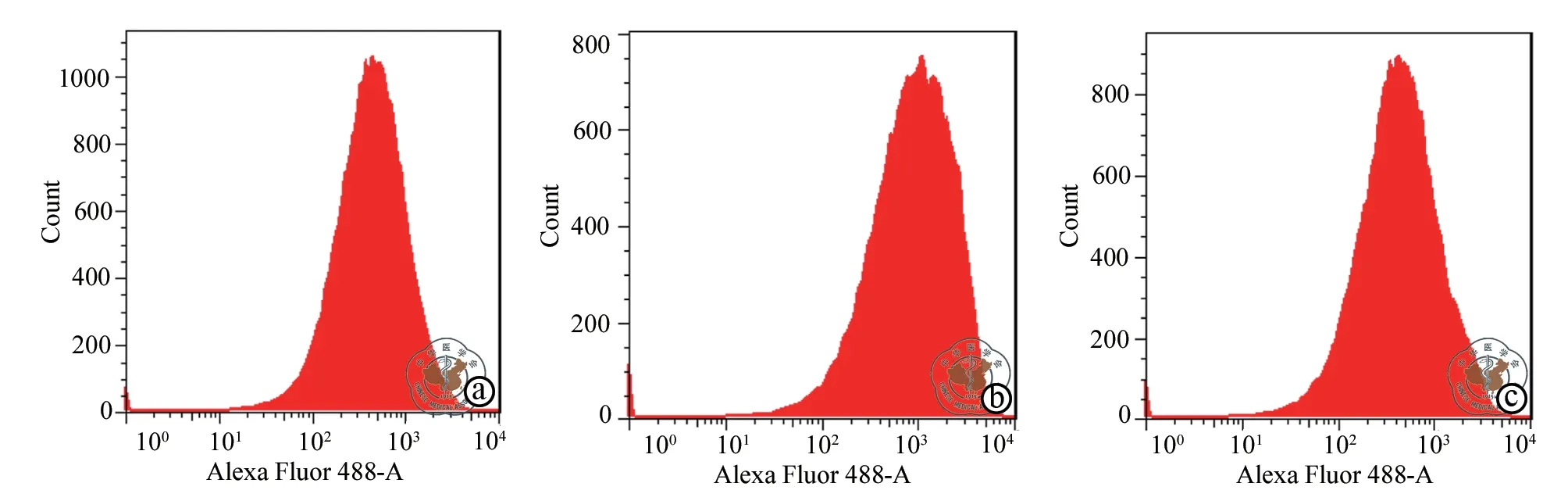
图4 对照组、甲醛组和GDF11 +甲醛组活性氧水平
细胞凋亡是机体本身为维持胞内稳态环境,进行自发性地由基因调控的死亡程序,让机体更好地适应生存环境[15]。caspase-3 是一种蛋白酶,是细胞凋亡过程中最主要的终末剪切酶[16]。Bax 是集体中广泛表达的促细胞凋亡基因之一[16]。Bcl -2 基因编码的蛋白具有抗凋亡的作用[17]。本研究通过蛋白免疫印迹法检测凋亡相关蛋白Bax、Bcl-2 蛋白的表达,发现GDF11 转染增强了甲醛对促凋亡蛋白Bax表达的增加作用,并减弱甲醛对抗凋亡蛋白Bcl-2 表达的抑制作用。以上提示GDF11 可抑制甲醛诱导的HT22 细胞凋亡。
ROS 是机体在生命活动中代谢的中间产物,具有高度的化学反应性[16]。人体内ROS 过多积累会对机体造成伤害,甚至导致细胞死亡,诱发各种肿瘤、心血管疾病和神经性疾病等多种疾病[16,18]。ROS 过多积累还可使组织器官衰老,诱发老年性疾病[19]。本研究中,通过DCFDA 染色流式检测GDF11 转染对甲醛处理HT22 细胞ROS 水平的影响,发现GDF11 可降低甲醛处理HT22 细胞的ROS水平,提示GDF11 转染明显抑制甲醛对HT22 细胞中ROS 的增加作用。
本研究结果显示,GDF11 转染甲醛处理的HT22 细胞后,降低促凋亡蛋白Bax 的表达、增加抗凋亡蛋白Bcl-2 的表达以及降低甲醛处理的HT22细胞内ROS 水平,提示GDF11 可抑制甲醛对HT22细胞的毒性作用,这为如何防治甲醛诱导的神经毒性作用提供了一个新的途径。

