乳中甲醛存在状态与影响因素研究
金福荣, 霍喜月, 冯志彪, 万洋, 姜瞻梅, 富天昕, 刘卜玮, 田波
(1.东北农业大学食品学院, 哈尔滨 150030;2.东北农业大学理学院, 哈尔滨 150030)
0 引言
甲醛是一种有机化学物质, 有较强的毒性, 在我国有毒化学品优先控制名单中列居第二位, 是潜在的强致突变物之一[1-5], 被世界卫生组织确定为Ⅰ类致癌物[6], 过量摄入甲醛会对人体产生危害。以往我国允许甲醛在食品中应用, 如《食品添加剂卫生标准》(GB2760-2007)[7]中允许甲醛作为食品加工助剂使用。2011年, 《食品安全国家标准 食品添加剂使用标准》(GB2760-2011)[8]将其删除, 不再允许在食品中使用。
甲醛在食品中应用可以起到防腐、增重等作用, 其主要被非法添加于水产品、乳肉及其制品、蔬菜中[9-10]。甲醛加入牛乳中可延长其保质期[11], 因此曾有极少数不法分子将其加入牛乳中来防止牛乳腐败变质。目前对于乳中甲醛的研究主要集中在甲醛的检测方法上[12-21], 即前处理方法与测定方式, 但是对生乳中甲醛的存在状态的研究较少。基于此, 本文采用乙酰丙酮法系统研究了生乳中甲醛的存在状态及其影响因素, 对生乳中甲醛的测定有一定的意义。
1 材料与方法
1.1 材料与仪器
生乳, 哈尔滨市香坊区奶户;甲醛标准溶液, 环境保护部标准样品研究所;冰乙酸, 天津市富宇精细化工有限公司;乙酰丙酮, 上海阿拉丁生化科技股份有限公司;乙酸铵, 天津市致远化学试剂有限公司;三氯乙酸, 天津永晟精细化工有限公司;乳糖, 天津市天力化学试剂有限公司;干酪素, 北京奥博星生物技术有限责任公司;乳清蛋白, 大连美仑生物技术有限公司。
79-1磁力加热搅拌器, 江苏金坛市双捷实验仪器厂;UV-6100型紫外可见分光光度计及AL204电子天平, 梅特勒-托利多仪器(上海)有限公司;101-OA电热恒温干燥箱, 北京东联哈尔仪器制造公司;TG16-WS高速台式离心机, 湖南湘仪实验室仪器开发有限公司;HH-4数显恒温搅拌水浴锅, 金坛市城东新瑞仪器厂。
1.2 方法
1.2.1 游离态甲醛测定标准曲线的绘制
取适量生乳样放置于超滤离心管中, 4 000 r/min离心30 min, 制得清液1。使用清液1配制甲醛浓度为0、1、2、3、4、5、6、7、8、9、10 mg/L的甲醛标准使用液。
参照HJ 601-2011[22]配制乙酰丙酮溶液, 取11支具塞比色管, 依次加入2.0 mL上述配制的甲醛标准使用液和2.5 mL乙酰丙酮溶液, 定容至25 mL, 60℃水浴反应15 min, 于413 nm下测定吸光度值, 甲醛浓度0 mg/L为空白对照, 测定3组平行值。以甲醛浓度为横坐标, 吸光度为纵坐标, 绘制标准曲线, 用于后续试验计算游离态甲醛的含量。
1.2.2 可逆结合态甲醛测定标准曲线的绘制
参照李薇霞的方法[23], 配制浓度为10%的三氯乙酸(TCA), 取适量生乳样, 1∶2体积加入TCA, 5 000 r/min离心10 min, 制得清液2。使用清液2配制甲醛浓度为0、1、2、3、4、5、6、7、8、9、10 mg/L的甲醛标准使用液。取11支具塞比色管, 参照1.2.1的步骤, 以甲醛浓度为横坐标, 吸光度为纵坐标, 绘制标准关系曲线, 用于后续试验计算可逆结合态甲醛的含量。
1.2.3 乳中不同状态甲醛含量的测定
以往报道涉及乳中甲醛的测定, 一般都是研究甲醛的测定方法, 没有对乳中甲醛的存在状态进行分析, 一般是只测定游离态甲醛或测定游离态甲醛和可逆结合态甲醛之和[12-21,24-25]。本试验所用样品均为乳外加甲醛所制得, 因此乳中总甲醛含量是已知的, 对乳中甲醛超滤离心测得的是其中的游离态甲醛, 而经蛋白沉淀后离心后测得的是游离态甲醛与可逆结合态甲醛的总和。
有研究发现牛乳中含有极低量的内源性甲醛[17]。在本试验所用的乳样品中使用乙酰丙酮法未检出甲醛, 故向其添加甲醛制得甲醛阳性乳样, 该甲醛阳性乳样的甲醛浓度为10 mg/L。
(1)游离态甲醛的测定。
取10.0 mL乳样于超滤离心管中, 4 000 r/min离心30 min。取2.0 mL清液于25 mL具塞比色管中, 加入2.5 mL乙酰丙酮溶液, 定容, 混匀, 60℃水浴反应15 min, 于413 nm下测定吸光度值, 根据1.2.1的标准曲线计算乳中的游离态甲醛含量。以不含甲醛的乳样品为空白, 测定3组平行值。
(2)可逆结合态甲醛的测定。
取10.0 mL乳样于离心管中, 加入10%TCA20.0 mL, 5 000 r/min离心10 min。取2.0 mL清液于25 mL具塞比色管中, 加入2.5 mL乙酰丙酮溶液, 定容, 混匀, 60℃水浴反应15 min, 于413 nm下测定吸光度值, 根据1.2.2的标准曲线计算甲醛含量, 此甲醛含量为可逆结合态甲醛和游离态甲醛含量之和, 可逆结合态甲醛含量=计算值-游离态甲醛含量。以不含甲醛的乳样品为空白, 测定3组平行值。
(3)不可逆结合态甲醛的测定。
由于不可逆结合态甲醛无法测定, 以总甲醛含量减去游离态甲醛和可逆结合态甲醛计算所得为不可逆结合态甲醛的含量。
1.2.4 乳中甲醛存在状态的影响因素
(1)温度对乳中甲醛存在状态的影响。
室温(25℃)、冷藏(4℃)处理:配制甲醛浓度为10 mg/L的乳样品, 于室温和冷藏下放置1 h, 按照
1.2.3 方法测定样品中不同状态甲醛的含量。
加热处理:取甲醛浓度10 mg/L乳样品, 放置在具塞锥形瓶中, 分别在30、40、50、60、70、80、90、100℃水浴加热1 h, 冷却, 按照1.2.3方法分别测定经加热处理的样品中不同状态甲醛的含量。
(2)时间对乳中甲醛存在状态的影响。
配制甲醛浓度为10 mg/L的乳样品, 分别于室温和冷藏下放置1、2、4、6、8、12、24 h;另取乳样, 分别在40、70℃下水浴加热20、40、60、80、100 min。根 据1.2.3的方法测定不同条件下、不同处理时间的乳样中不同状态甲醛的含量。
1.2.5 乳成分与甲醛的结合
(1)乳糖。
配制乳糖浓度为3%、甲醛浓度为10 mg/L的样品, 取10.0 mL于室温下放置1、4、8、12、24、36、48 h, 测定其中游离态甲醛含量, 计算结合态甲醛含量。
(2)乳蛋白。
配制酪蛋白浓度为2.4%、甲醛浓度为10 mg/L的样品和乳清蛋白浓度为0.6%、甲醛浓度为10 mg/L的样品, 分别取10.0 mL于室温放置1、4、8、12、24、36、48 h, 测定其中游离态甲醛含量, 计算结合态甲醛含量。
1.2.6 数据处理
每个样品至少做3次平行实验。应用Origin 2021和SPSS Statistics 23.0对实验数据进行统计分析和作图, 数据用平均值±标准偏差表示。通过配对T检验和单因素方差分析比较组间数据, 图中不同的字母表示有统计学差异(P<0.05)。
2 结果与分析
2.1 乳中甲醛存在状态的测定
乳中甲醛的状态为游离态、可逆结合态和不可逆结合态。对牛乳样品中的游离态甲醛通过超滤离心提取, 可逆结合态甲醛通过在牛乳样品中加TCA沉淀蛋白提取, 乙酰丙酮法测定其中甲醛含量, 不可逆结合态甲醛的含量无法测定, 通过总甲醛含量减游离态和可逆结合态甲醛含量计算所得。结果见表1。

表1 牛乳中不同状态甲醛含量
由表1可见, 在测定的乳样中, 添加甲醛浓度为3.00~10.00 mg/mL。经乙酰丙酮法测定其中游离态甲醛含量约占30%, 可逆结合态甲醛约占56.5%, 不可逆结合态甲醛约占13.5%, 结合态甲醛含量约占70%, 说明乳中甲醛主要以结合态形式存在, 这与对其他食品中甲醛的存在方式研究相吻合[26-28]。同时发现, 游离态与可逆结合态甲醛的总量为87%左右, 不可逆结合态无法检测, 即本法回收率为87%, 而陈静等人用HPLC法检测乳甲醛时发现甲醛的回收率约为87%[13], 二者结果一致。
2.2 乳中甲醛存在状态的影响因素
2.2.1 温度对乳中甲醛存在状态的影响
分别对牛乳进行不同温度处理, 测定不同态甲醛含量, 并记录数据, 结果见表2、图1。

表2 温度对甲醛状态的影响
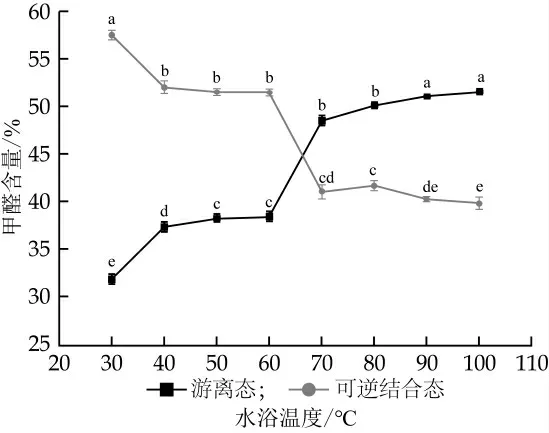
图1 不同加热温度对甲醛状态的影响
由表2可知, 在室温和冷藏状态下, 乳中甲醛存在状态无明显变化(配对T检验的P>0.05), 游离态甲醛含量稳定在30%左右, 可逆结合态甲醛约占56%, 结合态甲醛含量为70%左右。但将乳样进行水浴加热时, 乳中甲醛状态有明显变化。如图1所示, 热处理会明显影响甲醛的存在状态(单因素oneway-ANOVA的P<0.05)。在加热温度30~100℃, 随温度的升高, 乳中游离态甲醛含量由31.89%增加至51.57%, 可逆结合态甲醛含量由56.62%减少至39.87%;其中在温度为40℃与70℃时, 游离态甲醛和可逆结合态甲醛的含量变化比较显著, 在水浴温度40℃时, 游离态甲醛检出量增至37.35%, 可逆结合态甲醛含量减至52.06%;在水浴温度为70℃时, 游离态甲醛的含量高于可逆结合态甲醛达到48.58%。经计算, 加热后不可逆态甲醛占比由13%下降到9%左右。热处理对甲醛的存在状态的影响可能是由于加热使部分结合态甲醛的结合键断裂或产生新的甲醛所致[24]。若用超滤离心处理乳样品测定甲醛含量时需要考虑样品加热处理的影响, TCA沉淀乳蛋白测得的是游离态与可逆结合态甲醛含量的总和, 可不考虑样品的加热处理, 对检测结果的影响不大。
2.2.2 时间对乳中甲醛存在状态的影响
结合2.2.1的条件设置, 在不同温度下放置不同时间后测定乳样中的游离态和可逆结合态甲醛含量, 结果见图2。
由图2(a)可知, 在室温和冷藏条件下, 乳中游离态和结合态甲醛含量随时间延长无明显变化。在24 h内对不同状态甲醛含量进行检测, 游离态甲醛含量为28.80%~31.06%, 可逆结合态甲醛含量为56.52%~57.45%, 这说明室温和冷藏条件下乳中甲醛的存在状态比较稳定。由图2(b)可知, 对乳样进行水浴加热时, 随着时间变化乳中甲醛状态有明显变化。在加热温度为40℃时, 随水浴加热时间的延长, 游离态甲醛含量由34.05%增多至40.44%, 可逆结合态甲醛含量随之相应减少至51.21%。经过100 min的加热后, 甲醛状态仍不稳定, 但由于继续加热乳样会产生其它显色反应, 干扰甲醛的测定, 因此不再进行检测。在温度为70℃时, 甲醛状态随时间的变化较40℃更为明显, 在加热至80 min后, 乳中甲醛状态基本保持不变, 其中游离态甲醛50.13%, 可逆结合态甲醛41.94%, 这可能与乳成分与甲醛的结合相关。
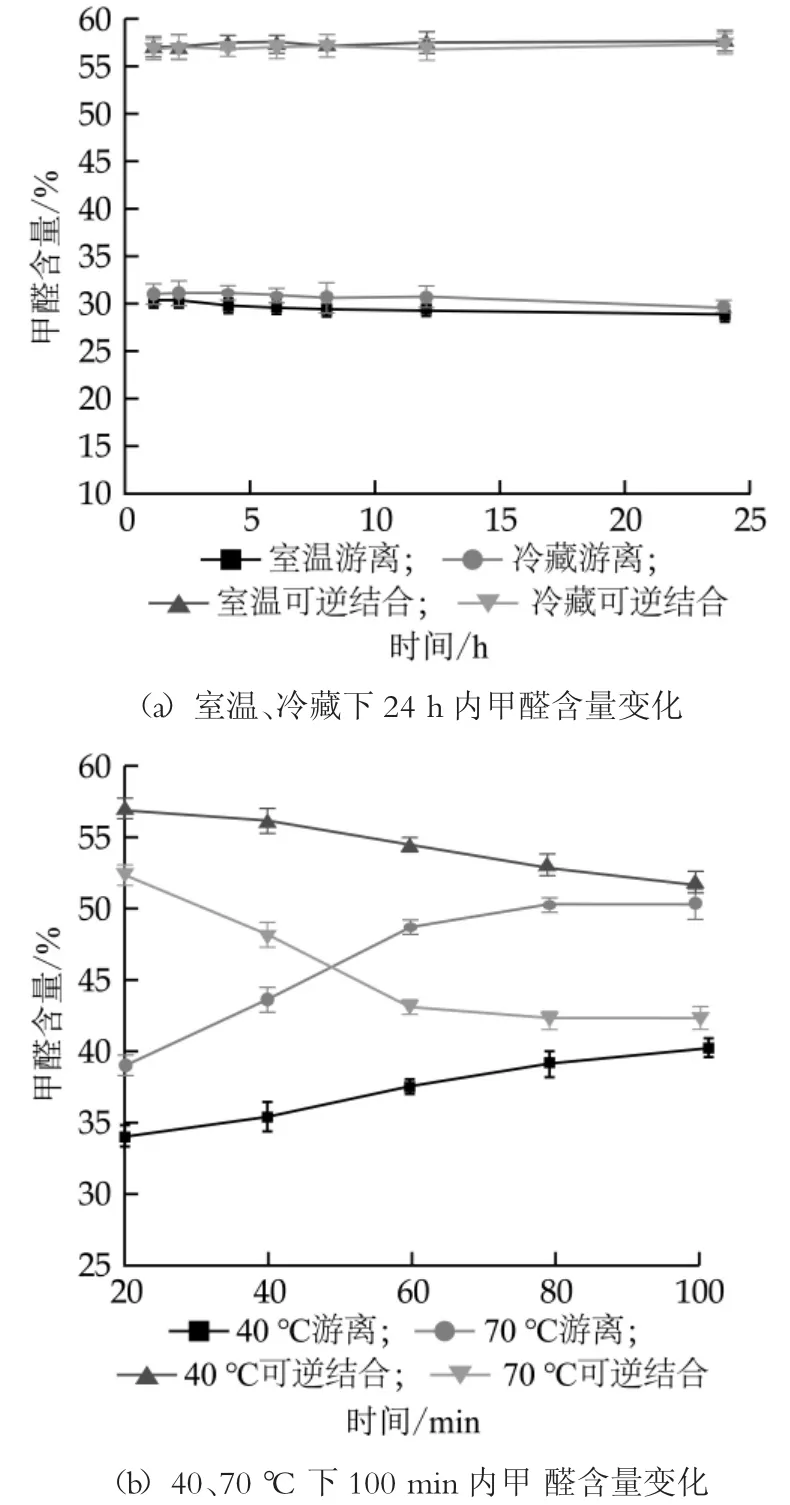
图2 不同时间对甲醛状态的影响
2.3 乳成分与甲醛的结合
乳糖和蛋白质是主要的乳成分, 分别配制与乳中乳糖、酪蛋白、乳清蛋白含量相同的溶液, 加入甲醛, 于室温下放置1、4、8、12、24、36、48 h后, 乙酰丙酮法测定游离态甲醛的含量, 计算结合态甲醛含量, 结果见图3、图4。
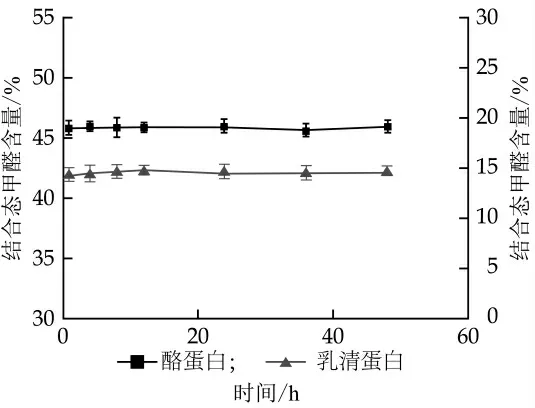
图4 乳蛋白与甲醛结合的程度
牛乳蛋白主要由酪蛋白和乳清蛋白组成, 其中乳清蛋白包括β-乳球蛋白、α-乳白蛋白以及其他几种微量蛋白。甲醛等醛类物质含有羰基极性基团, 可与氨基、羟基等多数基团进行结合。由图3、4可见, 与乳糖结合的甲醛占比4.02%~4.43%, 随着时间变化, 甲醛状态几乎不变。这说明在模拟的乳糖-甲醛体系中, 大部分甲醛以游离态形式存在, 即甲醛和乳糖结合极少。酪蛋白与甲醛的结合程度为45.75%~45.96%, 随着时间的延长, 结合状态较稳定;乳清蛋白与甲醛的结合程度14.22%~14.63%, 随着时间的延长, 结合状态亦没有明显变化。乳蛋白富含羟基、氨基等, 暴露在甲醛中会立即反应, 形成甲醛-蛋白质复合物, 而热处理会破坏甲醛和蛋白质之间的结合键或者产生新的甲醛[29-30]。有研究表明酪蛋白有很强的热稳定性, 一般的热处理不会导致其变性。乳清蛋白的热稳定性差, 40℃的热处理即可使其开始变性[29]。经40℃热处理后乳中游离态甲醛含量增加, 这可能是由于乳清蛋白在40℃时开始变性, 甲醛与之结合的键随之断裂, 也可能是由于与甲醛结合的其他物质热稳定性较差, 在此温度下出现变性[30]。当热处理温度为70℃时, 游离态甲醛比例更大, 可能是由于乳清蛋白或其他与甲醛结合的物质变性速度迅速加快, 使得更多可逆结合态甲醛转变为游离态。

图3 乳糖与甲醛结合的程度
3 结论
(1)甲醛在乳中有游离态和结合态(包括可逆结合态与非可逆结合态)两种存在方式, 游离态甲醛含量约占30%, 可逆结合态甲醛约占56.5%, 不可逆结合态甲醛约占13.5%, 结合态甲醛含量约占70%, 说明乳中甲醛主要以结合态形式存在。
(2)温度会影响乳中甲醛的存在状态, 未经任何热处理或经冷藏的牛乳样品中游离态甲醛的含量为28.7%~31%, 室温(25℃)与冷藏条件(4℃)下, 乳中甲醛存在状态无明显变化, 游离态甲醛含量稳定在28.80%~31.06%, 可逆结合态甲醛约占56.52%~57.45%;加热温度由30℃上升到100℃甲醛的存在状态有显著变化, 使游离态甲醛从37.35%上升到51.57%, 可逆结合态甲醛含量由52.06%降低到39.87%。不同温度下, 时间对甲醛存在状态影响不一。室温(25℃)与冷藏条件(4℃)下, 乳中甲醛的存在状态比较稳定, 反应时间延长也未有明显变化。在加热温度为30~100℃时, 随加热时间的延长, 乳中游离态甲醛含量由31.89%增加至51.57%, 可逆结合态甲醛含量由56.62%减少至39.87%, 其中在加热温度为40℃及70℃时, 甲醛状态随时间的变化尤为显著。乳成分对甲醛存在状态也有影响, 主要是乳蛋白与甲醛结合, 其中与酪蛋白结合占45.75%~45.96%, 与乳清蛋白结合占14.22%~14.63%。

