母乳低聚糖分离与纯化工艺技术现状
李云飞, 栾庆民, 李珍珍, 张莉, 薛雅莺, 孔刘娟, 李克文
(1.保龄宝生物股份有限公司, 山东禹城 251200;2.山东省功能糖提取与应用技术重点实验室, 山东禹城 251200;3.上海交通大学农业与生物学院, 上海 200240)
0 引言
母乳低聚糖(HMO)是母乳中第三大成分(乳糖、脂质、低聚糖等), 对婴儿生长发育具有特殊的生物活性功能, 是婴儿配方奶粉母乳化不可或缺的成分[1]。HMO自然资源非常有限, 但是婴幼儿配方奶粉市场对此需求量很大。近些年, 人们努力寻找和研发HMO可利用资源, 其中包括从牛羊乳汁中分离提取HMO, 人工化学合成、酶催化合成和利用微生物发酵法生产合成HMO, 在HMO生产源头上取得了长足进步, 发表了大量的研究论文和专利文献[2-4]。然而, 关于HMO下游的生产技术报道却非常少。本文基于国内外相关研究论文和专利文献, 分析工业化生产、分离HMO技术现状和趋势, 期望能为我国HMO生产提供参考。
1 HMO资源与合成途径
HMO组成比较简单, 由5种单糖通过不同数量或不同连接方式构成[5]。5种单糖是:D-葡萄糖(Glc)、D-半乳糖(Gal)、N-乙酰氨基葡萄糖(GlcNAc)、L-岩藻糖(Fuc)和N-乙酰神经氨酸(唾液酸, Neu5Ac)。HMO结构比较复杂, 目前已发现有200余种, 其中结构已明确的约100种, 聚合度3-14约50种, 占HMO质量的99%[6]。HMO分子链多以乳糖为还原端, 而以Galβ-1,3-GlcNAc(乳糖-N-二糖, I型)或Gal-β1,4-GlcNAc(N-乙酰氨基乳糖, II型)通过β-1,3或者β-1,6与乳糖连接或重复连接, 构成分子链的核心结构。岩藻糖通过α-1,2、α-1,3、α-1,4, 或者唾液酸通过α-2,3、α-2,6对分子链修饰, 如表1所示, 形成中性低聚糖和酸性低聚糖两类[7-8], 即岩藻糖基化中性低聚糖(占比35%~50%)、非岩藻糖基化中性低聚糖(42%~55%)和唾液酸化酸性低聚糖(12%~14%)[9]。
1.1 从牛乳或山羊乳中分离提取
牛乳或山羊乳中的低聚糖(Bovine Milk Oligosaccharides,BMO;Caprine Milk Oligosaccharides,CMO)是奶酪加工过程中的副产品, 往往随乳清一起废弃掉, 不但浪费资源, 而且也带来环境污染问题[10]。随着人们对HMO生物功能的认知, 从BMO或CMO中分离HMO或者HMO相似低聚糖得到重视。BMO中唾液酸化低聚糖含量比较丰富, 如表1所示, 尤其是3’-唾液酸乳糖(3’-SL)和6’-唾液酸乳糖(6’-SL)是HMO主要成分, 具有促进婴儿大脑神经发育功能。CMO既含有唾液酸化低聚糖, 也含有岩藻糖基化中性低聚糖, 在组成和结构方面与HMO更相似[11], 是生产HMO较好的资源。然而, 由于常乳中BMO或CMO含量非常低, 而且其分子组成和结构也与HMO略有不同, 例如, BMO除了HMO 5种单糖外, 还含有N-羟乙酰神经氨酸(Neu5Gc)和N-乙酰半乳糖胺(GalNAc), 在成分方面Galβ-1,3-GlcNAc(乳糖-N-二糖, I型)和中性低聚糖含量很少[9,12]。这些差异增加了HMO工业化分离、富集和纯化困难。
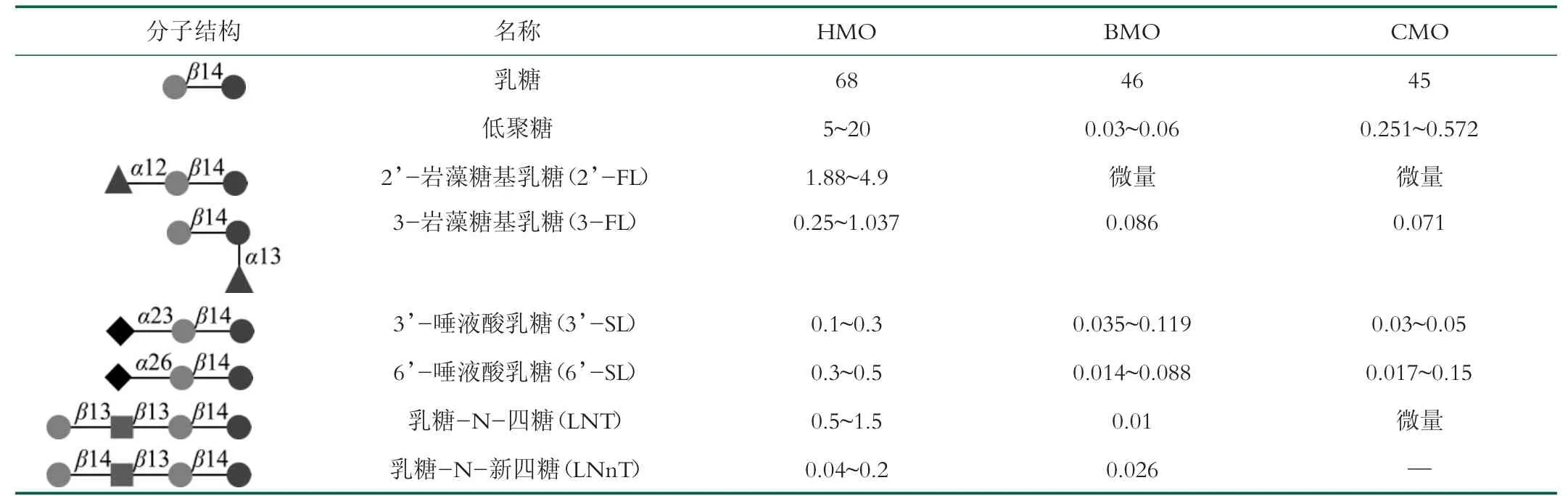
表1 部分常乳低聚糖结构与含量[8,10-12] g/L
1.2 化学合成或酶促合成法
在化学合成中, 由于所用原料或者中间体化学结构不同, 在反应过程中往往经历构象反转、脱氧或者脱氢等环节[13]。又由于每个糖分子都具有多个性质相似的羟基, 而两个糖分子之间的羟基可以形成多种糖苷键, 使反应产物或者中间体的化学结构非常繁杂。为了避免产生不希望的化学结构, 在反应过程中对中间体不断地分离与纯化, 对反应物基团不断地加保护和脱保护处理, 使反应过程步骤繁多, 收率低, 以及带来有毒有害等物质, 这是阻碍HMO化学合成工业化生产的瓶颈[14-15]。目前糖化学合成工程已有许多改进的方法, 例如, 模块顺序合成法、一锅法和固相合成法等, 合成过程和收率获得明显提高[16]。酶促合成法涉及到两种酶, 糖苷酶(Glycosidases)和糖基转移酶(Glucosyl transferases)。糖苷酶具有合成糖苷键和水解糖苷键的双重作用, 对底物选择性不高;而糖基转移酶需要核苷化糖基供体。由于酶的选择性催化, 大大减少了底物基团保护和脱保护步骤。酶促合成法取决于酶的性质和核苷化糖基供体, 高活性酶和丰富的核苷化糖基供体(例如, UDP-L-岩藻糖)是工业化酶促合成HMO的关键[17-18]。在分离纯化环节, 反应液中非目标HMO(或HMO异构体)、催化用酶、催化用重金属、底物及其它衍生物是突出问题。
1.3 微生物全细胞合成法
微生物全细胞合成法是利用经过基因修饰的工程菌在细胞内合成HMO。目前研究较多的宿主菌有大肠杆菌E.coil K12,大肠杆菌E.coil BL21(DE3)[19], 谷氨酸棒状杆菌(Corynebacterium glutamicum)、枯草芽孢杆菌(Bacillus subtilis)、乳酸乳球菌、酿酒酵母菌(Saccharomyces cerevisiae)等微生物[20]。通过高表达异源糖基转移酶基因和核苷化糖基供体合成酶基因, 获得高产率HMO。从遗传背景掌握, 基因操作方便性, 生长繁殖速度等角度, 大肠杆菌无疑是首选菌。丹麦格礼卡姆公司(Glycom)、德国詹内怀恩公司(Jennewein)、美国GlycoSyn公司和比利时Inbiose(杜邦营养)公司均利用大肠杆菌E.coil K12或大肠杆菌E.coil BL21(DE3)作为生产菌种生产出2’-FL、LNnT、LNT和DFL(Difucosyllactose)等HMO产品[21-22], 发酵罐容积已达到200 m3以上, 2’-FL效价可达280 g/L[23]。并且作为食品新资源, 先后获得美国食品药品监督管理局(Food and Drug Administration,FDA)的GRAS(generally recognized as safe)安全认定和欧盟食品安全局新食品认证(Novel Foods European Food Safety Authority, NF EFSA)[21,24]。大肠杆菌E.coil BL21(DE3)也被我国食品安全风险评估中心(食品添加剂新品种征求意见书)明确为2’-FL的加工助剂(食安通)[25]。在分离纯化环节, 发酵液中微生物细胞和碎片、微生物代谢副产品(蛋白质、肽、氨基酸、非目标糖酸)、底物等物质是突出问题, 尤其是大肠杆菌细胞外膜脂多糖产生的内毒素, 给食品药品带来潜在的风险, 是分离纯化环节特别突出的问题。
2 HMO分离纯化工艺
分离纯化是工业化生产的重要环节, 反应液或发酵液中含有大量的底物、中间产物和副产物, 这些杂质不但降低了HMO的功能, 而且部分是有毒有害物质。HMO作为食品新资源, 目前允许添加的仅有2’-FL、LNnT、LNT、DFL、3-SL[21]。HMO用于其功能分析、安全性评价、以及分析检验等材料, 要求其应有足够高的纯度[26]。分离纯化过程主要包括离心沉淀、膜分离、活性炭吸附、色谱分离、结晶、生物降解等工艺环节, 具体环节和顺序取决于被分离体的大小、带电性质、表面活性等性质[27]。其中纳滤、渗滤、色谱和结晶等工艺是生产高纯度产品的常用技术, 在HMO分离方面有多项专利技术和相关文献报道。
2.1 纳滤与渗滤(Nanofiltration and Diafiltration,NF,DF)
纳滤(NF)和渗滤(DF)均属于压力驱动型分离技术, 其分离机理是基于空间位阻和静电力协同效应, 如图1所示。影响NF或DF分离因素非常复杂, 包括膜表面材料理化性质、截留分子量大小、料液pH、流动状态、温度、黏度、颗粒理化特性、跨膜压力、渗滤容积系数(Diavolume,DV)等等因素。在HMO分离纯化方面, 研究所用NF有效面积从实验室级(160 cm2)、到中试规模(2.5 m2)和工业化规模(175 m2)[28], 成果与问题主要集中在:(1)利用酶解与生物发酵相结合的方法去除双糖和单糖。由于乳糖分子量(342.30 u)与HMO主要成分(2’-FL, 3-FL, 3’-SL, 6’-SL)分子量(487.4~633.55 u)相近, 且乳糖含量很高, 而低聚糖含量很低, 使后续分离、富集和纯化难度增大。利用米曲霉半乳糖苷酶将乳糖完全水解, 再经过酿酒酵母发酵降解乳糖分解后的葡萄糖和部分半乳糖, 使分离难度降低。该方法在中试规模上分离BMO或CMO取得了较好的效果[28-30]。例如, 牛初乳乳清(200~300 L, 低聚糖含量0.21 g/L, 乳糖含量21.22 g/L)酶解后发酵20 h, 葡萄糖被完全降解, 单糖仅剩0.06 g/L, 纳滤截留物中低聚糖(3’-SL,6’-SL, 6’-SLN)含量达95%, 产品纯度达99%[31]。(2)截留分子量(Molecular Weight Cutoff,MWC)对低聚糖收率和纯度的影响。MWC大, 低聚糖收率下降, 纯度提高;MWC小, 低聚糖收率提高, 纯度下降。收率和纯度两个指标相互制约[32-33]。多位学者结合跨膜压力和料液透过率等因素, 对MWC 150~1 400 u范围进行了研究, 结果表明, PA 200~400 u对乳糖截留太多, PVDF1 000 u对3’-SL截留太少, 而SPES 600~800 u效果最好[34]。相似的研究结果还有利用磺化聚醚砜纳滤膜分离低聚糖, MWC 500~700 u分离纯化效果较好[35], 而MWC 700~1 000 u低聚糖流失过多[29]。(3)渗滤次数或者渗滤容积系数DV(渗滤用水/滤液体积之比)对低聚糖纯化的影响。为了提高HMO纯度, 在损失一定收率前提下通过纳滤(浓缩系数CF达到5-10)再渗滤的方法可实现。研究表明, 牛初乳乳清经过纳滤至CF10后, 采用间歇式渗滤10次, 截留物中单糖从20%降至1%, 而低聚糖从99%降至95%[35]。采用切流渗滤(容积系数DV4.6)后, 渗滤前低聚糖与原料液单糖之比为10, 渗滤后低聚糖与原料液单糖之比为100, 低聚糖浓缩纯化效果明显[28]。用纳滤(MWC1 ku)并渗滤分离山羊乳清, 当渗滤容积系数达DV3时, 盐离子和95%乳糖已被洗脱掉, 80%以上的低聚糖被截留, 低聚糖收率较低与MWC偏大有关[36]。(4)跨膜压力选择。跨膜压力与滤膜透过率呈正相关, 但是, 压力过大加剧截留层压实密度和浓差极化后果[35,37]。研究表明, 压力从0.5~3.5 MPa, 山羊乳清透过率从1.92增加至11.33 Lm-2h-1, 截留物中低聚糖从50.5%增加至89.2%;从3.5~4.0 MPa, 透过率无明显变化。但是当纳滤至CF10时, 浓差极化后果明显, 透过率从10.22 Lm-2h-1降至5.33 Lm-2h-1, 截留层密度从988.3 kg/m3增加至1010.2 kg/m3[38]。(5)膜材料与pH选择。料液pH影响膜表面材料的电荷强度, pH增加, 膜材料(磺化聚醚砜纳滤膜)表面负电荷增强, 对于酸性HMO具有静电排斥效应, 起到滤膜的排阻作用, 有利于分离纯化。然而, 研究发现当料液中含有盐离子时, pH(4.5, 7.0, 8.5)增加, 酸性低聚糖(3’-SL)截留率并没有增加, 而中性低聚糖(及葡萄糖和半乳糖等单糖)截留率却减少。文章认为pH增加对膜孔有增大效应, 导致更多的中性低聚糖透过膜面;而对于酸性低聚糖而言, 静电相斥作用和膜孔增大作用相互抵消, 其截留率或者透过率无明显变化[34-35,39-40]。
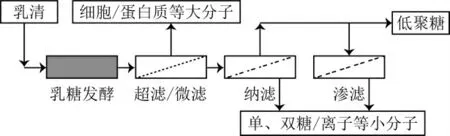
图1 从乳清中分离HMO工艺流程[28]
2.2 模拟移动床色谱分离
模拟移动床色谱(Simulated Moving Bed Chromatography,SMB)在制糖业、食品、制药和精细化学工业等领域得到推广应用, 尤其对两组分混合液分离, 具有处理量大、产品纯度高、洗脱剂耗量低等诸多优点[41-42]。常规SMB由4个色谱柱和进出口阀门等管件构成, 形成吸附剂再生区(I)、提纯区(II)、吸附区(III)和洗脱剂再生区(IV)。其中提纯区(II)和吸附区(III)是主工作区, I、IV再生区是保障吸附剂和洗脱剂可再循环利用区。4个进出口按一定时间间隔沿流动相流动方向同步移动, 从而形成固定相逆向移动的模拟效果如图2所示。SMB在分离低聚半乳糖和低聚果糖方面已有较多报道[43-45], 但是在分离HMO方面报道非常少。主要研究内容是:(1)色谱柱数量和配置方案。色谱柱数量与设备投资、运行成本及分离性能之间相互制约, 是优化研究SMB系统的主要内容。德国詹尼温公司(Jennewein Biotechnologie GmbH)专利技术介绍了其利用SMB系统分离中性HMO的基本框架, 即每个区可配置1~3个色谱柱, 整个系统色谱柱数量在4~12个范围[46]。对于糖组分较多的混合液, SMB系统可以串联应用。如图3所示, 两组SMB系统共24个色谱柱。第一组SMB系统将单双糖与三糖及以上低聚糖分离, 第二组将三糖与四糖及以上低聚糖分离。中性HMO 2’-FL从R1口流出, 纯度93.0%, 其它杂质包括3’-FL(1.1%)、DFL(0.9%)和乳糖(1.0%)[47]。为了强化分离能力, 可以增加提纯区和吸附区色谱柱的配置数量, 例如Andreas G.等将8个色谱柱按I区1个, II区3个, III区3个, IV区1个配置[41]。对于廉价洗脱剂(如水), 洗脱剂没有必要再生循环使用, 洗脱剂再生区IV可以取消[43,48-49]。(2)吸附剂选择。研究报道较多的是阳离子(H+、K+、Na+、Ca2+)凝胶树脂吸附剂和尺寸排阻吸附剂。由于离子凝胶吸附剂同时具有离子配位体效应和尺寸排阻效应, 在葡萄糖、果糖、半乳糖、蔗糖、乳糖、低聚糖等分离中应用较多。用3种离子(K+、Na+、Ca2+)型聚苯乙烯树脂吸附分离葡萄糖、果糖、蔗糖和低聚果糖, 结果表明, 葡萄糖和果糖分子量相同, 利用尺寸排阻很难分离, 但是果糖羟基具有更多的直立-平伏键, 与离子配位强度大于葡萄糖, 从而得以分离[44-45]。K+离子与糖有较高的亲和性, 但是其选择性能较差, Ca2+型吸附剂分离低聚果糖与小分子糖效果更好。由于离子型吸附剂需要用较强的酸或碱水溶液洗脱与再生[50], 吸附剂稳定性也是其选择因素之一。用尺寸排阻凝胶树脂(颗粒50~100μm)和配体(离子)交换树脂(Ca2+离子, 颗粒75~150μm)两种吸附剂试验, 配体(离子)交换树脂吸附乳糖能力为90~110 g/d, 而尺寸排阻凝胶树脂吸附能力为24~28 g/d, 前者明显高于后者。然而, 经过近一年的运行试验发现, 配体(离子)交换树脂颗粒在使用过程中出现塌陷和收缩, 使分离纯化效果显著下降。从SMB连续化生产特性角度, 尺寸排阻凝胶色谱柱更适合于工业化生产[41]。(3)运行参数选择。从图2可知, SMB系统流动相流动状态由两个进口和两个出口流量决定, 固定相模拟移动速率由4个进出口同步转换时间决定, 因此, 常规SMB系统具有5个独立变量(即进出口转换时间间隔t*(0<t<t*)和4个区的流动速率)。优化5个变量比较复杂, 往往由试验或者由理想线性模型初步预测, 再经过实际运行修正而确定[51]。随着理论计算和实验研究的不断进展, 进出口转换时间t*不断被细分, 系统独立变量不断增加, 使系统运行更趋完善, 逐步达到精准预测和控制各组分的前锋位置, 降低组分间交叉污染程度[52-54]。

图2 模拟移动床色谱(SMB)基本原理[42]
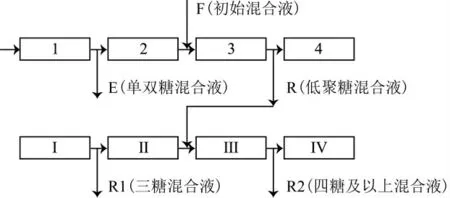
图3 多组分糖SMB分离流程[47]
2.3 结晶
结晶是混合液分离纯化技术之一, 是在一定浓缩基础上的后续工艺。结晶难易程度取决于物质的分子量、溶解度和工艺条件, 分子量大的物质往往从溶液中首先析出或结晶, 例如, 双糖(蔗糖、乳糖等)从单糖(葡萄糖、果糖、半乳糖等)水溶液中分离[55]。分子量相同或者相近的物质取决于其化学结构或者溶解度, 例如, 果糖在水溶液中溶解度高于葡萄糖, 葡萄糖首先结晶;乳果糖溶解度高于乳糖, 乳糖首先结晶[56]。对于低聚糖结晶, 其结晶难易程度受分子链链段自由度、支链大小和规整性等因素影响较大[57]。目前HMO合成与分离的低聚糖主要是3糖或4糖聚合物, 多数情况下呈不定型的浆状或粉末[58]。例如, 2’-FL水溶液在较低温度下仍然很稳定, 尽管黏度不高, 从分子扩散角度有利于结晶, 但是即使在过饱和状态下2’-FL也很难结晶[59]。针对发酵液中含有的单双糖和一定比例的非目标岩藻糖基化乳糖或半乳糖、以及岩藻糖基化乳果糖(如3-FL, 2,2’-FL, 2’,3-FL), 丹麦Glycom A/S公司有多项国内外专利技术介绍2’-FL的结晶方法。在前处理阶段, 原料液经过除杂、脱色和真空浓缩或者纳滤浓缩等工序后, 如图4所示, 碳水化合物含量达到50%~68%(或者2’-FL 550~670 g/L), 其中DFL含量与2’-FL之比控制在2∶8至1∶9范围内。在冷却结晶阶段, 分批加入冰醋酸(用量2~10 L/kg 2’-FL)和晶种, 结晶结束后用冷醋酸(或异丙醇或冷丙酮)淋洗、分离与干燥。该方法获得的结晶体, 2’-FL收率达70%~85%, 纯度92%~95%;杂糖含量(特别是DFL)小于2%~3%;冰醋酸含量小于2%~3%[60]。相似专利技术选择添加甲醇或者乙醇(C1-C6醇溶液), 获得的结晶产品(2’-FL)基本不含其它有机溶剂和水, 经过X射线衍射、DSC和IR光谱检测, 明确了晶胞尺寸和晶系(单斜晶), 是一种α、β端基异构体混合的多晶型物(I、II)[61-62]。
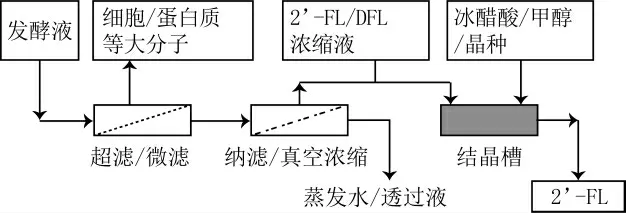
图4 2'-FL结晶分离工艺流程[60]
3 总结与讨论
HMO是一种具有生物活性功能的食品新资源, 是婴儿配方奶粉母乳化的重要组成物质。乳清是干酪生产副产品, 资源丰富, 是HMO天然资源之一。化学合成、酶催化合成和生物发酵合成也是获取HMO的人工途径, 具有工业化深度开发的技术基础。无论是牛羊乳清还是化学合成反应液, 分离纯化HMO是重要的生产环节。牛羊乳清中HMO含量很少, 而乳糖含量较高, 是分离纯化的主要问题。化学合成反应液除了含有反应物和中间物以外, 还有有机溶剂和重金属催化剂等残留物质。生物发酵液除了含有微生物和发酵底物外, 还有大量的代谢副产品。纳滤膜分离、SMB色谱分离和结晶分离都具有分离纯度高的特点, 纳滤膜分离往往结合渗滤分离, 在损失一定收率条件下可明显提高纯度。基于膜截留分子量大小和蒸馏塔板理论方法(McCabe-Thiele), 可以对膜分离分级串联模式进行优化[63]。SMB色谱在制糖行业有较多的应用范例, 但是在HMO分离方面报道很少, 试验用原材料稀缺是主要因素。与报道较多的糖浆中分离蔗糖、果糖与葡萄糖、半乳糖与乳糖等分离相比, HMO中组成相同、结构相似的成分较多(如2’-FL、3-FL、2,2’-FL、2’,3-FL等), 酸性糖(3’-SL,6’-SL)也占有较高比例, SMB色谱系统设计与优化有待深入研究。HMO晶体结构和结晶工艺主要出现在有限的专利文献中, 由于HMO分子量和分子结构不同于小分子糖, 结晶特性有较大差异。晶种诱发和有机酸或醇溶剂分批投放是成功结晶的关键。3种分离纯化技术(膜分离、SMB色谱、结晶)在产品收率、纯度和生产率方面各有特点。SMB纯化性能好, 尤其是结构相似难分离的产品;对于纯度要求不是特别高、且生产规模较大的产品, 膜分离技术对SMB色谱具有一定的竞争力[64-65];而结晶分离在产品收率和纯度方面略差, 但是设备投资和运行成本均较低[66]。产品分离方案应该综合投资成本、产品规格和生产规模等多种因素确定。

