羊奶冻干粉中恩诺沙星基体标准物质的研制
刘天和, 武彩红, 左伟勇, 杜汶伸, 曹习超, 魏宁
(江苏农牧科技职业学院, 江苏泰州, 225300)
0 引言
在兽药残留分析过程中由于受样品本身差异性的影响, 纯标准物质和基质添加标准物质相比, 基体标准物质能够更好的满足兽药残留检测的需要。近年来, 世界各国颁布的有关于农、兽药残留分析的指导性文件, 如欧盟决议2002/657/EC, 明确指出需要采用基体标准物质进行质量控制, 所以基体标准物质在兽药残留检测中具有十分重要的作用[1]。在兽药残留分析中, 样品基体涉及到各种动物组织及加工食品, 分析基体本身的差异性使得在分析过程中不能只简单地使用纯度标准物质, 而需要用基体标准物质来满足进一步的检测需要[2,15]。
现如今, 随着老百姓生活水平的提高, 奶制品在人们的饮食结构中越来越重要, 除了牛奶以外羊奶在我国的需求量也逐年攀升, 相关数据显示, 当前我国的羊奶市场消费规模已经突破百亿, 年均增速在25%以上。恩诺沙星是世界上第一个动物专用的氟喹诺酮类药物, 对于牛、羊、猪、禽由细菌引起的消化道感染、呼吸道感染和支原体病等都有很好的疗效。其给药方式多样, 可混饮、可注射、可内服。由于恩诺沙星具有抗菌谱广、杀菌活性强、体内分布广泛的特点, 所以兽医临床上大量使用, 同时也出现了恩诺沙星在动物源性食品中超标现象, 其中牛奶和羊奶中残留超标的事件也有报道。我国对牛羊奶中的恩诺沙星最高限量为100μg/kg[3]。就国内而言, 我国标准物质的研制还是刚刚起步, 特别是兽药基体标准物质, 无论种类还是数量均十分的缺乏, 远不能满足现实需求。羊奶冻干粉中恩诺沙星基体标准物质的研制力求为羊奶实际样品中恩诺沙星残留量的准确检测提供稳定的质控标准。
1 材料与方法
1.1 仪器与材料
Waters ACQUITY Arc高效液相色谱仪(配PDA-2998二极管阵列检测器), 美国Waters公司;SECURA124-1CN精密电子天平, Sartorius公司;Milli-Q Direct 7纯水仪, 美国Milipore公司;SevenExcellence S400 pH计, 瑞士METTLER TOLEDO公司;R300旋转蒸发仪, 瑞士BUCHI公司;20孔固相萃取装置, 美国Waters公司;5804R高速冷冻离心机, 德国Eppendorf公司;FreeZone(2.5L)真空冷冻干燥机, 美国Labconco公司;N-EVAP-24氮吹仪, 美国Qrganomation Associates公司;HD-2500多管涡旋振荡器, 杭州佑宁仪器有限公司;KQ-800ES超声波清洗器, 昆山市超声仪器有限公司;HYC-650医用冷藏箱、DW-25L262医用低温保存箱, 青岛海尔生物医疗股份有限公司。
恩诺沙星标准品(纯度≥99.7%), 中国兽医药品监察所;乙腈(色谱纯), Thermo Fisher Scientific公司;甲醇(色谱纯), Thermo Fisher Scientific公司;磷酸(分析纯)、三乙胺(分析纯)、氢氧化钠(分析纯)、正丙醇(分析纯)、正己烷(分析纯), 国药集团化学试剂有限公司;C18固相萃取柱(6 cc/500 mg), 美国Waters公司;2.5%恩诺沙星注射液(规格:10 mL∶0.25 g), 新乡市华畜商贸有限公司。
1.2 标准物质的制备
选取健康且在泌乳期的奶山羊3只, 体重在60±3.5 kg左右(江苏泰州西来原生态农业有限公司), 按照0.1 mL/kg量在奶山羊的颈部肌肉注射2.5%恩诺沙星注射液[4]。给药前将奶山羊单独饲养, 给药前3天每天按正常时间, 上、下午各采1次羊奶, 前4把羊奶弃掉, 3天的羊奶混装。空白羊奶需要进行恩诺沙星含量检测和乳房炎检测, 确定无恩诺沙星残留和乳房炎症状后, 第4天开始给药, 注射部位为颈部肌肉, 注射4 h后开始挤奶, 上午和下午采集的牛奶都需分装, 采集好的牛奶在-20℃冷冻保存。测得羊奶样品中恩诺沙星含量为122μg/kg, 然后使用空白羊奶将样品浓度稀释到100μg/kg左右。药物含量检测方法参考《GB 29692-2013牛奶中喹诺酮类药物多残留的测定高效液相色谱法》和已报道的检测方法[5,16-17]。
1.3 冻干粉的混匀与分装
随后将稀释好的羊奶样品均匀分装到西林瓶中, 每瓶11.2 g, 随后将分装好的样品放置到真空冷冻干燥机中进行冻干, 并采用橡胶塞和铝壳进行封装, 放置到-20℃冰箱保存, 需要检测时每瓶冻干粉加10.00 mL纯水进行复溶[6]。
1.4 标准物质的均匀性检验
按照JJG 1006-1994《一级标准物质技术规范》对均匀性检验的要求, 总体样本数500份情况下, 查阅随机数表随机抽取15瓶, 对所取每个样品重复测定3次[7]。按照单因素方差分析法对该套标准物质进行均匀性评价, 单因素方差分析方法是用来统计检验均匀性的最常用方法, 是通过组间方差和组内方差的比较来判断各组测量值之间有无系统性差异, 如果两者的比小于统计检验的临界值, 则认为样品是均匀的[18]。
1.5 标准物质的稳定性检验
稳定性检验包括短期稳定性和长期稳定性的检验, 本研究在短期稳定性的检验过程中结合运输环境和极端贮存条件对其进行评价, 将样品通过快递邮寄的方式寄到深圳、拉萨、兰州这3个城市, 分别在25、-20, 4℃环境下贮存两周时间。长期稳定性的检验考察样品在-20、-80℃两个贮存温度下样品在12个月内恩诺沙星含量的稳定性情况, 监测时间分别为0、1、4、8、12个月, 每次检测随机取3份样品, 平行检测3次, 取其平均值。JJF 1343-2012《标准物质定值的通用原则及统计学原理》规定长期稳定性的评估通常取5或6个时间点, 短期稳定性通常取3~5个时间点, 短期和长期稳定性检验都遵循先密后疏的原则[8]。
1.6 标准物质的定值与不确定度评估
JJF 1343-2012《标准物质定值的通用原则及统计学原理》规定[8], 标准物质特性量的标准值一般代表当前对其“真值”的最佳估计。样品通过均匀性检验后, 进行准确测量并对数据进行系统分析处理即为标准物质的定值。
JJF 1343-2012《标准物质定值的通用原则及统计学原理》规定[8], 对于标准物质定值结果, 其不确定度由三部分组成, 第一部分为标准物质不均匀性引起的不确定度;第二部分为有效期内的变动引起的不确定度;第三部分为定值过程引起的不确定度。将定值不确定度与均匀性检验、稳定性检验引入的不确定度按照平方和开方的方法叠加就给出总不确定度, 记为uCRM。该合成标准不确定度乘以因子(该因子称为包含因子, 记为k)得出的不确定度为扩展不确定度或称总不确定度, 记为U。在给出扩展不确定度时应指明包含因子的数值, 该值与要求的置信概率与自由度有关。
2 结果与讨论
2.1 标准物质的制备
本研究通过肌肉注射的方式给药对泌乳期的奶山羊给药, 使恩诺沙星自然代谢到羊奶中。注射药物为2.5%恩诺沙星注射液(规格:10 mL, 0.25 g), 给药量为0.1 mL/kg, 实际给药浓度为2.5 mg/kg[4]。给药4 h后开始挤奶, 获得的样品羊奶混合, 进行恩诺沙星含量检测, 检测值为122μg/kg, 随后将使用空白羊奶将药物浓度稀释到目标浓度100μg/kg左右。将羊奶样品进行分装、冻干、密封保存、随后进行均匀性、稳定性检验、定值和不确定度评估。
乳品常用的干燥方法主要是喷雾干燥法和真空冷冻干燥法, 喷雾干燥法由于其设备热效率低, 设备体积较大, 仪器价格昂贵, 不适用实验研究[14]。真空冷冻干燥法将溶液状态的产品经冷冻处理后, 先后经过升华和解吸作用, 使产品中的溶剂减少到一定程度, 从而阻止微生物的生成或溶质与溶剂间的化学反应, 真空冷冻干燥可以去除样品中95%的水分, 最大限度的保证样品的原有活性和品质[9-11]。对于热敏性较差的生物制品, 生化类制品, 血液制品, 基因工程类制品特性量值的均匀性、稳定性有最佳保证, 对于不稳定、易降解的药物来说, 真空冷冻干燥是一种较实用的干燥技术[12]。冷冻干燥时的工艺流程主要包括3个步骤, 依次是预冻、升华干燥、解析干燥[25], 本研究羊奶样品冻干条件为冷肼温度-80℃, 真空度10~20 Pa, 冻干时间72 h。
2.2 标准物质的均匀性检验
样品的均匀性评估采用单因素方差分析法进行数学统计, 查阅随机数表, 从500份样品中抽取15份样品进行均匀性检测, 每一份样品重复检测3次[19]。按照方差分析法对该套标准物质进行均匀性评价, 检测结果见表1。

表1 羊奶冻干粉中恩诺沙星标准物质的均匀性检验结果μg/kg
根据JJF 1343-2012标准物质定值的通用原则及统计学原理要求[8], 在置信区间为95%, F0.05(14,30)=2.04, 经以上实验数据分析得到的F值=1.92<F0.05(14, 30), 可认为羊奶冻干粉中恩诺沙星标准物质是均匀的。
2.3 标准物质的稳定性检验
2.3.1 短期稳定性检验结果
标准物质短期稳定性评价主要是模拟在不同的运输、保存条件中外界环境对恩诺沙星含量的影响。本研究充分考虑到运输过程中的各种影响因素, 温度、湿度、震荡、温度变化等, 将样品用快递分别寄到深圳、拉萨、兰州, 这3个温度环境和地理位置差异性比较大的城市, 并分别在25, -20, 4℃温度下保存2周(从快递到达目的地开始), 这样既考察了标准物质在运输环境下的稳定性又考虑在不同贮存条件下的稳定性, 这也是本研究在考察短期稳定性上的一个创新。由表2检测结果可知, 在95%置信水平, 短期稳定性结果良好, 在3种储存环境下羊奶冻干粉中的恩诺沙星能保持稳定。

表2 羊奶冻干粉中恩诺沙星标准物质短期稳定性检验结果μg/kg
2.3.2 长期稳定性检验结果
长期稳定性的考察, 在实验中选定了-20、-80℃2个贮存温度作为考察对象, 2个温度下的样品放置12个月, 测定样品中药物的含量, 监测时间分别为0、1、4、8、12个月(时间段为2021年1月~2022年1月), 每次检测随机取3份样品, 平行检测3次, 取其平均值[20]。选用线性模型对其进行长期稳定性评价, 表3检测结果表明羊奶冻干粉中恩诺沙星标准物质含量在12个月内没有明显的的变化, 变化范围均在特性量值及不确定度范围内[24]。因此可得到结论, 将含恩诺沙星的羊乳制成冻干粉后, 药物比较稳定, 在12个月内未发现明显的降解。
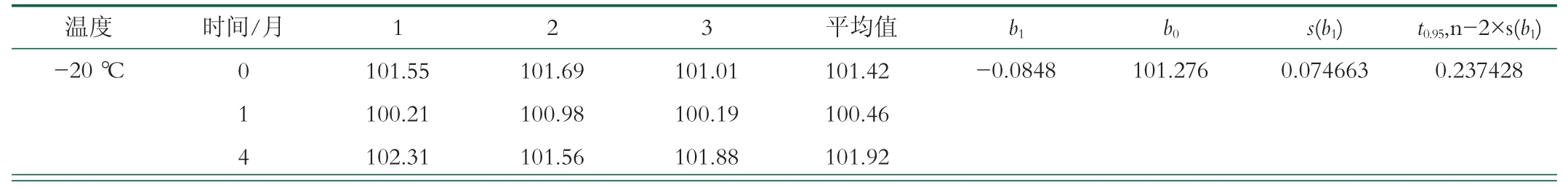
表3 羊奶冻干粉中恩诺沙星标准物质在长期稳定性评价结果 μg/kg
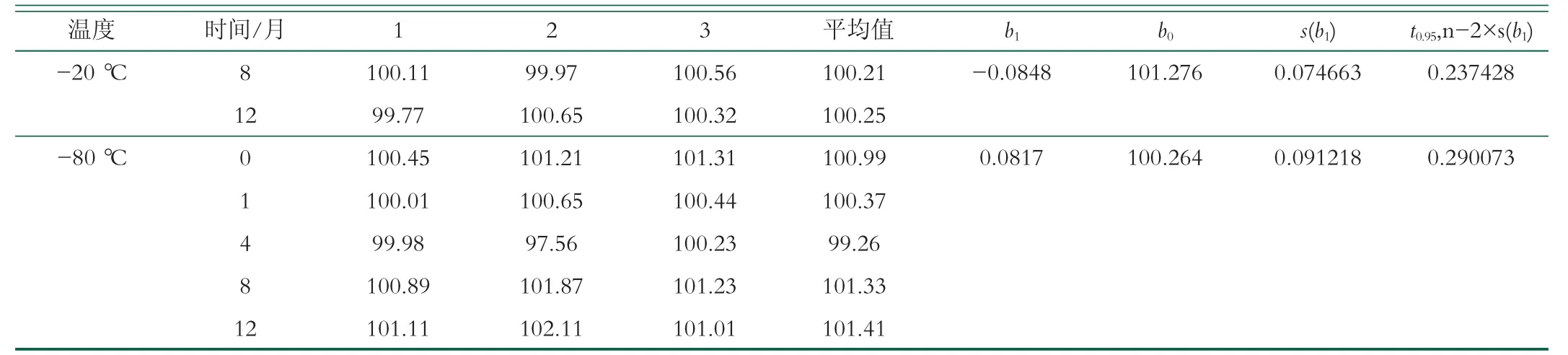
(续表3)
2.4 标准物质的定值
羊奶冻干粉中恩诺沙星标准物质的定值由8家具有相关资质的实验室协同定值[13]。各实验室均使用同一批次的恩诺沙星标准物质, 8家实验室分别对3个标准物质包装单元进行高效液相色谱法恩诺沙星含量检测, 每个样品重复检测3次[21-23], 对测得的8组数据先利用柯克伦(Cochran)准则判断这8组数据中哪一组为可疑数据, 然后利用狄克逊法(Dixon)对每组数据进行检验是否存在离群值, 如果存在, 可进行剔除, 数据经处理后余下的正常数据求其平均值[8]。定值结果见表4。
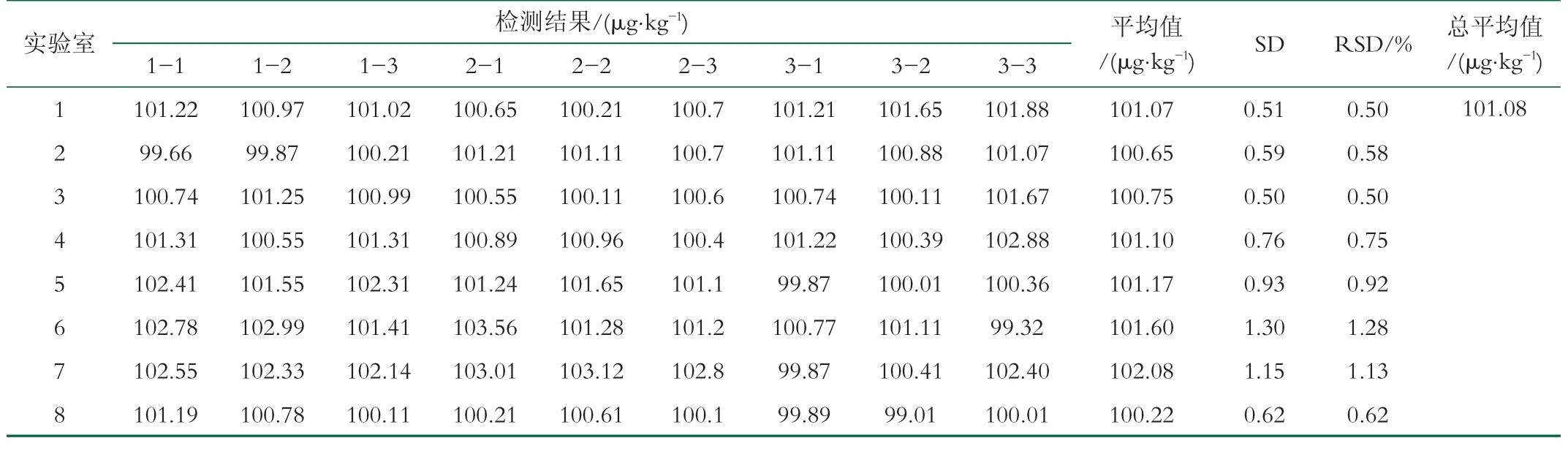
表4 羊奶冻干粉中恩诺沙星标准物质的定值数据
2.5 标准物质的不确定度评估
羊奶冻干粉中恩诺沙星标准物质的不确定度主要由三部分组成。第一部分是标准物质的不均匀性造成的不确定度;第二部分是标准物质的有效期内变动造成的不确定度;第三部分是定值过程中造成的不确定度。
2.5.1 标准物质的均匀性引起的不确定度

均匀性引起的相对不确定度:

2.5.2 标准物质的稳定性引起的不确定度
短期稳定性引起的不确定度:

2.5.3 标准物质的定值引起的不确定度
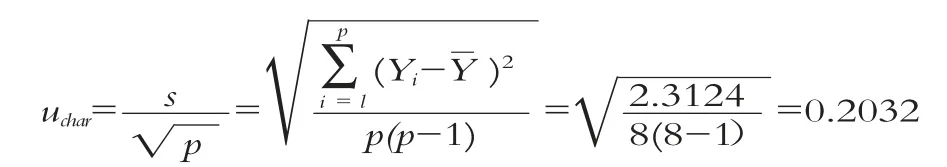
定值引起的相对不确定度:
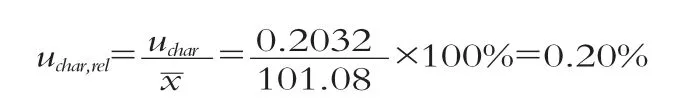
2.5.4 标准物质的合成不确定度
羊奶冻干粉中恩诺沙星标准物质的总不确定度uCRM由公式计算:

3 结论
在残留检测实验中, 一些药物与基质的实际结合方式并非简单的添加, 人为添加的方式始终是模拟药物与基质的天然结合, 在添加的过程中往往会受到一些因素干扰。本研究采用给药代谢的方式获得标准物质的候选物, 最大限度的保证了药物与基质本身的天然结合, 使得在进行药物残留检测时能够排除其他干扰因素, 获得的基体标准物质均匀性、稳定性良好, 通过8家有资质的实验室联合定值并对其不确定度进行评估, 最终得到其特征值为101.08±2.7μg/kg(k=2)。羊奶冻干粉中恩诺沙星基体标准物质的研制, 为恩诺沙星的检测提供了实物基体标准物质, 满足了恩诺沙星残留检测中质量控制和方法学验证的需求, 为检测结果的溯源性、可靠性和可比性提供了保障。

