骨髓间充质干细胞动员内源性干细胞修复放射性肠黏膜损伤的实验研究
薛小军 李冉冉 洪自强 叶磊 王少怡 孔丽青 周松
放射性肠炎(radiation enteritis,RE)是放射治疗和核辐射中常见的一种疾病。小肠黏膜上皮细胞由于增殖活跃,对放射线尤为敏感;同时放射线能损伤位于隐窝内的小肠干细胞 (intestinal stem cell,ISC),表现为ISC 数量减少和功能减退[1],导致RE 的发生快、程度重、修复困难。有研究显示,20% ~ 75%接受腹盆腔放疗的患者面临着RE 带来的痛苦[2-3],此外在核泄漏事故、核战争和核恐怖袭击中RE 也是最重要的并发症,而对于RE 目前尚无公认的有效治疗方法[4]。间充质干细胞 (mesenchymal stem cells,MSCs)具有多向分化潜能,在再生医学的应用中取得了很好的疗效。近年来,已有MSCs 治疗放射性肠炎的动物实验研究,但其在治疗中扮演的角色仍不清晰。本研究采用骨髓MSCs 移植治疗放射性肠炎的大鼠模型,观察小肠黏膜的修复情况,并探索MSCs 发挥作用的途径。
材料与方法
一、材料
20 只清洁级雄性SD 大 鼠,体质量为250 ~300 g [原南京军区福州总医院实验动物中心 (动物实验许可证号:SYXK (军)2017-0042)];Bmi-1 抗体[上海Abcam 贸易有限公司 (代理英国Abcam 公司)];4,6-二氨基- 2-苯基吲哚 (DAPI)检测试剂盒 (瑞士Roche 公司)。
二、方法
1.骨髓MSCs的分离、培养:选用4周龄的大鼠,断颈处死后,75%乙醇浸泡消毒20 min,在无菌条件下获取双侧胫骨和股骨,剪开骨端,用DMEM/F12培养液反复冲洗骨髓腔,将冲出的骨髓液以117×g离心5 min,弃上清液。沉淀物用10 %胎牛血清的DMEM/F12 重悬后,接种于25 cm2培养瓶中。置37 ℃、5 % CO2、饱和湿度恒温培养箱中培养,每日观察细胞贴壁情况,3 d 后首次换液,以后每2 ~ 3 d换液1 次,7 ~ 10 d 细胞生长融合,经0.25 %胰酶消化,1 : 2 或1 : 3 传代,选取生长良好的P3 代细胞进行后续实验。
2.骨髓MSCs 的鉴定:选取生长良好的P3 代细胞,胰酶消化重悬,PBS 洗涤2 次去除胰酶,分别加入PE 标记CD29、CD34、CD45、CD90 单克隆荧光抗体,并设立同型对照,室温避光孵育,应用流式细胞仪检测MSCs 的表面标志物。
3.RE 动物模型的建立:大鼠RE 模型的建立参照徐伟等[5]的研究完成。将大鼠采用10%水合氯醛溶液腹腔注射麻醉,然后将其固定于解剖板上进行辐照。辐照仪采用美国Rad-Source 公司的低剂量率生物辐照仪。实时照射剂量率为:1.5 Gy/min(160 kV,25 mA);照射范围:上至剑突,下至耻骨联合的5 cm×5 cm 的等效方形照射野。建模是否成功依据以下标准判断:动物烦躁、易激惹、攻击性强,或精神萎靡,摄食、摄水少,脱毛、腹泻、便血、体重不增或降低;小肠病理显示:隐窝细胞破坏,绒毛高度降低,黏膜萎缩,溃疡形成,甚至肠瘘形成。在前期实验中确定了造模良好的稳定性,成功率在90 %以上。建模成功后,大鼠随机分为骨髓MSCs 治疗组和对照组,每组10 只。每日观察大鼠的临床表现。所有实验均通过我院动物实验伦理委员会批准。
4.骨髓MSCs 移植:于动物模型建立后1 周开始进行MSCs 移植实验。移植前1 d,用DAPI 标记液标记MSCs,以进行示踪分析。移植时,用0.25 %胰酶、0.1 %EDTA 液常规消化,获得细胞悬液。反复离心、PBS 重悬洗涤,最后加入LG-DMEM 培养液,采用细胞计数板计数,制成1×106个 /mL 浓度的细胞悬液,无菌注射器分装,1 mL/支,置入冰盒中备用。在MSCs 备用时,要不断轻轻摇晃冰盒,防止细胞聚集和贴壁。MSCs 悬液通过尾静脉注射移植到大鼠体内。治疗组每只大鼠移植1 mL MSCs 悬液(1×106个/mL);对照组大鼠经尾静脉注射1 mL 生理盐水;每日1 次,连续3 次。
5.标本获取:移植后1 周处死大鼠,获取标本。采用10 %水合氯醛溶液腹腔注射麻醉。麻醉生效后,无菌组织剪沿腹中线将腹部剖开,暴露肠组织,截取距回盲部5 cm 的小肠组织。部分作快速冰冻,荧光显微镜下观察DAPI 阳性细胞;部分进一步处理,透射电镜观察小肠黏膜上皮细胞超微结构;其余小肠以10 %甲醛固定、石蜡包埋,待进一步实验使用。
6.骨髓MSCs 荧光示踪分析和小肠组织常规病理检测:小肠组织作快速冰冻切片,在荧光显微镜蓝色通道下观察DPAI 阳性细胞。小肠石蜡切片,HE染色,光镜下观察小肠结构。
7.小肠隐窝Bmi-1 阳性细胞的免疫组化染色:(1)空白的组织切片二甲苯脱蜡,柠檬酸盐抗原修复液高温高压组织抗原修复,在98℃条件下孵育20 min;(2)将切片置于0.25 % Triton X-100 溶液中孵育10 min,D-Hank's 缓冲液稍冲洗后山羊血清室温封闭30 min;(3)加入已经稀释的一抗,4 ℃过夜孵育;(4)Hank's 液洗片,加入HRP 偶联的二抗,37 ℃孵育1 h;(5)Hank's 液洗片,加入DAB 显色液室温下显色5 min;(6)流水冲洗,苏木素染液复染2 min;(7)返蓝,无水乙醇脱水,二甲苯透明,中性树胶封片。
8.小肠组织透射电镜观察:(1)取材:小肠切成1 mm×1 mm×2 mm 大小;(2)前固定:3 %戊二醛-1.5%多聚甲醛-0.1 mol/L PBS(pH 7.2) 4 ℃固定2 h 以上,然后漂洗3 次;(3)后固定:1%锇酸-1.5 %亚铁氰化钾4 ℃ 1.5 h,然后漂洗3 次;(4)脱水:50 %酒精10 min,70 %酒精饱和醋酸铀染液4 ℃过夜,90 %酒精10 min,90 %酒精-丙酮10 min,90 %丙酮10 min,无水丙酮10 min×3 次;(5)浸透:无水丙酮+环氧树脂618 包埋剂(1 : 1)1.5 h,纯618 包埋剂35 ℃ 3 h;(6)包埋、聚合:35 ℃ 12 h,45 ℃ 12 h,60 ℃ 3 d;(7)切片、染色:超薄切片机切成70 ~ 80 nm 切片;醋酸铀、柠檬酸铅分别染色5 min,蒸馏水水洗;(8)在透射电镜下观察并摄片。
三、统计学分析方法
采用SPSS 17.0 软件进行统计学分析。采用Image-Pro Plus 6.0 软件对小肠隐窝Bmi-1 阳性细胞数量进行分析。大鼠体重、小肠绒毛高度、隐窝Bmi-1 阳性干细胞数量以± s表示,组间比较采用t检验。以P< 0.05 为差异有统计学意义。
结 果
一、骨髓MSCs 的分离、鉴定、荧光染色
通过密度梯度离心的方法,成功分离得到大鼠骨髓MSCs,经过连续传代 (约3 代)之后,细胞呈现均一的长梭形,并显示出良好的贴壁生长的特性 (图1a)。经流式细胞仪测定表型均一 (图1c ~ f):表达间质细胞的标记 (CD29+、CD90+),不表达造血和内皮的标记 (CD34-、CD45-)。细胞采用DAPI 染色后呈蓝色(图 1b)。

图1 间充质干细胞的分离、鉴定、荧光染色结果
二、大鼠的一般情况
照射后大鼠出现弓背、脱毛、精神萎靡,进食、进水减少,腹泻、便血,体重逐渐降低;移植后1 周,与对照组相比,治疗组大鼠症状轻,体重 (190.30 g ±13.23 g 比235.00 g±14.30 g)增加,差异有统计学意义(t= -7.258,P< 0.001)(图2)。

图2 治疗组与对照组大鼠体重变化趋势
三、骨髓MSCs 的示踪
小肠组织快速冰冻切片后,荧光显微镜下观察,显示小肠组织中有蓝色荧光细胞,即 DAPI 阳性细胞(图3),证实MSCs 能够归巢至炎症损伤部位,在组织的损伤修复中发挥作用。

图3 荧光显微镜下观察骨髓间充质干细胞归巢至小肠(DAPI 染色,×200)
四、 小肠组织结构和绒毛超微结构变化
对照组小肠绒毛宽大低平,部分上皮溃烂、出血(图4a),治疗组小肠绒毛结构存在,无明显溃疡 (图4b)。与对照组相比,治疗组大鼠的小肠绒毛高度明显较高,差异具有统计学意义(t= -15.266,P< 0.05;表1)。
电镜分析:治疗组上皮细胞微绒毛修复较完整,排列整齐,细胞结构清晰;对照组肠上皮细胞空泡变性,粗面内质网扩张,线粒体轻度肿胀,部分杯状细胞排空,间质水肿伴炎症细胞浸润 (图5)。
五、小肠隐窝Bmi-1 阳性细胞数量分析
与对照组相比,治疗组Bmi-1 阳性细胞数量增多,差异有统计学意义(t= -7.612,P< 0.05;表1、图6)。

图4 光学显微镜下观察对照组和治疗组小肠组织 (HE染色,×100)
表1 对照组和治疗组大鼠小肠绒毛高度及Bmi-1 阳性细胞数结果分析 ( ± s)

表1 对照组和治疗组大鼠小肠绒毛高度及Bmi-1 阳性细胞数结果分析 ( ± s)
分组 例数 绒毛高度(μm) Bmi-1 阳性细胞(个/mm2)对照组 10 627.50±40.55 60.67±9.63治疗组 10 984.33±61.80 87.33±5.47 t 值 -15.266 -7.612 P 值 < 0.001 < 0.001
讨 论
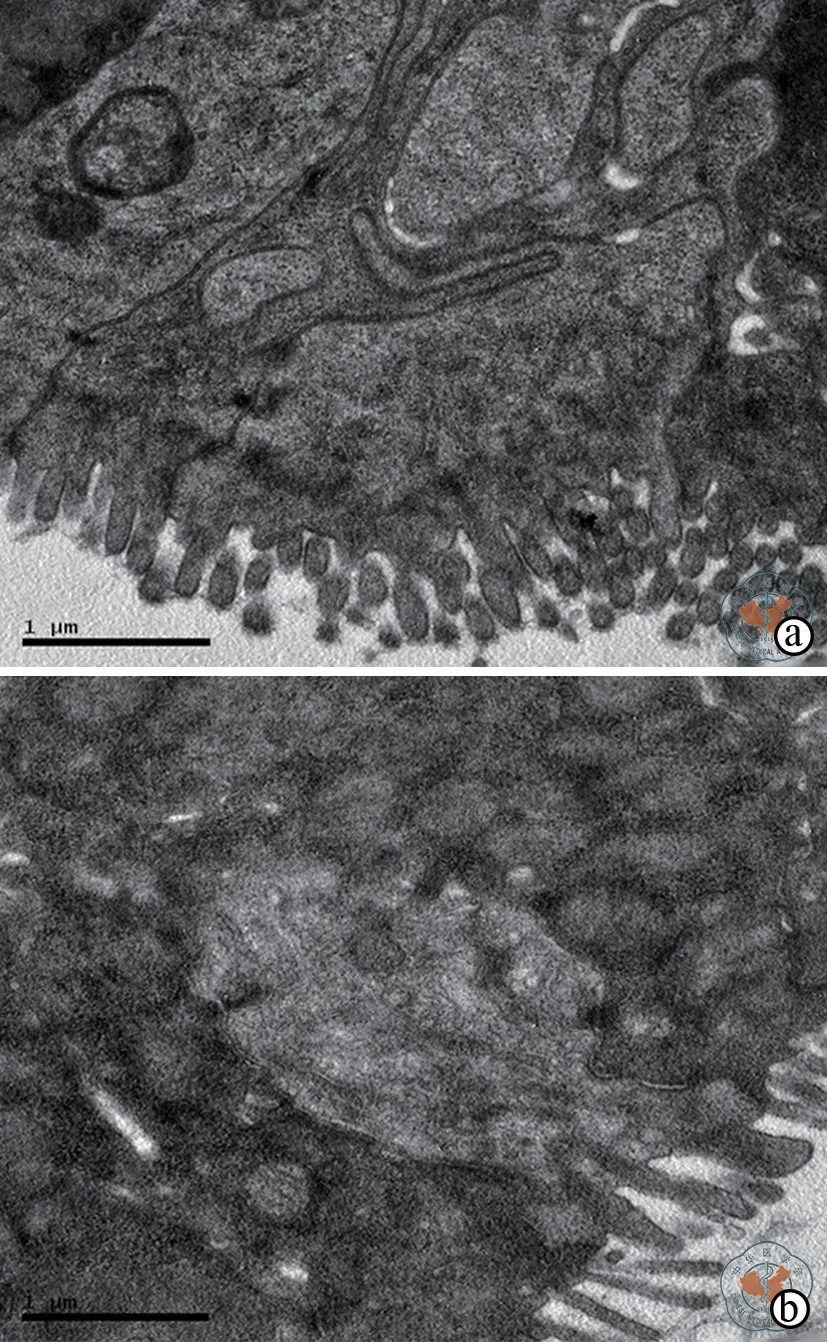
图5 电镜下观察对照组和治疗组小肠上皮组织 (×4 000)
RE 是腹盆腔恶性肿瘤患者接受放疗后的常见毒性反应,其发病机制涉及多种细胞的相互作用、机体的免疫反应、肠道神经系统和肠道微生物[6];由于治疗效果欠佳,给患者带来极大的创伤。一般认为,肠上皮细胞和血管内皮细胞损伤、肠壁炎症反应在疾病的发生、发展和转归中起着重要的作用。急性期表现为肠黏膜炎症反应,慢性期表现为肠缺血、纤维化。
MSCs 是一种多能干细胞,其来源广泛、分离提纯方便、易于体外培养,具有低免疫源性和多向分化潜能的特性。体外实验证实,MSCs 可分化为肠上皮细胞;动物实验表明,MSCs 可归巢至受损的肠黏膜。本实验研究中采用DAPI 标记MSCs,移植后在受损肠组织内观察到蓝染的MSCs,显示出MSCs 归巢至炎症组织的特性。MSCs 修复肠黏膜的机制包括:(1)直接分化为肠上皮细胞[7];(2)分化为血管内皮细胞,促进血管的修复[8];(3)通过自分泌、旁分泌的机制产生多种细胞因子,发挥免疫调节的作用[7-9]。目前,MSCs 在Crohn's 病的临床治疗中显示出令人满意的效果,并且安全性也较好[10-11]。
ISC 位于肠黏膜隐窝基底部,是一种具有自我更新能力和高度增殖能力以及多向分化潜能的成体干细胞,包括2 个亚群:Lgr-5+亚群和Bmi-1+亚群。ISC 能够增殖分化为多种细胞,其中包括上皮细胞,对肠道黏膜更新、修复起着重要的作用,因此如何恢复照射后肠壁中ISC 的数量和功能成为治疗RE 的关键。马发鑫等[12]将炎症诱导的骨髓MSCs 条件培养基经尾静脉注射到急性辐射诱导的肠损伤模型大鼠体内,发现Lgr-5+亚群和Bmi-1+亚群增多,并认为Bmi-1+亚群可能通过分化为Lgr-5+亚群发挥作用。本研究采用MSCs 经尾静脉移植治疗RE 模型的大鼠,发现其可以归巢至受损的肠道,修复受损肠黏膜。在小鼠的RE 模型中,Saha 等[13]也证实,接受MSCs 移植治疗的小鼠肠隐窝内Lgr-5+亚群干细胞表达数量增加。MSCs 可以在损伤局部释放细胞因子和生长因子组成ISC 生存的微环境,并诱导ISC 向绒毛顶端迁移[14]。有研究指出,Wnt /β-连环蛋白信号通路在ISC 的增殖和维持扮演至关重要的角色[15-16]。Gong 等[17]采用MSCs 治疗14 Gy 腹部照射制作的RE 动物模型,发现小肠组织中Lgr- 5+亚群的数量及隐窝的数量均有增加,另外Wnt3a 和活化β-连环蛋白表达量也明显增加;结果证实,MSCs 能够促进内源性ISC 的生长,从而促进小肠黏膜的修复,其作用的分子机制与Wnt /β-连环蛋白信号通路的活化增加有关。另外在炎症性肠病的动物模型中发现,MSCs 对肠道微生物的多样性发挥促进作用[18],进一步促进肠黏膜的修复;MSCs 能通过抑制Rho/MRTF/SRF 信号通路抑制肠道纤维化[19],从而防止纤维组织过多增生引起肠道狭窄。
本研究中将骨髓MSCs 采用DAPI 标记后移植到RE 模型的大鼠体内,观察ISC Bmi-1+亚群的增殖情况,结果发现Bmi-1+亚群数量增多,受损的肠黏膜得以修复。本研究推测MSCs 可能通过促进ISC 的增殖发挥作用,或者在局部微环境下MSCs 可转化为ISC,从而进一步发挥修复作用。

