低强度超声对HeLa肿瘤细胞凋亡的诱导作用及其机制
廖欣 顾一平 廖薇
子宫颈癌是全球女性中第二大常见的癌症,据统计,在全球范围内,子宫颈癌每年新增病例大约528 000 例,因为子宫颈癌而死亡的病例约为266 000 例[1]。虽在利用药物、手术、化疗和放疗等联合治疗手段对子宫颈癌的治疗方面取得了很大的进展,但是与其他类型的癌症相比,子宫颈癌治愈后的5年内仍可能会出现复发和转移的情况,数据显示其复发率约为34%[1]。近年来,在利用超声技术治疗肿瘤方面取得了一定的进展。
一系列研究表明,与正常细胞相比,恶性细胞更容易被超声杀死。低强度超声在无坏死情况下诱导细胞凋亡,为细胞凋亡治疗提供了一种新的方法[2]。低强度超声在体外作为诱导细胞死亡的一种形式,具有诱导细胞凋亡的优势,一些途径通过中介相互关联,可以阐明整个机制[3]。在细胞凋亡级联过程中,虽然分子信号通路是由低强度超声独立触发的,但其发展与关键蛋白密切相关。结果表明,不同参数的超声可通过caspase-12、Bcl-2、survivin 等信号通路诱导细胞凋亡。survivin 可抑制使细胞发生凋亡的系列蛋白活性,其可以与被激活的caspase-3、caspase-7 和caspase-9 结合,从而抑制它们的活性。survivin 作为凋亡蛋白的抑制剂,可以通过抑制下游的caspase-3 和caspase-7,阻断多种caspase 激活途径的汇聚点,从而达到抑制因各种刺激被诱导细胞发生凋亡现象的作用[4]。survivin siRNA 微泡造影剂联合超声治疗可有效抑制survivin 表达并诱导细胞凋亡。这些结果表明survivin 可能参与了超声诱导的细胞凋亡[5-8]。因此本文以HeLa 肿瘤细胞为研究对象,研究与凋亡相关的蛋白caspase-12 和survivin 在低强度超声诱导HeLa 肿瘤细胞凋亡中的作用,以期为诱导恶性细胞死亡、癌症治疗技术的探索提供理论依据。
材料和方法
一、实验材料
1.细胞系:HeLa 细胞 (中国科学院上海生物化学与细胞生物学研究所)。
2.主要材料和试剂:10%的胎牛血清 (美国Amersco 公 司),100 U/mL 青霉素 和100 μg/mL 链霉素(德国Sigma 公司),2',7'-二氯荧光素二乙酸酯(DCFH-DA) (美国Molecular Probes 公司)。
3.主要仪器:低频超声治疗仪 (中国深圳迈瑞公司,L14- 6WE 探头) (有效直径为3 cm,功率为0.1 ~2.75 W/cm2),耦合剂 (中国深圳迈瑞公司),荧光板读数器 (美国Millipore Corp.公司),BX40 光学显微镜(日本Olympus 公司),流式细胞术 (美国Beckman公司),细胞凋亡检测试剂盒 (美国Life Technologies公司),Quest 软件 (美国BD 公司)。
二、细胞培养和超声干预处理
HeLa 细胞培养在有10 % 的胎牛血清,100 U/ mL 青霉素和100 μg/mL 链霉素的细胞培养基中,并放置在温度为37 ℃,CO2含量为5 %的恒温孵育箱中。将细胞每3 天分裂1 次,待细胞处于对数生长期时进行后续实验。
将HeLa 肿瘤细胞接种于6 孔板内,接种密度为0.5×106/mL,待细胞处于对数生长期,且细胞活力 > 95%,待满80 % ~ 90 %时将其分为阴性对照组(切断电源后给予假的超声干预)、0.5、1.3、2.0 W/ cm2超声干预组。将超声探头垂直固定于6孔板底部 (底面积9.5 cm2),其间加用耦合剂填充以隔绝外界空气的影响。超声处理频率均设置为1 MHz,工作周期为25 %,细胞干预时间为1 min,阴性对照组切断电源予以假超声干预。待各组细胞经过低强度超声干预完成后,于恒温箱孵育6 h 后,将每个培养皿中的废培养基取出,把细胞进行冷冻保存,以备进行后续的细胞活力、细胞凋亡、caspase-12蛋白、survivin 蛋白表达的测定。
三、检测指标和检测方法
1.细胞活力的测定:采用MTT [3-(4,5-二甲基噻唑-2-酰基)-2,5-二苯-四唑溴胺]法测定细胞活力。用新鲜培养基洗涤细胞并在96 孔板(1×105细胞/mL)中培养,然后与30 μg/mL 异甘草素孵育24 h。孵育后,吸出培养基,补加10 μL含有5 mg/mL MTT 的新鲜培养基。4 h 后,去除培养基,用溶解在100 μL 的二甲基亚砜 (DMSO)中的蓝色甲瓒晶体代替。使用荧光板读数器在570 nm 处测定吸光度,将数据用细胞活力的百分比(与空白对照相比)表示。
2.细胞形态特征分析:用台盼蓝染料排除试验以检查细胞活力。用BX40 光学显微镜用苏木精-伊红染色检查凋亡细胞的形态变化。根据制造商的方案,荧光素异硫氰酸酯标记的膜联蛋白V 在流式细胞术中用作荧光探针以检测细胞膜上的磷脂酰丝氨酸暴露作为早期凋亡的典型标记30。使用由Li等[9]引入的二苯胺试剂定量从经历DNA 片段化的细胞中提取DNA 的量。通过流式细胞术测量显示低Δψm 的细胞部分。对于单线态氧和羟基自由基的活性氧清除,将2.0×106个细胞在含有10 mmol/L L-组氨酸和100 mmol/L 甘露醇的培养基中于37 ℃温育1 h,然后暴露。然后,分别通过低强度超声以0.5、1.3、2.0 W/cm2处理细胞1 min,并在37 ℃下在含有5 %二氧化碳的潮湿空气中孵育6 h,然后观察并拍照。
3.细胞存活率的测定:细胞存活率采用前文所述的MTT 法进行测定,细胞经超声处理,然后孵育24 h,在570 nm 处测定其吸光值。细胞存活率计算公式为:细胞存活率= (超声处理组的吸光值/空白对照组的吸光值)×100。
4.细胞结构观察:利用透射电镜在×600 下对阴性对照组和0.5、1.3、2.0 W/cm2超声干预组细胞进行观察并拍照。
5.细胞凋亡率检测:为了观察超声诱导后的细胞的凋亡情况,根据制造商的说明用Annexin V-FITC/碘化丙啶 (PI)细胞凋亡检测试剂盒对细胞的凋亡率进行分析和测定。将细胞通过超声干预并孵育24 h 后,用PBS 洗涤2 次,并将细胞重悬于500 μL 含 有5 μL膜联蛋白V-FITC 和10 μL 的PI 的结合缓冲液中,接着在黑暗环境中孵育15 min。然后使用具有细胞Quest 软件的流式细胞术来检测凋亡细胞的百分比。
6.ROS 含量测定:用流式细胞术测定ROS 的产生。细胞经超声干预并孵育6 h 后,用PBS 洗涤2 次,重新悬浮于含有荧光探针,2',7'-二氯荧光素二乙酸酯 (DCFH-DA)的500 μL 缓冲液中,使得最终浓度为5 mmol/L,然后在37 ℃的温度下避光孵育30 min。然后使用流式细胞术检测激发波长为480 nm 的荧光,实验至少重复进行3 次。
7.Western blot:采用蛋白裂解缓冲液分别裂解四组细胞抽提总蛋白;采用蛋白测定试剂盒检测总蛋白的浓度,以牛血清蛋白 (bovine serum albumin,BSA)作为标准品,经分光光度计检测562 nm 处吸光度A值,绘制标准曲线后,根据各待测蛋白稀释孔的A562 平均值确定出待测蛋白的浓度。将4 组的蛋白样品调至相同浓度后按照每孔40 μg 含量上样,经10%聚丙烯酰胺凝胶电泳分离后转至PVDF 膜上,在蛋白marker 35kDa 处将膜剪开,5%脱脂牛奶封闭后,35kDa 以上的pvdf 膜加入一抗caspase(1:1 000)和β-actin (1:400)共同孵育,35kDa 以下加入一抗survivin (1:1000)。孵育过夜后加入相应辣根过氧化物酶结合的二抗 (工作浓度1:5 000)。采用ECL 化学发光试剂盒检测杂交信号,扫描成像并用Quantity One 软件测量灰度值分析结果。
四、统计学分析方法
采用SPSS20.0 统计软件进行统计学分析,细胞活力、存活率、凋亡率,细胞中ROS 含量、caspase-12蛋白和survivin 蛋白的结果均表示为± s,多组间比较采用单因素方差分析,各个实验组与对照组比较采用Dunnet-t检验。以P< 0.05 为差异有统计学意义。
结 果
一、MTT 法检测低强度超声干预对HeLa 肿瘤细胞活力、细胞存活率及凋亡率影响
与阴性对照组比较,0.5、1.3、2.0 W/cm2超声干预组的HeLa 肿瘤细胞活力、细胞存活率均降低,细胞凋亡率上升,差异具有统计学意义 (P均 < 0.05,表1)。
表1 Hela 肿瘤细胞活力、细胞存活率及凋亡率比较 (%, ± s)

表1 Hela 肿瘤细胞活力、细胞存活率及凋亡率比较 (%, ± s)
注:与阴性对照组比较,aP < 0.001
分组 实验重复次数 细胞活力 细胞存活率 细胞凋亡率阴性对照组 3 99.23±1.56 99.91±1.51 4.23±1.21 0.5 W/cm2 超声干预组 3 80.52±1.72a 76.69±1.92a 24.16±1.91a 1.3 W/cm2 超声干预组 3 54.31±1.69a 52.57±1.63a 48.34±1.66a 2.0 W/cm2 超声干预组 3 27.75±1.26a 29.81±1.22a 70.27±0.98a F 值 1185.004 1087.433 1121.252 P 值 < 0.001 < 0.001 < 0.001
二、HeLa 肿瘤细胞细胞形态特征及结构测定结果
各组细胞显微镜及透射电镜下观察,结果均显示未经低强度超声干预的细胞呈现完整的状态,随着超声强度的增强,细胞逐渐溶解 (图1 ~ 2)。
三、低强度超声干预对HeLa 肿瘤细胞ROS 含量、caspase-12 和survivin 蛋白表达的影响
与阴性对照组比较,0.5、1.3、2.0 W/cm2超 声干预组的survivin 蛋白表达均降低,ROS 含量、caspase-12 蛋白表达升高,差异有统计学意义(P<0.05,表2、图3)。
讨 论
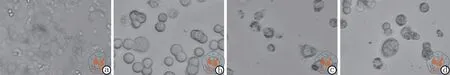
图1 光学显微镜下观察超声干预对细胞形态的影响 (苏木精-伊红染色,×40)

图2 透射电镜下观察超声干预对Hela 肿瘤细胞结构 (×600)
表2 不同超声强度干预对Hela 肿瘤细胞中caspase-12 蛋白和survivin 蛋白表达水平的影响( ± s)

表2 不同超声强度干预对Hela 肿瘤细胞中caspase-12 蛋白和survivin 蛋白表达水平的影响( ± s)
注:与阴性对照组比较,aP < 0.05
分组 实验重复次数 ROS 含量 caspase-12 蛋白 survivin 蛋白阴性对照组 3 11.21±0.45 13.05±0.21 51.19±0.21 0.5 W/cm2 超声干预组 3 24.34±1.23a 20.23±0.19a 43.46±0.34a 1.3 W/cm2 超声干预组 3 38.26±2.47a 33.17±0.32a 25.28±0.29a 2.0 W/cm2 超声干预组 3 52.18±1.56a 41.52±0.21a 18.32±0.31a F 值 365.400 8634.002 8034.149 P 值 < 0.001 < 0.001 < 0.001

图3 低强度超声干预对Hela 肿瘤细胞中caspase-12、survivin 蛋白表达的影响
细胞凋亡是指细胞为了维持内环境的稳定,由基因控制的细胞进行自主的有序的死亡。它是一个主动的过程,凋亡过程中会涉及到一系列基因的激活、表达以及调控;它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。在多种恶性肿瘤细胞中,凋亡通路的废除是由基因畸变和失调通路的复杂相互作用引起的。细胞的存活需要细胞凋亡的减少,而细胞凋亡是通过抑制促凋亡因子而发生的。诱导细胞凋亡的途径主要有两种:一种是外部途径,即死亡受体通过与死亡配体连接,随后是受体分子的重建和caspase-8 或caspase-10 的激活;另一种是内部途径,线粒体中的细胞色素c 释放后会触发由Apaf- 1、pro-caspase-9、dATP 和细胞色素c 组成的凋亡体系[6-8,10]。而在本研究中,低强度超声干预可以诱导恶性肿瘤细胞凋亡,从而达到治疗效果,但是低强度超声诱导恶性肿瘤细胞时,恶性肿瘤中与凋亡相关的蛋白的作用机制并不明确[11-12]。本实验以HeLa 肿瘤细胞为研究对象,将Hela 肿瘤细胞经不同强度的超声 (0.5、1.3、2.0 W/cm2超声干预)诱导后,发现HeLa 肿瘤细胞随超声强度的增加活力和存活率均呈现显著的下降趋势 (P< 0.05),并且细胞的凋亡率呈现显著的上升趋势 (P< 0.05)。细胞内ROS 的积累也随超声强度的增加出现了显著的增加(P< 0.05),初步判断出现这种现象的原因是与凋亡相关的蛋白的表达有关。
有报道显示,caspase-12、survivin 等与凋亡相关的蛋白在细胞凋亡中发生了巨大的作用[13-14]。caspase 蛋白与细胞凋亡密切相关,并且参与了细胞的生长、分化和凋亡的调节,caspase 家族成员有很多,其中caspase-1、caspase-4 和caspase-11 不直接参与凋亡信号的转导,它们主要是参与白介素前体的活化;而caspase-2,caspase-8,caspase-9 和caspase-10 在细胞凋亡的起始阶段起作用,参与细胞凋亡执行的则是caspase-3,caspase-6 和caspase-7,其中caspase-3 和7 具有相近的底物和抑制剂特异性。前期研究表示,超声诱导细胞后,caspase-12蛋白的表达随着超声强度的增大而增加,使得caspase-12 蛋白得以稳定表达,caspase-12 蛋白的激活间接激活了caspase-3 蛋白的表达,从而使细胞发生凋亡[15-16]。survivin 是凋亡抑制剂家族的一员,是细胞增殖及细胞动力学等生理功能的调节因子。它不仅参与抑制细胞凋亡、血管生成和应激反应,而且参与组织稳态和细胞再生能力。survivin 具有高度的组织特异性,在结肠直肠癌和溃疡性结肠炎中均有高表达,是一种良好的诊断标志物[17-18]。此前有多项研究表明,survivin 通常在正常细胞中含量较低,但在许多实体癌和血癌中含量较高,survivin在癌症中的表达会增强,与肿瘤侵袭转移增加有关。survivin 作为线粒体相关凋亡的上游调控因子,表达survivin 的内皮细胞可降低caspase-7。由于survivin 的特性,通常将其作为一种通过促进细胞凋亡来治疗癌症的方法[19-20]。
本研究以HeLa 肿瘤细胞为研究对象,通过采用Western blot 测定凋亡相关蛋白caspase-12 和survivin 在低强度超声诱导HeLa 肿瘤细胞凋亡中的表达情况,发现caspase-12 的表达随着超声强度的增加而增加,与β-actin 表达趋势近似,而survivin 的表达随着超声强度的增加而下降,推测,HeLa 肿瘤细胞在被低强度超声干预的过程中,促进了caspase-12 的表达,间接激活了执行细胞凋亡的caspase-3 的表达,抑制了起凋亡抑制剂作用的survivin 的表达,从而促进了细胞的凋亡。
综上所述,低强度超声可能通过诱导HeLa 肿瘤细胞中caspase-12 蛋白表达增加和survivin 蛋白表达的减少而使HeLa 肿瘤细胞发生凋亡。

