我国干细胞临床研究现状分析、政策回顾及展望
项楠 汪国生 厉小梅
干细胞是一类具有自我更新能力和高度分化潜能的细胞,根据其发育阶段的不同又可以分为胚胎干细胞和成体干细胞。胚胎干细胞主要来源于受精卵发育成囊胚过程的内层细胞团,而成体干细胞来源于成年动物或人体组织或器官,如间充质干细胞、造血干细胞、脂肪干细胞和神经干细胞等[1-2]。干细胞治疗是将人自体或异体来源的干细胞,通过分离、体外培养和诱导分化等过程再植入人体从而实现对临床疾病的治疗。干细胞研究是近年来生命科学领域的前沿和热点[3],随着干细胞研究的不断深入,干细胞治疗也成功应用于一些疾病的治疗并取得了较好的效果,尤其是在自身免疫性疾病、关节软骨修复、糖尿病和退行性疾病等领域[4]。各国政府加大投入用于干细胞及其转化医学研究,期望干细胞研究能够产生革命性的可供临床应用的产品和疗法,为一些疑难复杂的疾病提供新的治疗策略,解决医学难题,实现巨大的社会效益和经济效益[5]。本文描述国内外干细胞临床研究的现状及趋势,回顾我国在干细胞管理方面政策的演变,分析我国干细胞临床研究的备案情况及目前存在的问题,为我国干细胞临床研究的进一步发展提供文献参考。
一、国内外干细胞临床研究现状及趋势
(一)干细胞临床研究国内外发展现状
由于干细胞研究及产业的广阔前景,欧美、韩国及日本等发达国家和地区均将干细胞研究提升为国家科技发展的重要战略,在干细胞的基础研究和临床应用方面投入了大量的研究经费,全球超过700 家公司正在开展干细胞及转化医学相关的研究,我国政府也自上世纪90年代后期逐渐加大了干细胞研究的投入[6-7]。截至2019年底全世界在美国临床试验注册中心 (clinicaltrials.gov)和世界卫生组织临床试验登记平台 (International Clinical Trials Registry Platform,ICTRP)上登记的干细胞临床研究已经超过7 000 项,美国在全球范围内开展的干细胞临床研究数量最多,欧盟和中国的研究数量仅次于美国。使用Innography 统计全球干细胞的专利情况,美国共申请5 418 件,居全球首位,中国和世界知识产权组织紧随其后,分别为4 843 件和4 094 件[8]。干细胞领域的基础和应用研究成果的数量也在逐年增加,在Web of science 的MEDLINE 数据库中按照 “stem cell” 为主题词进行检索发现,2010 ~ 2019年全球发表的干细胞研究相关文章数共计220 675 篇,其中我国发表的文章数量共计37 522 篇,占17.0%。2019年全球发表干细胞研究相关文章共25 653篇,我国发表文章数为5 994 篇,占23.4%。全球范围及我国干细胞研究文章的数量均呈现逐年增加的趋势(图1)。

图1 PubMed 收录的干细胞研究相关文章年份分布
(二)干细胞治疗药物国内外发展现状
在干细胞治疗药物方面,2009年欧盟批准了首个上市的干细胞治疗药物,随后美国、澳大利亚、韩国和加拿大相继有干细胞药物上市,截至目前全球已经批准了25 种干细胞治疗药物(表1)。除了已上市产品外,截至目前已有较多干细胞治疗产品进入Ⅱ/Ⅲ期临床试验,预计未来5 ~ 10年还会有多个治疗疑难疾病的干细胞产品上市[9]。美国市场研究公司Grand View Research 发布的干细胞市场规模分析报告显示(2019 ~ 2025年),2018年全球干细胞市场规模约86.5亿美元,预计未来6年将以8.8%的复合年增长率增长。我国目前尚无已上市的干细胞治疗药物,但自2018年6月以来国家药品监督管理局重启干细胞疗法的临床注册申请,目前已有11 款间充质干细胞新药注册申报获得受理,治疗的疾病包括:膝骨关节炎、糖尿病足溃疡、移植物抗宿主病、慢性牙周炎、缺血性卒中、难治性系统性红斑狼疮及类风湿关节炎。
二、我国干细胞临床研究的监管现状和政策回顾
由于干细胞疗法的风险和不确定性,这给干细胞的监管提出了很大的挑战,我国在干细胞临床研究的管理方面也出现了多次政策的变动。
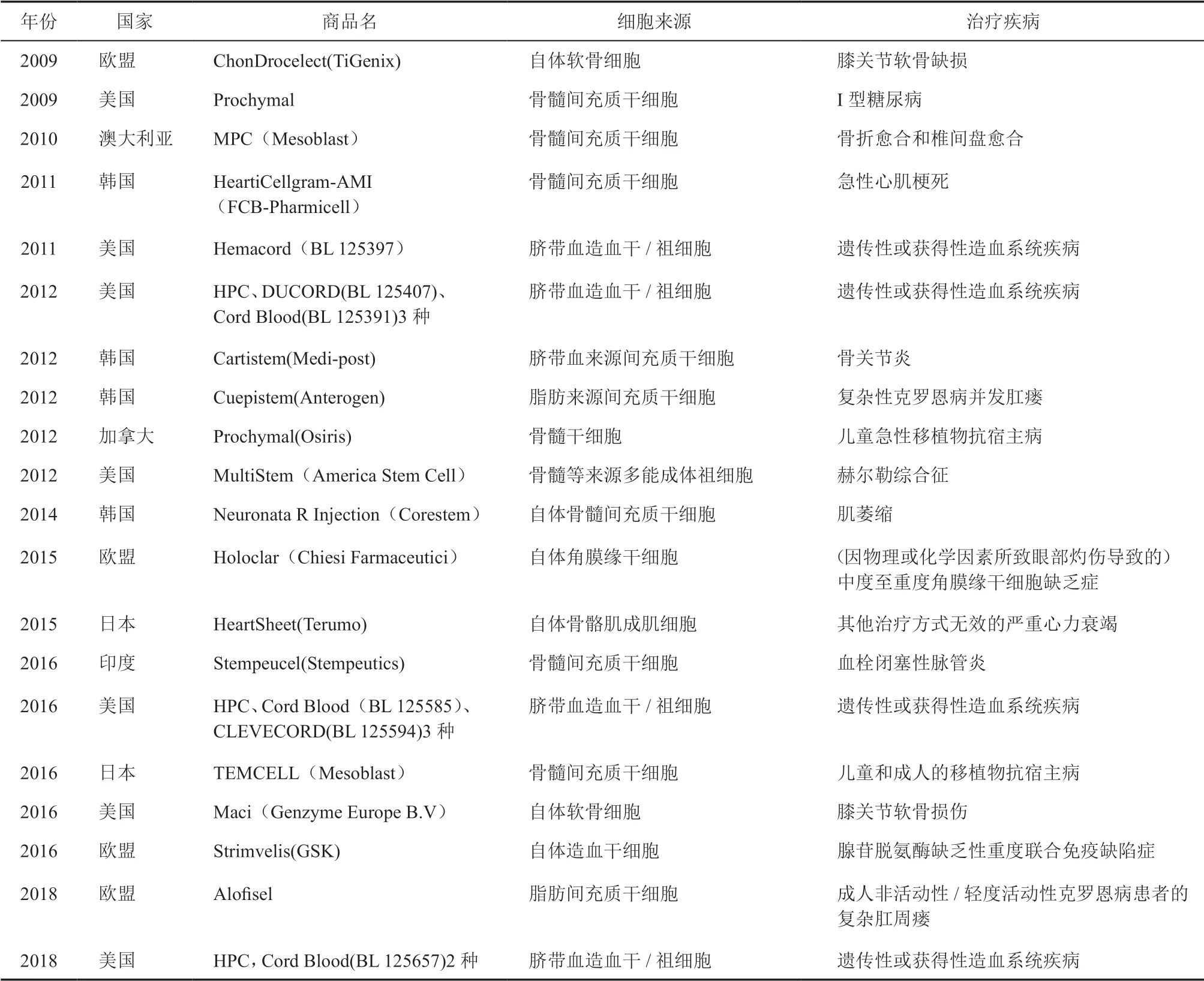
表1 全球已批准的干细胞治疗药物
(一)干细胞临床研究初步探索
上世纪90年代我国开始了对干细胞临床应用的管理,1993年5月原卫生部颁布了《人的体细胞治疗及基因治疗临床研究质控要点》,将人的体细胞治疗及基因治疗的临床研究纳入《药品管理法》的法制化管理。2003年国家食品药品监管局相继发布了《人体细胞治疗研究和制剂质量控制技术指导原则》和《药物临床试验质量管理规范》,规定了细胞制剂的质量控制标准,同时对细胞治疗类产品的研发与注册进行了指导。在这一阶段国内政策支持干细胞临床研究及应用,监管较为宽松,我国进行了较多的干细胞临床应用,全国范围内有近300 家医院和机构开展干细胞治疗[10]。这一阶段我国干细胞临床研究和应用十分不规范,也暴露出了很多问题,这一现象也受到了国外学者的抨击,2009年5月《自然》杂志刊登了标题为“中国干细胞治疗乱象”的文章[11]。国家干细胞工程技术研究中心主任韩忠朝表示干细胞治疗的混乱局面主要表现在包治百病、费用高昂、资质缺失和质量失控这4 个方面[12]。
(二)干细胞临床研究趋于严格
2009年3月卫生部颁布《医疗技术临床应用管理办法》[13],对医疗技术实行分类、分级管理。自体干细胞和免疫细胞治疗技术、异基因干细胞移植技术属于涉及重大伦理问题,安全性和有效性尚需经规范的临床试验研究进一步验证的第三类医疗技术。国家监管部门虽然将干细胞技术纳入需要卫生行政部门加以严格控制管理的医疗技术,但是干细胞治疗乱象并没有得到有效的遏制。为打击这些干细胞违规应用行为,2011年12月原卫生部和国家食品药品监督管理局开展了为期一年的自查自纠和规范整顿工作,未经过批准的干细胞临床研究和应用必须停止[14]。
(三)干细胞临床研究进一步规范
2015年5月国家卫生计生委取消了第三类医疗技术临床应用准入审批[15],自体干细胞和免疫细胞治疗技术不在限制临床应用的医疗技术 (2015 版)目录内,应按照临床研究进行管理。针对干细胞研究和应用中出现的高收费、制剂制备标准不一致、存在质量缺陷、伦理审查和知情同意缺乏等一系列问题,2015年7月,我国首个干细胞临床研究管理的规范性文件——《干细胞临床研究管理办法 (试行)》[16](以下简称《办法》)出台,明确了干细胞临床研究不得收费,开展的主体必须是三甲医院、具备药物临床试验机构资质和干细胞临床研究条件。之后国家卫计委又对干细胞制剂质量控制和干细胞临床研究机构的备案作出了明确的规定[17-18]。近几年来国家级主管部门及地方陆续颁布多项扶持政策,干细胞科学研究和应用产业迎来新的发展机会 (表2)。
(四)干细胞临床研究成果显现
《“十三五”国家基础研究专项规划》提出要加强干细胞转化研究,自2016年起国家重点研发计划“干细胞及转化研究”试点专项启动,截至2019年共立项121 项,资助金额共计23.8 亿元 (图2)。项目资助总金额排名前5 位的牵头单位分别为中国科学院动物研究所、同济大学、北京大学、中山大学和中国科学院广州生物医药与健康研究院。在干细胞及转化研究项目的资助下,我国在干细胞研究领域也取得了显著的成果,例如:2017年北京大学邓宏魁研究组在国际上首次建立了具有全能性特性的多能干细胞,研究结果发表在Cell 杂志上[34];2019年中国科学院动物研究所刘峰课题组利用多重转录组测序的方法,绘制了扩增性造血器官的3D转录组图谱,研究结果发表在Cell Reports 杂志上[35]。

图2 2016 ~ 2019年国家重点研发计划 “干细胞及转化研究”试点专项立项分布
四、我国干细胞临床研究备案情况
(一)干细胞临床研究机构备案情况
医疗机构是干细胞临床研究的主体,为落实主体责任、加强机构管理,国家卫生计生委和食品药品监管总局下发了《关于开展干细胞临床研究机构备案工作的通知》[18],第一批共有30 家医疗机构通过了备案,2017年初军委后勤保障部公布首批12 家军队医院通过了备案,2017年11月23日国家卫生计生委和食品药品监管总局公布了第二批备案机构名单,共有72 家医疗机构通过了备案,2019年又有6 家干细胞临床研究机构完成备案,至此已完成备案的医疗机构共计120 家。非军队医院中,广东省通过备案的医疗机构最多,其次为北京和上海 (图3)。
(二)干细胞临床研究项目备案情况
截止2020年3月,全国有75 项干细胞临床研究项目在国家医学研究登记备案信息系统登记,其中包括5 项干细胞治疗新型冠状肺炎的临床研究项目。研究项目涉及的干细胞类型以成体干细胞为主,共计66 项 (88.0%),胚胎干细胞共9 项 (占12.0%)。成体干细胞临床研究项目中间充质干细胞50 项 (占75.8%),脂肪干细胞5 项(占7.6%),神经干细胞4 项 (占6.1%),上皮干细胞3 项 (占4.5%),骨髓干细胞2 项 (占3.0%),肺脏干细胞2 项 (占3.0%)。按照国际疾病分类标准第10 版 (ICD-10)对干细胞临床研究方案涉及的疾病领域进行分类,以消化系统疾病和泌尿生殖系统疾病最多 (各占14.7%),再次为呼吸系统疾病 (占10.7%),见图4。干细胞临床研究的疾病种类主要包括溃疡性结肠炎、卵巢功能不全、骨关节炎、狼疮肾炎、银屑病、脊髓损伤和急性心梗等。

表2 2016年后发布的关于干细胞研究的相关政策文件
五、我国干细胞临床研究存在的问题
(一)干细胞临床研究的伦理审查需要进一步加强

图3 通过备案的干细胞临床研究机构省份分布

图4 干细胞临床研究备案项目专业分布图
由于干细胞独特的生物学特性和治疗效果的不确定性,干细胞相关研究和临床应用的伦理审查备受关注。我国在干细胞临床研究的早期由于监管不到位、伦理审查不严,出现了一些干细胞临床应用的乱象。2015年8月《办法》出台后要求机构伦理委员会按照涉及人的生物医学研究伦理审查办法相关要求对干细胞临床研究进行独立的伦理审查,省级卫生计生行政部门与省级食品药品监管部门也加强了对机构的常态化监管,干细胞临床研究开始依法、依规和依程序开展[36-36]。张勘等[38]对3 个省 (市)已备案的10 所公立医院进行的问卷调查显示干细胞临床研究项目伦理审查通过率为66.67% (14/21),表明伦理委员会较好地发挥了作用,保障了干细胞临床研究的规范开展。另一项调查研究发现,纳入研究的10 所公立医院均建立了机构伦理委员会,有1 所医院专门建立了干细胞临床研究的伦理委员会[39],这表明在《办法》出台后作为责任主体的医疗机构能够按照办法要求建立伦理委员会。另外,10 所被调查的公立医院中有3所医院未制定有专门针对干细胞伦理审查的标准操作程序(SOP)[39]。建议监管部门能够尽快完善我国干细胞临床研究伦理审查SOP,指导医疗机构规范开展干细胞临床研究。2016年11月24日,国家卫生计生委科教司和食品药品监管总局药化注册司在浙江杭州召开了省级医学伦理暨干细胞临床研究管理工作推进会。会议突出强调了医学伦理审查工作在涉及人的生物医学研究中的重要性,要求省级卫生计生行政部门要尽快成立医学伦理专家委员会并加强组织和能力建设,履行管理职责。迄今为止北京市、上海市、江苏省、广东省、湖南省和江西省等地已成立了干细胞临床研究专家委员会和伦理专家委员会。
(二)干细胞临床研究人员的培训需要进一步强化
一项关于我国公立医院人员对干细胞临床研究伦理问题的认知调查发现[40],96%以上的受访者知晓干细胞临床研究需要政府相关部门批准,但仍有约18%的人不知道干细胞临床研究项目需同时获得学术委员会和伦理委员会批准。说明这部分研究人员对干细胞临床研究的政策法规并不熟悉,一方面与目前国内开展的干细胞临床研究数量较少有关;另一方面与医疗机构对干细胞研究相关人员的培训落实不到位有关。姜天娇等[41]对干细胞临床研究医师培训与政策认知的调查显示,开展干细胞临床试验的6 所三甲医院128 名医生中,有53.1%的医生没有参加过干细胞技术专业培训,55.5%的医生对 《办法》和相关技术指南的内容不了解,有82.8%的医生认为干细胞技术以及相关管理政策培训十分有必要。该项研究也证实了目前研究人员存在业务和政策不熟悉的现象,《办法》明确规定医疗机构是干细胞制剂和临床研究质量管理的责任主体,医疗机构的医务人员则是研究的具体实施者,他们对于国家政策和研究过程的了解可以更好地规范及约束自己的医疗行为,从而降低医疗风险,保障每一位受试者的人身安全。建议上级卫生行政部门要加强对机构的人员培训情况进行监管,把人员的培训情况作为督查的一项常态化指标,通过人员培训提高干细胞临床研究人员对我国干细胞临床研究政策、伦理要求、项目审查程序、质量管理和风险管控的认知。
(三)干细胞临床研究的相关知识需要进一步普及
在我国干细胞临床研究政策宽松期, “干细胞乱象”屡屡出现,很多干细胞公司、干细胞治疗中心违规发布干细胞治疗的广告,夸大干细胞的治疗效果,收取高昂的医疗费用。部分境外的旅游团甚至发布“干细胞旅游”的宣传广告吸引外国公民进入中国进行干细胞治疗,2012年原卫生部和国家食品药品监管局对吉林两家医院违法违规开展干细胞相关活动进行了通报批评。经过国家的专项治理和相关管理办法相继出台,我国“干细胞乱象”得到了有效的遏制。《办法》中明确指出开展干细胞临床研究的机构不得发布或变相发布干细胞临床研究的广告,但至今网络上关于干细胞治疗的信息和广告仍有出现。造成这种现象的出现一是因为民众干细胞相关医疗知识的缺乏,存在信息的不对等;二是对于一些疑难复杂的疾病,目前尚无有效的根治方法,广大民众求医心切的心理很容易被一些夸大疗效的广告所欺骗。政府部门和媒体可通过多种媒介普及干细胞治疗的知识与医学常识,提高公众的鉴别能力,帮助公众充分认识干细胞临床研究的探索性与风险性,科学理性的对待干细胞治疗。同时还应加强对宣传媒介的监管,屏蔽非法广告,使媒体的宣传起到正确指导作用。
(四)干细胞相关法律法规和标准体系需要进一步完善
《办法》是我国首个针对干细胞临床研究进行管理的规范性文件,《办法》规定卫生计生和食品药品监管部门对干细胞临床研究负有监督管理职责,但管理办法没有上升到法律层面,导致执行力度不够,对违规开展干细胞治疗的医疗机构和医生未起到震慑作用,非正规医疗机构干细胞滥用现象屡禁不止[42]。另一方面,我国干细胞治疗药物从备案到转化,审批严格,进程缓慢,缺乏干细胞临床研究及应用的风险分级管理机制。美国、欧盟、日本等国家和地区均制定了相应的监管政策以促进细胞治疗行业的发展。美国FDA 生物制品评估与研究中心 (FDA Center for Biologics Evaluation,CBER)负责干细胞的临床试验、产品的生产和销售。CBER对干细胞采用分级分类管理模式,对于异体来源、经过复杂处理制备的、非同源使用的细胞产品按照药品一样的审批程序,而对于干预最小化、同源使用、未经过复杂处理的细胞产品按照低风险管理,按照FDA 的相关要求开展研究和上市转化后可以在医院直接进行临床应用。同时美国FDA 也发布了细胞治疗的技术指南,形成了包括上位法律、法规、管理制度与指南的完善的法规监管框架[43]。欧盟建立有《医药产品法》与《医疗器械法》,2007年颁布了《先进技术治疗医学产品法规》,将细胞治疗产品纳入先进治疗医学产品(advanced therapy medicinal products,ATMP)由欧洲药品管理局 (EMA)负责审批和管理。另外,与美国相似,欧盟的相关法规中提出了豁免条款,该条款允许医院在经过基础研究、临床研究验证之后,将自体细胞产品作为医疗技术用于特定的患者[44-45]。欧盟针对细胞治疗产品还制定了一系列科学指导原则。从以上国外的干细胞管理经验来看,干细胞治疗领域需要建立从法律、法规到行业指南的完善管理框架,分级分类管理,促进干细胞研究的临床转化。但我国目前的相关政策法规尚未能覆盖基础研究、产品研发到临床应用的全流程。一些国家还成立了相关的学术团体并制定了包括干细胞的获取和制备、受试者的选择、输入的途径、剂量与疗程和临床效果评价等全流程的标准和规范。我国政府和干细胞临床研究专家委员会也应尽快出台国内干细胞临床研究相关行业规范和标准,指导干细胞研究与临床应用[46]。
六、展望
由于干细胞治疗在疾病治疗和再生医学领域具有广阔应用前景,干细胞临床试验已成为各国政府、科技和企业界高度关注和大力投入的重要研究发展领域。根据全球市场情报机构Fior Markets 发布的新报告,2018 ~ 2025年全球细胞治疗技术市场的复合年增长率为16.81%,预计到2025年市场值将超过340 亿美元。2019年年初美国FDA 宣布了对未来细胞治疗的发展计划,FDA 预测到2025年这一领域每年将有10 ~ 20 款新药获得批准。中国的干细胞市场潜力巨大,很多难治性的疾病患病人数多,迫切需要新的、有效的治疗方法。我国目前已建立起多家产业化基地,形成了从基础研究到关键技术研发,再到产品研发及临床应用的贯穿产业链上下游的完整研究体系。但是,我国还需要进一步加快干细胞研究向临床成果转化的速度,近几年来国家和地方政策中多次提到在国家设立的自由贸易区内医疗机构可按有关规定开展干细胞临床前沿医疗技术研究,这些地区可利用政策优势先行先试,推动干细胞研究成果向临床应用转化。

