新鲜和冻融胚胎移植中异位妊娠风险的分析
黎佩怡 陈志云
广东省惠州市中心人民医院生殖医学中心,广东惠州 516000
异位妊娠是体外受精-胚胎移植(IVF-ET)技术中可能出现的一种严重危害女性患者的并发症之一。在接受IVF-ET的患者中,异位妊娠的发生率为1.4%~5.4%[1],约为自然受孕女性的异位妊娠率的两倍[2]。有文献报道,输卵管疾病可能是异位妊娠发生的重要促进因素[3],患有输卵管疾病的患者往往需要接受IVF-ET治疗,因此该类患者的异位妊娠率较高。在IVF周期的促排卵药物作用下,子宫内膜的改变被认为是异位妊娠率升高的原因之一[4-5]。有文献报道,由于冻融周期的内膜较容易接受胚胎种植,所以冻融胚胎移植可以降低异位妊娠发生率[6]。此外,囊胚具有较高的种植潜能,与卵裂胚移植相比,囊胚移植也被认为可以降低异位妊娠发生率[7-8]。综上所述,本研究将新鲜和冻融胚胎移植周期中根据胚胎类型(卵裂胚或囊胚)进行分组,比较四种移植策略下异位妊娠发生率及进行风险因素分析。
1 资料与方法
1.1 一般资料
采用整群随机抽样的方法进行回顾性研究,从本院生殖医学中心的辅助生殖管理系统数据库导出2014年1月1日~2019年9月1日进行的胚胎移植周期共8927个,分析患者临床资料。患者纳入标准:(1)女方<40周岁;(2)女方子宫内膜厚度为7~14mm;(3)行新鲜或冻融胚胎移植后获得宫内妊娠或异位妊娠。排除标准:(1)卵裂胚或囊胚复苏后有超过一半细胞裂解的移植周期;(2)冻卵周期;(3)失访的移植周期。根据胚胎类型和移植类型分为四组:新鲜卵裂胚组(A1组)、新鲜囊胚组(A2组)、冻融卵裂胚组(B1组)和冻融囊胚组(B2组)。研究方案已经伦理学委员会批准,所有患者已知情同意并签署知情同意书。
1.2 超促排卵方案
所有研究对象的超促排卵方案按本中心常规方法进行。本中心常规使用长方案,即在患者上一个月经周期的黄体中期使用0.8~1.3mg的促性腺激素释放素进行降调,根据患者情况每日注射促性腺激素。当有两个卵泡>18mm时,患者注射5000~10000IU的人体绒膜促性腺激素(hCG),36h后在B超引导下进行取卵手术。
1.3 胚胎培养、冷冻和解冻
在获卵3~4h后通过IVF或ICSI进行授精。授精后,胚胎在K-SICM培养液(COOK, USA),温度为37℃,气体环境为5% O2,6% CO2,89% N2的培养箱中培养3d。第一天观察胚胎受精情况,第三天观察胚胎形态。患者签署知情同意书后进行新鲜胚胎移植、胚胎冷冻和(或)囊胚培养。如进行囊胚培养,胚胎转移至K-SIBM培养液(COOK,USA),在相同的环境下继续培养2d,在第五天和第六天观察囊胚形态。研究期间胚胎冷冻与复苏所使用的冷冻液、复苏液和载杆购买自瑞典Vitrolife公司产品。
1.4 胚胎移植
患者在胚胎移植前提前进行自然周期或人工周期准备子宫内膜。研究期间使用的胚胎移植管为Pivet Embryo Transfer Catheter Set(COOKUSA)。实验室人员将胚胎装载在含10μL的K-SIBM中,头尾均含用于B超定位的气泡。研究期间使用移植管、移植方法和移植医师均没有改变。
1.5 妊娠结局的判断
移植术后14d,电话随访其血清β-HCG试验结果。若B超可见宫内胎囊和胎心,可判断为宫内临床妊娠;若B超观察到宫外胎儿,或者在宫内未观察到胎儿但hCG高于500ng/mL,则可判断为异位妊娠[9]。
1.6 统计学方法
应用SPSS20.0软件进行单因素分析(χ2检验、t检验和方差分析)和多因素Logistic回归分析,P<0.05为差异有统计学意义。获卵数指新鲜胚胎移植周期对应的单次取卵手术获得的卵子数,冻融胚胎移植周期此项为无。IVF比例是指新鲜胚胎移植周期对应的授精方式(IVF或ICSI),冻融胚胎移植周期此项为无。移植数目是指进行移植的胚胎个数。进行多因素Logistic回归分析的自变量包括移植分组、女方是否有盆腔输卵管因素和胚胎移植数目。
2 结果
2.1 四组患者临床资料比较
四组患者的临床资料分析显示,年龄、获卵数、不孕年限和移植胚胎数目比较,差异有统计学意义(P<0.05)。四组患者的BMI和授精方式比较,差异无统计学意义(P>0.05)。见表1。
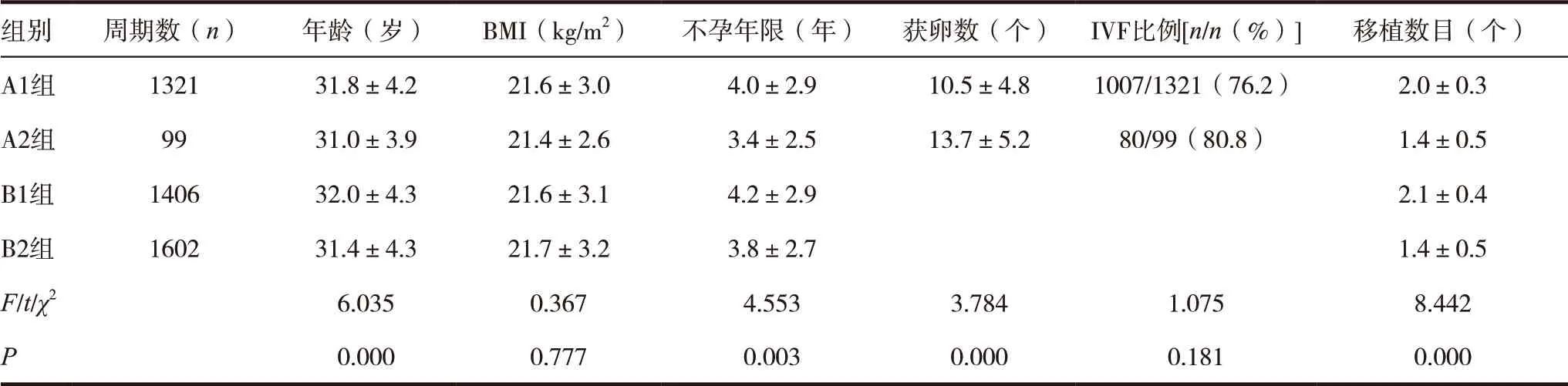
表1 四组患者基本资料比较
2.2 四组患者异位妊娠率比较
A1组的异位妊娠率为2.6%,A2组为3.0%,B1组为2.8%,B2组为1.1%。四组比较差异有统计学意义(P<0.05)。见表2。
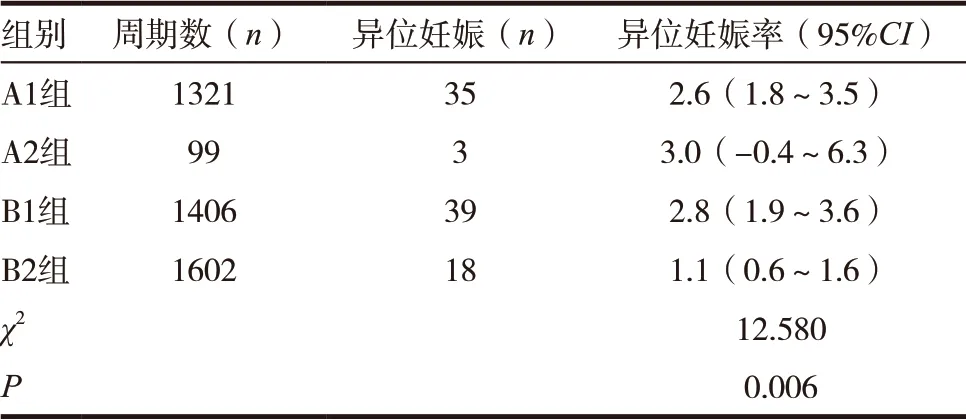
表2 四组患者异位妊娠率比较
2.3 四组患者异位妊娠风险分析
影响异位妊娠发生的单因素分析筛选出三个差异有统计学意义的变量,即女方是否有盆腔输卵管因素、移植数目(表3)和移植分组(表2)。多因素Logistic回归分析显示移植分组的差异有统计学意义(P<0.05)(表4),其中卵裂胚移植组(A1组和B1组)与B2组比较,异位妊娠风险的差异有统计学意义(P<0.05)。A2与B2组比较,异位妊娠风险的差异无统计学意义(P>0.05)。
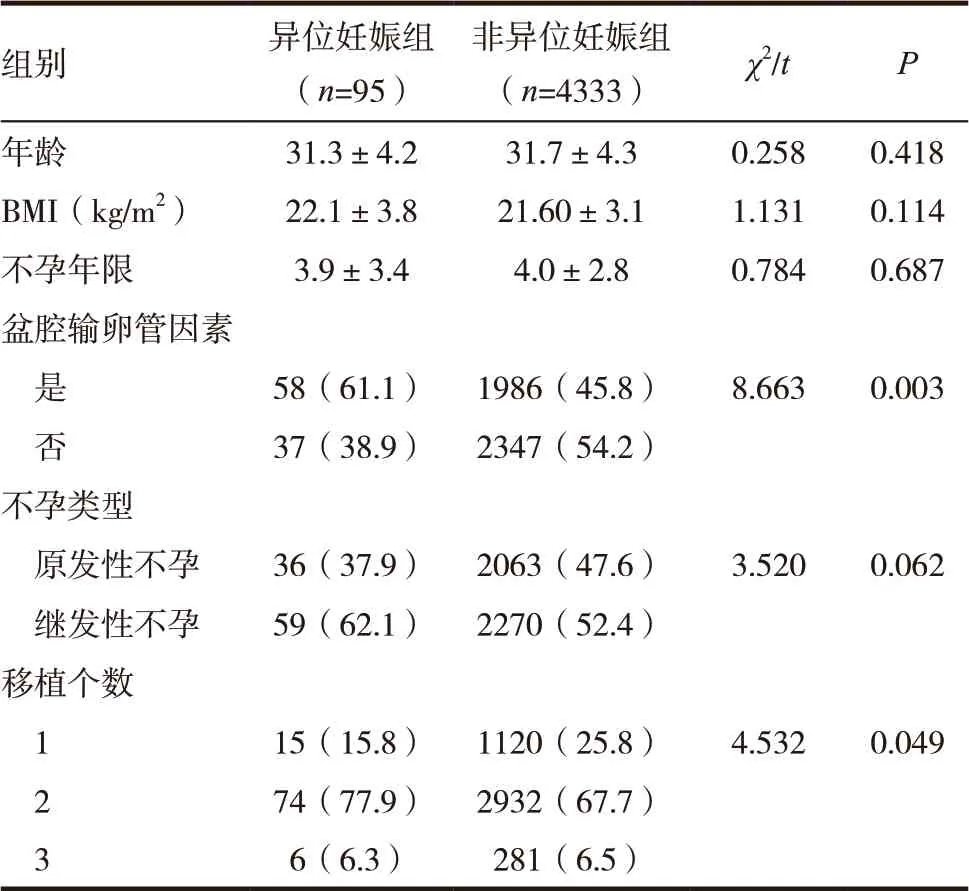
表3 异位妊娠发生的单因素分析[n(%)]
3 讨论
3.1 胚胎类型的异位妊娠风险比较
目前生殖中心通常选择卵裂胚或囊胚时期的胚胎进行移植。卵裂胚在移植入子宫后不会马上种植于内膜,而可能在女性生殖系统内逆行运输至输卵管,此过程容易导致异位妊娠[10]。因此,选择具备更高种植潜力的胚胎进行移植可降低异位妊娠的发生[11]。本研究发现,无论是新鲜周期还是冻融周期,囊胚移植的异位妊娠率显著性低于卵裂胚移植。国内外文献报道相似的结果[12-14],提示选择囊胚移植可降低辅助生殖技术的异位妊娠率。
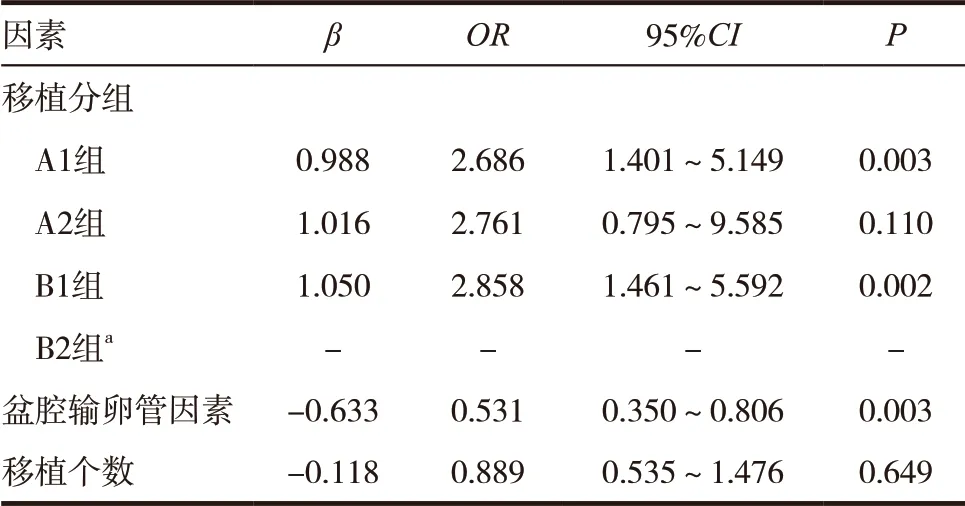
表4 四组移植类型的异位妊娠风险分析
3.2 移植类型的异位妊娠风险比较
在IVF周期促排卵药物的影响下,接受新鲜胚胎移植的患者可能会有更高概率的胚胎异常种植情况[7],如异位妊娠、生化妊娠和早期自然流产等。随着玻璃化冷冻和复苏胚胎技术的成熟,胚胎复苏率可达95%以上,冻融胚胎的种植潜力与新鲜胚胎相仿[15]。本研究结果显示,新鲜卵裂胚移植和冻融卵裂胚移植的异位妊娠率无显著性差异,而冻融囊胚移植的异位妊娠率显著性低于新鲜囊胚和新鲜卵裂胚移植。然而,关于新鲜周期和冻融周期移植后异位妊娠率的比较,多项研究的结论不尽相同。路锦等报道选择囊胚移植时,新鲜周期与冻融周期的异位妊娠率无统计学差异[16]。国外两篇文献报道冻融囊胚移植的异位妊娠风险最低[7,17]。
3.3 胚胎移植个数对异位妊娠的影响
每个胚胎都具有独立的异位妊娠风险,因此异位妊娠率被认为会随着移植的胚胎个数增加而升高[11,18],然而也有文献报道两者无相关性[19]。本研究未发现异位妊娠率与移植胚胎数目相关,这可能是由于胚胎质量的不同而导致的。单胚胎移植通常会选择评分最好的优质胚胎,而多胚胎移植中可能会含有低评分胚胎。本研究的Logistic回归分析表明,冻融囊胚移植是异位妊娠风险最低的。
3.4 本研究的局限性
本研究仍存在一定的局限性。首先,由于移植策略的改变,新鲜囊胚移植周期数量较少,仍需要继续扩大样本量进行深入分析;此外,后续研究需要纳入更多的患者基本指标和胚胎评分,以分析对异位妊娠的影响。
综上所述,冻融囊胚移植后异位妊娠发生率低于新鲜周期移植和冻融卵裂胚移植。

