姜黄素对肿瘤相关巨噬细胞分泌细胞因子基因表达的影响
刘璐瑶 ,张雯雯,曹娟,李玮柏,孙宏晨,2,李波,2
(1.吉林大学口腔医院实验教学中心,吉林 长春 130021;2.中国医科大学口腔医学院·附属口腔医院辽宁省口腔疾病重点实验室,辽宁 沈阳 110002)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,是一种极具侵袭性的恶性肿瘤,早期OSCC 患者5 年生存率为55%~60%,晚期OSCC 患者5 年生存率为30%~40%[1]。OSCC 的治疗,在其非特异性、非选择性和毒性方面仍存在巨大的挑战,多数患者在手术、化疗及放疗过程中出现严重不良反应,且后期易复发和转移[2]。OSCC 的形成过程中有活化的巨噬细胞参与,浸润巨噬细胞数量是OSCC 进展和预后的预测因子[3]。巨噬细胞在趋化因子的作用下浸润到肿瘤周围,在肿瘤微环境的作用下形成肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)。TAMs 通过分泌多种因子和基质金属蛋白酶(matrix metalloproteinase,MMP)等与肿瘤细胞进行交互作用,进而在肿瘤增殖、侵袭、转移和血管生成等过程中发挥作用。TAMs 分泌细胞因子的表达变化与其表型有密切关联,可以用于TAMs 表型转化和对M2 型TAMs 再教育研究[4-5]。姜黄素是姜黄的主要活性成分,是一种从天然植物姜黄根茎中提取出的多酚化合物。姜黄素具有抗炎、抗氧化和抗肿瘤等多种药理作用[6]。姜黄素对OSCC 的增殖、侵袭、转移和血管生成等有明显的抑制作用。研究[7]表明:姜黄素能通过抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)和EGFR 下游信号分子蛋白激酶B(Akt),细胞外信号调节蛋白激酶(ERK1/2)和信号转录及转录激活因子3(STAT3)的磷酸化抑制OSCC 的增殖和侵袭;可以通过减少MMP2 和MMP9 及调节p53-E-钙黏蛋白途径抑制OSCC 的侵袭和上皮-间充质转化[8];还能通过抑制辐射诱导的核因子κB(nuclear factor kappa-B,NF-κB)活性协同增强人OSCC 的放射敏感性[9]。姜黄素可以干预TAMs 分泌细胞因子的表达[10-11]。在白血病中,姜黄素通过Toll 样受体4(TLR4)/丝裂原活化蛋白激酶(MAPK)/NF-κB通路降低TAMs肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和白细胞介素12B(interleukin-12B,IL-12B)的表达[10];姜黄素能够促进肿瘤宿主巨噬细胞产生白细胞介素1(interleukin-1,IL-1)、IL-6 和TNF-α,抑制白细胞介素10(interleukin-10,IL-10)和转化生长因子β(transforming growth factor,TGF-β)的生成[11]。但是,姜黄素对OSCC 中TAMs 分泌细胞因子的影响目前尚未见相关报道。因此,本文作者推测:姜黄素可能通过干预OSCC中TAMs分泌细胞因子的表达,进而抑制OSCC 的进展。本研究旨在通过探讨姜黄素对OSCC 肿瘤细胞上清液诱导的TAMs 分泌细胞因子基因表达的影响,进一步阐明姜黄素抗OSCC 作用机制,为OSCC 的治疗提供新的实验依据以及潜在的治疗策略。
1 材料与方法
1.1 细胞、主要试剂和仪器人OSCC Cal27 细胞以及Raw264.7 巨噬细胞购自中国典型培养物宝藏中心(China Center for Type Culture Collection,CCTCC),由吉林大学口腔医院实验教学中心进行传代培养。DMEM-高糖培养基(货号C11995500 BT,美国Gibco 公司),胎牛血清(货号04-001-1A)和青链霉素双抗(货号Hyc-SV30010)购自以色列BI 公司,姜黄素(货号C7727-500MG,美国Sigma 公司),CCK-8 试剂盒(K1018-5mL,美国APExBIO 公司),总RNA 提取试剂盒、逆转录试剂盒和Real-time PCR 试剂盒(大连TaKaRa 公司)。实时荧光定量PCR 仪(美国安捷伦公司)。
1.2 细胞培养Cal27 细胞和Raw264.7 细胞均采用含10%胎牛血清、1%青链霉素双抗的DMEM高糖培养基在37°C、5% CO2且饱和湿度的培养箱中培养,取对数生长期细胞进行实验。
1.3 肿瘤细胞上清液的收集及姜黄素和Cal27 细胞上清混合液的制备取对数生长期Cal27 细胞,接种到75cm2细胞培养瓶中,待细胞生长至约为80%融合率时换成10 mL 新鲜完全培养基继续培养,24 h 后收集上清液,500 g 离心5 min,弃掉沉淀收集上清,将上清液与新鲜完全培养基按7∶3比例配制。将姜黄素溶于配置后的Cal27 肿瘤细胞上清液中形成不同浓度的姜黄素和Cal27 细胞上清混合液。
1.4 CCK-8 法检测细胞活性取对数生长期Raw264.7 细胞,重悬成单细胞悬液,按每孔100 μL、2 000 个细胞数接种于96 孔细胞培养板内,随机分为对照组和实验组,每组设5 个复孔,用Cal27 细胞上清液孵育Raw264.7 细胞,实验组用不同浓度(1.25、2.50、5.00、10.00、20.00 和40.00 μmol·L-1)姜黄素进行干预。待细胞贴壁状态稳定后,弃掉原培养基,按实验分组每孔加入100 μL 相应溶液,在培养箱中孵育48 h 后,每孔中加入10 μL CCK-8 溶液,继续孵育4 h,于酶标仪450 nm 处检测各孔吸光度(A)值。根据各孔A 值计算细胞存活率。细胞存活率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)。
1.5 Real-time PCR 法检测细胞中TAMs 分泌细胞因子mRNA 表达水平取对数生长期Raw264.7 细胞,重悬成单细胞悬液接种于6 孔细胞培养板内,随机分为对照组和实验组,每组设3 个复孔,用Cal27 细胞上清液孵育Raw264.7 细胞,实验组用不同浓度(5、10 和20 μmol·L-1)姜黄素进行干预。根据试剂盒说明书提取总mRNA,测定mRNA 的浓度,按照逆转录试剂盒操作步骤将各组mRNA 反转录为cDNA。按照Real-time PCR 试剂盒步骤进行实验。各目的基因mRNA 相对表达水平采用2-ΔΔCT法计算。引物由生工生物工程(上海)股份有限公司合成,引物序列:β-actin,上游引物5'-GTGCTATGTTGCTCTAGACTTCG-3',下游引物5'-ATGCCACAGGATTCCATACC-3';IL-10,上游引物5'-CTGCTATGCTGCCTGCTCTTACTG-3',下游引物5'-ATGTGGCTCTGGCCGACTGG-3';IL-12,上游引物5'-ACGAGAGTTGCCTGGCTACTAGAG-3',下游引物5'-TCTGAAGTGCTGCGTTGATGGC-3';TNF-α,上游引物5'-CTCATGCACCACCATCAAGGACTC-3',下游引物5'-AGACAGAGGCAACCTGACCACTC-3';Arg-1,上游引物5'-TGCTCACACTGACATCAACACTCC-3',下游引物5'-GGTCTACGTCTCGCAAGCCAATG-3';iNOS,上游引物5'-TGCCACGGACGAGACGGATAG-3',下游引物5'-CTCTTCAAGCACCTCCAGGAACG-3'。
1.6 统计学分析采用Graphpad Prism 5.0 统计软件进行统计学分析。各组Raw264.7 细胞存活率以及 Raw264.7 细胞分泌的 IL-12、iNOS、TNF-α、IL-10 和Arg-1 mRNA 表达水平均符合正态分布,以表示。所有实验数据均是重复3 次以上的结果,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组Raw264.7 细胞活性与对照组比较,1.25、2.50、5.00、10.00 和20.00 μmol·L-1姜黄素组Raw264.7 细胞活性均有不同程度降低,但差异无统计学意义(P>0.05);40 μmol·L-1姜黄素组Raw264.7 细胞活性明显降低(P<0.01)。因此后续实验将选取不加姜黄素组作为对照组,5、10 和20 μmol·L-1姜黄素组作为实验组进行干预。见表1。
2.2 TAMs 诱导过程中各组Raw264.7 细胞中IL-12、iNOS 和TNF-α mRNA 表达水平不同浓度姜黄素和Cal27 细胞上清液共同孵育Raw264.7 细胞36 h,与对照组比较,5 μmol·L-1姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平差异无统计学意义(P>0.05),10 μmol·L-1姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平有上升趋势,但差异也无统计学意义(P>0.05),20 μmol·L-1姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平明显升高(P<0.01);iNOS mRNA 表达水平均有不同程度降低,10 和20 μmol·L-1姜黄素组Raw264.7 细胞中iNOS mRNA 表达水平明显降低(P<0.05);不同浓度姜黄素组Raw264.7细胞中TNF-α mRNA表达水平均有下降趋势,10 和20 μmol·L-1组TNF-α mRNA 表达水平明显降低(P<0.01)。不同浓度姜黄素和Cal27 细胞上清液共同孵育Raw264.7 细胞48 h,与对照组比较,不同浓度姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平均有不同程度升高,5 和20 μmol·L-1姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平升高(P<0.01);不同浓度姜黄素组Raw264.7 细胞中iNOS mRNA 表达水平均有下降趋势,其中5 和20 μmol·L-1姜黄素组Raw264.7细胞中iNOS mRNA 表达水平降低(P<0.01);不同浓度姜黄素组Raw264.7 细胞中TNF-αmRNA表达水平均降低(P<0.01)。见表2。
表1 CCK-8 法检测各组Raw264.7 细胞活性Tab.1 Activities of Raw264.7 cells in various groups detected by CCK-8 assay(n=5,,η/%)
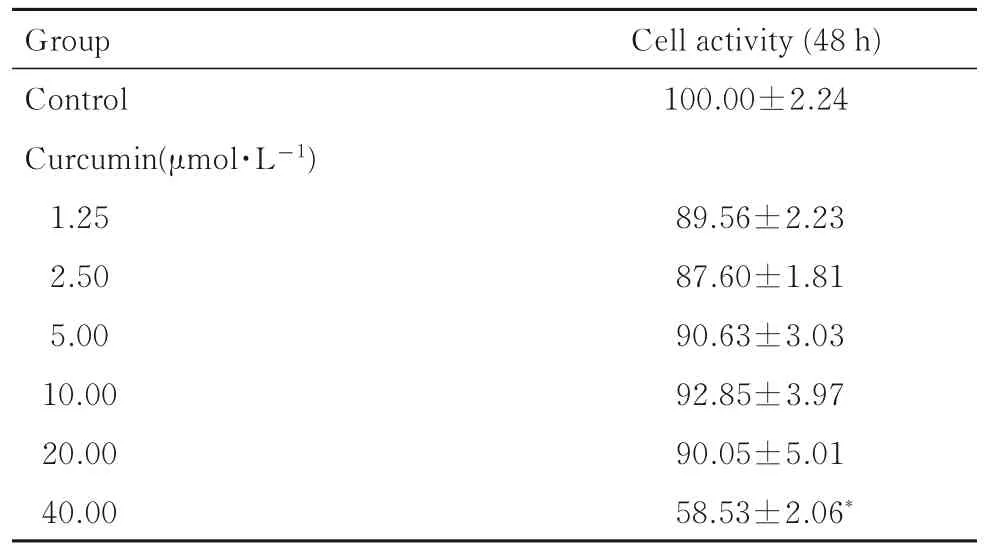
表1 CCK-8 法检测各组Raw264.7 细胞活性Tab.1 Activities of Raw264.7 cells in various groups detected by CCK-8 assay(n=5,,η/%)
*P<0.01vscontrol group.

表2 各组Raw264.7 细胞中IL-12、iNOS 和TNF-α mRNA 表达水平Tab.2 Expression levels of IL-12,iNOS and TNF-α mRNA in Raw264.7 cells in various groups(n=3,x±s)
2.3 TAMs 诱导过程中各组Raw264.7 细胞中IL-10 mRNA 表达水平不同浓度姜黄素和Cal27 细胞上清液共同孵育Raw264.7 细胞36 h,与对照组比较,20 μmol·L-1组姜黄素Raw264.7细胞中IL-10 mRNA 表达水平明显降低(P<0.01)。不同浓度姜黄素和Cal27 细胞上清液共同孵育Raw264.7 细胞48 h,与对照组比较,不同浓度姜黄素组Raw264.7 细胞中IL-10 mRNA 表达水平均明显降低(P<0.01)。见表3。
2.4 TAMs 诱导48 h 后加入姜黄素干预时各组Raw264.7 细胞中IL-12、iNOS、TNF-α、IL-10 和Agr-1 mRNA 表达水平Cal27 细胞上清液孵育Raw264.7 细胞48 h 后,采用不同浓度的姜黄素进行干预,与对照组比较,10 和20 μmol·L-1姜黄素组Raw264.7 细胞中IL-12 mRNA 表达水平明显升高(P<0.01),iNOS mRNA 表达水平均明显降低(P<0.01);5 μmol·L-1姜黄素组Raw264.7 细胞中TNF-α mRNA表达水平降低(P<0.05),10 和20 μmol·L-1姜黄素组Raw264.7 细胞中TNF-α mRNA 表达水平明显降低(P<0.01)。与对照组比较,10 和20 μmol·L-1姜黄素组Raw264.7细胞中IL-10 mRNA 表达水平明显降低(P<0.01),5、10 和20 μmol·L-1姜黄素组Raw264.7细胞中Arg-1 mRNA 表达水平均明显降低(P<0.01)。见表4。
表3 各组Raw264.7 细胞中IL-10 mRNA 表达水平Tab.3 Expression levels of IL-10 mRNA in Raw264.7 cells in various groups(n=3,)

表3 各组Raw264.7 细胞中IL-10 mRNA 表达水平Tab.3 Expression levels of IL-10 mRNA in Raw264.7 cells in various groups(n=3,)
*P<0.01vscontrol group.
表4 TAMs 诱导48 h 后姜黄素作用下各组Raw264.7 细胞中IL-12、iNOS、TNF-α、IL-10 和Agr-1 mRNA 表达水平Tab.4 Expression levels of IL-12,iNOS,TNF-α IL-10,and Arg-1 mRNA in Raw264.7 cells in various groups after TAMs induction for 48 h followed by curcumin treatment(n=3,)

表4 TAMs 诱导48 h 后姜黄素作用下各组Raw264.7 细胞中IL-12、iNOS、TNF-α、IL-10 和Agr-1 mRNA 表达水平Tab.4 Expression levels of IL-12,iNOS,TNF-α IL-10,and Arg-1 mRNA in Raw264.7 cells in various groups after TAMs induction for 48 h followed by curcumin treatment(n=3,)
*P<0.05,**P<0.01vscontrol group.
3 讨论
本研究选用Cal27 和Raw264.7 这2 种细胞系,采用Cal27 细胞上清液孵育Raw264.7 诱导形成TAMs;在TAMs 诱导过程中以及诱导48 h 后使用姜黄素进行干预,观察姜黄素对TAMs 分泌细胞因子基因表达的影响。
目前将巨噬细胞诱导成TAMs 的方式主要有2 种:一种是直接使用脂多糖(LPS)/γ-干扰素(IFN-γ)或白细胞介素4(IL-4)/ 白细胞介素13(IL-13)将巨噬细胞诱导成M1 或M2 表型的TAMs,如IL-4/ IL-13 刺激Raw264.7 细胞诱导成M2 型TAMs,经羧化多壁碳纳米管处理后M2 型TAMs向M1表型转化[12];IL-4处理小鼠巨噬细胞诱导成M2 表型TAMs,LPS 诱导形成M1 表型TAMs,6-姜醇通过改变TAMs 极化状态,以防止氨基甲酸酯诱导的肺癌发生[13];另一种是使用肿瘤上清液诱导巨噬细胞形成TAMs,如佛波酯处理的单核细胞系(THP-1)细胞与人A549 细胞培养上清液共培养48 h 诱导形成M2 型TAMs,观察SPP1 影响TAMs 极化并促进肺腺癌的免疫逃逸[14];Raw264.7 巨噬细胞与4T1 细胞上清液共孵育72 h 后成功诱导成M2 型TAMs,观察肿瘤来源的透明质酸对巨噬细胞免疫抑制作用的影响[15]。使用LPS/ IFN-γ 或IL-4/ IL-13 诱导巨噬细胞极化不仅应用于肿瘤,还应用于炎症相关研究,但无法模拟肿瘤微环境,同时也无法体现不同肿瘤之间的差异性;使用不同肿瘤细胞上清液诱导巨噬细胞形成TAMs,能够真实还原巨噬细胞在不同肿瘤微环境中形成TAMs 的过程。本研究采用Cal27 上清液诱导TAMs,可以更好地模拟OSCC 肿瘤微环境中TAMs 的形成过程,确保实验数据翔实可靠。研究姜黄素对TAMs 分泌细胞因子基因表达的影响,有助于进一步阐明姜黄素抗OSCC 的作用机制。
TAMs 分泌的细胞因子,在肿瘤的进展中发挥着重要作用。在黑色素瘤中,Batf2 通过上调TAMs 分泌的IL-12 发挥其抗肿瘤的作用[16];紫杉醇可以诱导TAMs 重新生成IL-12,纠正肿瘤诱导的免疫功能障碍,进而对抗纤维肉瘤[17];IL-12 还具有诱导肿瘤细胞自噬、抑制肿瘤细胞转移及血管生成等作用[18]。TAMs分泌的TNF-α具有促进肿瘤生长及转移的作用,是多种癌症发生、增殖、转移和血管生成过程中的关键因子[19-21]。iNOS 与肿瘤的分化、转移及预后有密切关联[21]。在肿瘤微环境中,IL-10 表达水平升高可以激活STAT3 通路进而促进肝癌的浸润和转移[22];IL-10 可以促进乳腺癌的免疫逃逸[23];IL-10通过产生TNF 家族细胞活化因子BAFF 促进淋巴瘤的存活及发展[24]。Arg-1 在多种癌症中呈阳性表达,具有抑制免疫反应促进肿瘤生长的作用[25]。
本研究结果显示:姜黄素能上调TAMs分泌细胞因子IL-12 的表达水平,下调TNF-α、iNOS、IL-10 和Arg-1 表达水平。IL-12被称为重要的抗肿瘤细胞因子,通过不同的机制抑制肿瘤的发生发展[16-17]。姜黄素可能通过上调TAMs分泌细胞因子IL-12 表达进而抑制OSCC的进展。在OSCC发展过程中,阻断TNF-α 的生成可抑制肿瘤的血管生成及生长[19];TNF-α诱导的miR-450a介导的TMEM182表达,以促进OSCC的运动[20]。姜黄素可能通过下调TNF-α的表达进而抑制OSCC的血管生成、生长及侵袭。iNOS对OSCC的发生发展起重要作用,可能通过下调iNOS 的表达进而与OSCC 的分化、淋巴结转移及预后有密切关联[21]。CD163+/CD204+M2型TAMs 通过产生IL-10和程序死亡配体1(PD-L1)作用于T细胞,促进OSCC 的侵袭和转移[26]。姜黄素可能通过下调IL-10 表达水平抑制OSCC 的侵袭和转移。Arg-1 具有抑制免疫反应促进肿瘤生长的作用[25],还可能通过下调Arg-1 的表达抑制OSCC 生长。
研究[4,27]表明:中药可以通过调控TAMs 分泌细胞因子的表达干预TAMs 的表型变化。中药消水汤上调M2 型TAMs IL-12 的表达水平,下调IL-10 的表达水平,促进M2 型TAMs 向M1 表型极化[4];三七通过上调M1型因子IL-1β、单核细胞趋化蛋白1(MCP-1)、TNF-α 和iNOS 表达水平,下调M2 型因子IL-10 和YM-1 的表达水平,激活巨噬细胞向M1 表型极化抑制肿瘤生长[27]。与上述研究结果不同,本研究中姜黄素下调TNF-α和iNOS的表达水平。姜黄素可以下调小鼠巨噬细胞中TNF-α和IL-1β的产生并抑制NF-κB的活化,而TNF-α 和IL-1β是巨噬细胞中iNOS基因表达的关键,NF-κB对iNOS 的转录至关重要[28];姜黄素是iNOS 激活的抑制剂,可以抑制iNOS 蛋白表达,姜黄素还降低肺泡巨噬细胞中TNF-α及NO的合成[29]。姜黄素可能通过上述途径下调TNF-α和iNOS 的基因表达。
本研究中,TAMs分泌的IL-12、IL-10和Arg-1表达水平的变化与TAMs 表型的转化有密切关联。在TAMs诱导过程中,姜黄素上调M1 型细胞因子IL-12 表达水平的同时,下调M2 型细胞因子IL-10的表达水平,表明姜黄素可能延缓了TAMs由M1型向M2型转化的过程;TAMs 诱导48 h 后使用姜黄素进行干预,M1型细胞因子IL-12表达水平上调,M2 型细胞因子IL-10和Arg-1表达水平下调,表明姜黄素可能对M2型TAMs再教育,使其由M2 型向M1型转变。上述结果表明:姜黄素可能从延长M1型TAMs持续时间和对M2 型TAMs再教育2个途径干预TAMs 表型变化,最大限度解除免疫限制,进而对抗OSCC。
综上所述,姜黄素可以调节TAMs 分泌细胞因子的基因表达,其可能通过干预IL-12、TNF-α、iNOS、IL-10 和Arg-1 在OSCC 中的作用以及TAMs 的表型变化,进而发挥其抗OSCC 作用。本研究有助于进一步阐明姜黄素抗OSCC 的作用机制,为OSCC 的治疗提供新的实验依据以及潜在的治疗策略。

