SIRPα-GFP 真核表达载体构建及其在HEK293T 细胞中的表达
王明月,王浩,王冬梅,杨泽斌,崔梅英,刘宁,黄莉莉,关新刚
(北华大学医学技术学院肿瘤靶向治疗重点实验室,吉林 吉林 132013)
信号调节蛋白α(signal regulatory protein-α,SIRPα),也被称为CD172a 或SHPS-1,是属于免疫球蛋白超家族中的一种膜蛋白,是一种在巨噬细胞、树突状细胞和中性粒细胞等髓系细胞上表达的抑制性受体分子[1]。CD47 是SIRPα 的天然配体,在多种生理病理过程中均发挥作用[2-4]。正常的血液系统细胞表面均有CD47 表达,CD47-SIRPα 通路在红细胞老化吞噬过程中发挥作用[5]。SIRPα 作为巨噬细胞上的关键免疫抑制受体,与SIRPα 配体CD47 的相互作用可阻止自体吞噬作用,因此可以利用CD47 与SIRPα 识别抑制巨噬细胞的吞噬作用和移植排斥反应[6-7]。SIRPα 除在巨噬细胞表面表达外,还在中性粒细胞的表面呈高水平表达,多种肿瘤中CD47 分子呈高水平表达,巨噬细胞和中性粒细胞表面的SIRPα 与其识别结合后,会介导免疫抑制,发生免疫逃逸,从而促进肿瘤的发展[8-9]。CD47-SIRPα 信号通路为肿瘤治疗提供了新的思路,通过阻断CD47-SIRPα 信号通路激活吞噬细胞对肿瘤的吞噬,增强肿瘤抗原递呈,引发机体抗肿瘤免疫反应,杀伤肿瘤细胞[10-11]。本研究通过构建融合表达绿色荧光蛋白(green fluorescent protein,GFP)的SIRPα 真核表达载体,制备稳定表达SIRPα-GFP 的HEK293T 细胞系,并研究SIRPα-GFP 在细胞中的表达定位,为后续SIRPα的功能研究以及CD47-SIRPα 信号通路阻断研究奠定基础。
1 材料与方法
1.1 细胞、主要试剂和仪器HEK293T 细胞为本实验室冻存。培养基购自美国Hyclone 公司,胎牛血清购自杭州四季青公司,pLenti-C-mGFP 质粒和pCMV6-SIRPα 质粒购自美国Origene 公司,MluⅠ和SgfⅠ限制性内切酶购自日本TaKaRa 公司,T4 DNA 连接酶购自上海碧云天生物技术公司,DH5α 感受态细胞和卡那霉素购自生工生物工程(上海)股份有限公司,质粒提取试剂盒和凝胶回收试剂盒购自美国Axyprep 公司,Lipofectamine 3000 转染试剂购自美国Invitrogen 公司,单克隆SIRPα 抗体购自美国Biolegend 公司,蛋白预染Marker、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)和显色底物购自上海碧云天生物技术有限公司。核酸电泳系统、凝胶成像系统、蛋白电泳和转膜系统均购自美国Bio-Rad 公司,倒置荧光显微镜购自美国Lifte-Technologies 公司,全自动多功能酶标仪购自瑞士TECAN 公司。
1.2 SIRPα 真核表达载体的构建和鉴定将测序正确的pLenti-C-mGFP 质粒与pCMV6-SIRPα 质粒用限制性内切酶MluⅠ和SgfⅠ进行双酶切:各取2 μ g 质粒,加入1 μ L 限制性内切酶MluⅠ和SgfⅠ,37℃水浴4 h,酶切产物经0.8%琼脂糖凝胶电泳分离并对相关片段进行凝胶回收,利用T4 DNA 快速连接酶在25℃水浴连接1 h,将连接产物转化到DH5α 感受态细胞,接种到含有卡那霉素的LB 平板培养基中,过夜培养。从平板培养基中挑取单个菌落,160 r·min-1摇床过夜,提取质粒后用MluⅠ和SgfⅠ限制性内切酶进行双酶切,在0.8%琼脂糖凝胶电泳检测双酶切后DNA 片段大小。双酶切验证成功的质粒DNA 送到生工生物工程(上海)股份有限公司进行DNA 测序分析。
1.3 重组质粒转染HEK293T 细胞HEK293T 细胞在含有10%胎牛血清的DMEM 培养基中,置于37℃、5% CO2的培养箱中培养。转染前1 d,将对数生长期的HEK293T 细胞以每孔1×106个细胞接种于6 孔细胞培养板中,使细胞在第2 天达到70%~80% 融合度。第2 天,从培养箱中取出6 孔细胞培养板培养的HEK293T 细胞,吸除原有培养基,加入2 mL PBS 缓冲液清洗细胞2 次后,换为Opti-MEM 培养基培养。利用Lipofectamine 3000 转染试剂,将2 μg 质粒DNA 以及10 μL 转染试剂分别与125 μL Opti-MEM 培养基混匀,之后将带有质粒DNA 的混合物加入到带有转染试剂的试管中,混匀后室温静置15 min,加入到6 孔细胞培养板HEK293T 细胞培养基中。转染48 h 后在荧光显微镜下488 nm 激发光观察SIRPα-GFP 绿色荧光的表达及细胞膜定位情况。
1.4 Western blotting 法检测HEK293T 细胞中SIRPα-GFP 融合蛋白的表达为了对转染后的HEK293T 细胞进行筛选,转染48 h 后将细胞转移到10cm 培养皿进行培养,使细胞在24 h 后达到40%~50% 的融合度,更换为含有嘌呤霉素(8 mg·L-1)的新鲜培养基,每隔2 d 弃去原有培养基,用PBS 缓冲液清洗2 遍,更换含有嘌呤霉素(8 mg·L-1)的新鲜培养基,此步骤重复3 次。已经筛选后的细胞,扩大培养后收集细胞,PBS 缓冲液清洗2~3 次,用RIPA 裂解液冰上裂解60 min,每隔10 min 颠倒混匀,之后将裂解物经12 000 g、4℃离心30 min,留取上清进行蛋白定量以及Western blotting 法验证。取30 μg 总蛋白经12%SDS-PAGE 凝胶分离,25 V 恒压14 min 转移到PVDF 膜上。PVDF 膜用含有5% 脱脂奶粉的TBST 封闭液室温封闭2 h,与稀释后的SIRPα 一抗(1∶1 000 稀释)和Actin 一抗(1∶1 000 稀释)在4℃摇床孵育过夜。过夜后的PVDF 膜用TBST 清洗3 次,每次10 min,再与羊抗鼠二抗(1∶1 000 稀释)室温孵育2 h,经TBST 洗膜3 次,每次10 min。将膜放置于显影仪曝光板上,将特超敏ECL 化学发光试剂盒(BeyoECL Star)中的A 液和B 液按1∶1 比例混合,覆盖到膜上,曝光30 s,拍摄图像,若在相对分子质量为83 000附近出现清晰条带则提示SIRPα-GFP 融合蛋白表达成功。
2 结果
2.1 SIRPα-GFP 真核表达载体的构建本研究利用现有的慢病毒质粒pLenti-C-mGFP 作为真核表达载体进行重组质粒构建。将表达载体pLenti-CmGFP与SIRPα质粒(pCMV6-SIRPα)用限制性内切酶MluⅠ和SgfⅠ双酶切后,酶切产物经0.8%琼脂糖凝胶电泳分离,pLenti-C-mGFP 质粒双酶切后可见长度约为756 bp 的片段,pCMV6-SIRPα 质粒双酶切后可见长度约为1 527 bp 的片段(图1)。目的片段凝胶回收后,连接产物转化Kana 平板,阳性菌落在进行质粒提取后通过MluⅠ和SgfⅠ双酶切鉴定,电泳结果显示:重组质粒双酶切后可见约为7800和1 500bp的2个DNA条带,与pLenti-C-mGFP 载体及SIRPα 基因大小相符(图2),提示重组质粒pLenti-SIRPα-GFP 构建成功。
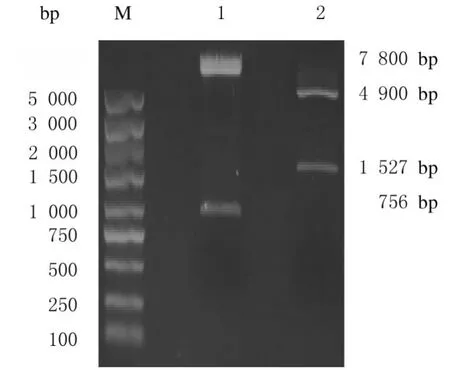
图1 GFP 表达载体(pLenti-C-mGFP)和SIRP α 质粒(pCMV6-SIRPα)双酶切结果Fig.1 Double digestion results of GFP expression vector(pLenti-C-mGFP)and SIRPα plasmid(pCMV6-SIRPα)

图2 重组质粒pLenti-SIRPα-GFP 的双酶切鉴定Fig.2 Identification of recombinant plasmid pLenti-SIRPα-GFP by double digestion
2.2 真核表达载体的DNA 序列测定将重组质粒pLenti-SIRPα-GFP 进行DNA 序列测定分析,测序结果显示:SIRPα 基因成功插入到pLenti-C-mGFP载体中的SgfⅠ位点(GCGATCGCC),提示SIRPα-GFP 重组质粒pLenti-SIRPα-GFP 构建成功(图3)。
2.3 SIRPα-GFP 重组质粒的真核表达通过Lipofectamine 3000 转染试剂将重组质粒pLenti-SIRPα-GFP 转染HEK293T 细胞,48 h 后在荧光显微镜下观察绿色荧光。绿色荧光清晰地表达在转染后的HEK293T 细胞膜上,与文献[9]报道的SIRPα蛋白的膜定位一致。见图4。

2.4 Western blotting 法检测SIRPα 蛋白表达转染空载体pLenti-C-mGFP 的HEK293T 细胞及转染pLenti-SIRPα-GFP 后的HEK293T 细胞裂解后,采用Western blotting 法检测HEK293T 细胞中SIRPα蛋白的表达,结果显示:转染pLenti-SIRPα-GFP质粒的HEK293T 细胞裂解液在相对分子质量为83 000 附近出现清晰的条带,转染空质粒的HEK293T 细胞裂解液则未检测出,考虑到SIRPα和GFP 蛋白的相对分子质量分别为56 000 及27 000,提示利用SIRPα 抗体检测的特异性条带为SIRPα-GFP融合蛋白。Western blotting 法检测结果表明:SIRPα-GFP 融合蛋白在HEK293T 细胞中成功表达。见图5。

图5 Western blotting 法检测HEK293T 细胞中SIRPα-GFP 蛋白表达电泳图Fig.5 Electrophoregram of expression of SIRP α -GFP protein in HEK293T cells detected by Western blotting method
3 讨论
肿瘤细胞通过表达与免疫细胞表面受体相互作用的活化或抑制性配体来逃避免疫监视[12]。肿瘤与免疫细胞之间的相互作用可防止肿瘤被免疫系统杀伤,促进肿瘤细胞的增殖[13-14]。肿瘤细胞通过过度表达的CD47 分子识别免疫细胞表面表达的SIRPα分子,使肿瘤能够逃避免疫系统监视,因此CD47-SIRPα 信号通路在肿瘤治疗等方面作用的研究受到越来越多的关注[15-16]。SIRPα是SIRP家族中一个典型的抑制性受体,在巨噬细胞、树突状细胞、嗜中性粒细胞和神经元上具有高水平的表达,研究[17]表明:SIRPα 在生理和病理过程中均发挥重要作用。SIRPα 代表一种髓样特异性免疫检查点,与肿瘤细胞表面高表达的“不要吃我”信号CD47 结合,会抑制免疫系统对肿瘤细胞的攻击[18]。因此阻断SIRPα 与CD47 的识别,会切断CD47-SIRPα信号通路对免疫系统的抑制,恢复免疫细胞的吞噬杀伤作用,达到治疗肿瘤的目的[19-20]。
GFP作为示踪标记,对宿主细胞不具有毒性,不会影响目的蛋白的表达,可以直接在显微镜下观察融合蛋白表达和定位,因此在融合蛋白真核表达研究中具有不可替代的作用[21-23]。由于HEK293 细胞生长繁殖速度快且极少表达细胞外配体所需的内生受体,且比较容易转染[24-25],因此选用HEK293T 细胞作为目的细胞。本研究构建SIRPα-GFP 真核表达载体,利用GFP 起到示踪的目的,荧光显微镜下观察HEK293T 细胞中融合蛋白的表达及定位,结果表明:SIRPα-GFP 融合蛋白在HEK293T 细胞膜上表达;Western blotting 法检测结果进一步验证了重组质粒SIRPα-GFP 转染HEK293T 细胞后融合蛋白的表达。
综上所述,本研究成功构建了SIRPα-GFP 真核表达载体,并利用脂质体转染试剂成功转染HEK293T 细胞,SIRPα-GFP 融合蛋白在HEK293T细胞中表达并位于HEK293T 细胞膜上,为后续SIRPα 的功能研究奠定基础。

