茯苓复合提取物对2 型糖尿病大鼠血糖和血脂水平的影响
张叶茁,杨岳峰,杨野仝,张颖,刘雅娟
(1.吉林大学公共卫生学院营养与食品卫生教研室,吉林 长春 130021;2.吉林省疾病预防控制中心食品所,吉林 长春 130062)
糖尿病(diabetes mellitus,DM)是一组由多病因引起的以慢性高血糖为特征的代谢性疾病,长期糖、脂肪和蛋白质等代谢紊乱可引起多器官多系统损害、功能减退及衰竭[1-2]。2 型糖尿病(type 2 diabetes mellitus,T2DM)是最主要和患病率增长最快的DM 类型[3]。目前,T2DM 的治疗药物多以西药为主,西药治疗DM 存在不良反应多和价格昂贵等缺点[4]。中草药中的功效成分具有较好调节血糖和血脂的作用,而且用药灵活,疗效稳定,标本兼治且无明显不良反应[5]。茯苓(Poria Cocos)俗称松苓和云苓,为多孔菌科卧孔菌属真菌茯苓的干燥菌核,史载于《神农百草经》,列为上品[6];人参为我国名贵中药材,为百草之王;刺五加为人参近缘植物,又称“西伯利亚人参”,与其他中药配伍可提升组方功效。研究[7-9]表明:茯苓可以降低大鼠空腹血糖(fasting blood glucose,FBG),还可以提高机体清除自由基能力;人参具有降低糖尿病大鼠总胆固醇(total cholesterol,TG)、甘油三酯(triglycerides,TC)、FBG 水平及明显升高胰岛素(insulin,INS)水平的生物学效应;刺五加具有调节糖脂代谢和增强抗氧化作用。目前茯苓复合提取物对T2DM 大鼠血糖、血脂水平及抗氧化能力影响的研究报道较少,本研究采用高糖高脂饲料饲喂联合小剂量链脲佐菌素(streptozotocin,STZ)构建T2DM 大鼠模型,探讨茯苓复合提取物对T2DM 大鼠血糖和血脂水平及抗氧化能力的影响,并阐明其作用机制,为研究防治T2DM 的保健品提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级SD 雄性大鼠65 只,4 周龄,体质量155~170 g,购于北京华阜康生物科技股份有限公司,动物生产许可证号:SCXK(京)2014-0004,饲养于吉林大学基础实验动物中心屏障系统,饲养室温22℃~24℃,相对湿度40%~55%,自由摄食、饮水,适应性饲养1 周。维持饲料由吉林大学基础实验动物中心提供,高糖高脂饲料(在维持饲料中添加15%蔗糖、15%猪油,适量的酪蛋白、磷酸氢钙和石粉等;其中脂肪提供总热量的40%,蛋白质提供总热量的22%,碳水化合物提供总热量的38%)购于南通特洛菲饲料科技有限公司。STZ 购自美国Sigma 公司,血清TG、TC、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、超氧化物歧化酶(superoxidedismutase,SOD)和丙二醛(malonaldehyde,MDA)测定试剂盒和胰岛素及胰高血糖素(glucagon,GC)酶联免疫试剂盒均购自南京建成生物工程研究所。血糖仪及同批号血糖试纸购自韩国i-SENS 公司,722s 型分光光度计、组织匀浆机、低速台式离心机和电子天平(型号ALC-110.4 和T1000)购自上海第二仪器分析厂,分析天平购自北京赛多利斯仪器系统有限公司,电热恒温水浴锅(型号1410146)和全功能酶标仪购自北京意成东方科技有限公司。
1.2 茯苓复合提取物的制备茯苓复合提取液,按10 倍日服处方量(主要原料:人参1.5 g,茯苓10.0 g,刺五加10.0 g)称取各味药材,加10 倍量水煎煮3 次,每次1 h,合并3 次水煎提取液,浓缩至每毫升1.5 g 生药量,高压灭菌4℃保存备用。
1.3 T2DM 大鼠模型的制备、分组及给药方式65 只SPF 级雄性SD 大鼠适应性喂养1 周,随机选取10 只大鼠作为对照组,其余55 只用于T2DM 模型制备。55 只大鼠给予高糖高脂饲料饲喂4周,第4周末,大鼠禁食12 h,按照30 mg·kg-1剂量一次性左下腹腹腔注射1% STZ,继续饲喂高糖高脂饲料1 周,检测FBG,以FBG 水平>11.1 mmol·L-1为建模成功[10]。造模成功大鼠随机分为5 组:模型组(n=8)、二甲双胍组(n=9,100 mg·kg-1·d-1二甲双胍灌胃)、低剂量茯苓复合提取物组(n=10,给予1.5 g·kg-1茯苓复合提取物灌胃,即成人每日推荐量5 倍)、中剂量茯苓复合提取物组(n=9,给予3.0 g·kg-1茯苓复合提取物灌胃,即成人每日推荐量10 倍)和高剂量茯苓复合提取物组(n=9,给予6.0 g·kg-1茯苓复合提取物灌胃,即成人每日推荐量20 倍)。各组大鼠灌胃体积均为10 mL·kg-1,模型组和对照组大鼠给予等体积双蒸水。每3 d 称取大鼠体质量1 次,按体质量变化调整给药剂量,连续灌胃28 d,每天1 次。第28 天给药后,将称取大鼠体质量,隔夜禁食不禁水12 h 后,心脏采血,分离血清,测定各项指标。
1.4 各组大鼠FBG 水平检测采集各组大鼠尾静脉血,采用血糖仪和血糖试纸检测各组大鼠FBG 水平。
1.5 各组大鼠血清样本采集及生化指标检测末次灌胃给药后禁食12 h,心脏采血,37℃静置2 h,2 500 r·min-1离心10 min,取血清,按照试剂盒说明书要求检测大鼠血清TC、TG、HDL-C、LDL-C、MDA、INS 和GC 水平及SOD 活性。计算稳态模型评估胰岛素抵抗指数(homeostasis model assessed the insulin resistance index,HOMAIR),评价其胰岛素抵抗(insulin resistance,IR)程度。HOMA-IR=FBG(mmol·L-1)× 空腹INS(mU·L-1)/22.5。
1.6 统计学分析采用SPSS 24.0 统计软件进行统计学分析。各组大鼠体质量,FBG 水平,血清中INS、GC、TC、TG、HDL-C、LDL-C 和MDA 水平,SOD 活性及HOMA-IR 均符合正态分布,以表示。多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠的一般情况对照组大鼠毛色光滑亮泽,精神状态良好,对外界环境刺激反应灵敏,动作迅速。模型组大鼠毛色焦枯,精神萎靡,反应迟缓,出现多饮多尿表现。实验过程中模型组、二甲双胍组、中和高剂量茯苓复合提取物组均有大鼠死亡。与模型组比较,二甲双胍组和低、中及高剂量茯苓复合提取物组大鼠毛色、精神状态、采食量、饮水量以及排尿量等均有所改善。
2.2 各组大鼠体质量和FBG 水平与对照组比较,模型组大鼠体质量明显降低(P<0.05),FBG 水平明显升高(P<0.05)。与模型组比较,二甲双胍组大鼠体质量明显升高(P<0.05),FBG 水平明显降低(P<0.05),低、中和高剂量茯苓复合提取物组大鼠体质量明显升高(P<0.05),FBG 水平明显降低(P<0.05)。见表1。
表1 各组大鼠体质量和FBG 水平Tab.1 Body weights and levels of FBG of rats in various groups()
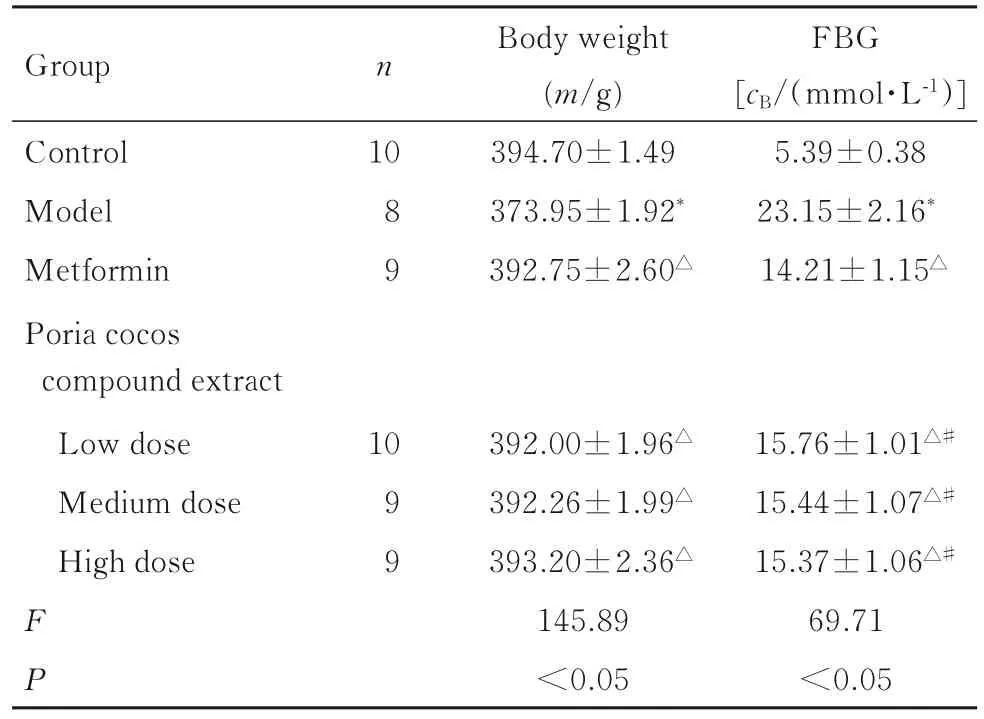
表1 各组大鼠体质量和FBG 水平Tab.1 Body weights and levels of FBG of rats in various groups()
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with metformin group.
2.3 各组大鼠血清中INS 和GC 水平及HOMAIR与对照组比较,模型组大鼠血清中INS 水平明显降低(P<0.05);与模型组比较,二甲双胍组和低、中及高剂量茯苓复合提取物组大鼠血清中INS 水平均明显升高(P<0.05)。与对照组比较,模型组大鼠血清中GC 水平和HOMA-IR 均明显升高(P<0.05);与模型组比较,二甲双胍组和低、中及高剂量茯苓复合提取物组大鼠血清中GC 水平和HOMA-IR 均明显降低(P<0.05);与二甲双胍组比较,低、中及高剂量茯苓复合提取物组大鼠血清中GC 水平均明显降低(P<0.05)。见表2。
表2 各组大鼠血清中INS 和GC 水平及HOMA-IRTab.2 Levels of serum INS and GC and HOMA-IR of rats in various groups()

表2 各组大鼠血清中INS 和GC 水平及HOMA-IRTab.2 Levels of serum INS and GC and HOMA-IR of rats in various groups()
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with metformin group.
2.4 各组大鼠血清中TC、TG、LDL-C、HDL-C 和MDA 水平及SOD 活性与对照组比较,模型组大鼠血清中TC、TG、LDL-C 和MDA 水平均明显升高(P<0.05);与模型组比较,二甲双胍组和低、中及高剂量茯苓复合提取物组大鼠血清中TC、TG、LDL-C 和MDA 水平均明显降低(P<0.05);与二甲双胍组比较,低、中和高剂量茯苓复合提取物组大鼠血清中LDL-C 水平均明显降低(P<0.05)。与对照组比较,模型组大鼠血清中HDL-C水平和SOD 活性均明显降低(P<0.05);与模型组比较,二甲双胍组和低、中及高剂量茯苓复合提取物组大鼠血清中HDL-C 水平和SOD 活性均明显升高(P<0.05)。见表3。
3 讨论
DM 是目前发病率较高的慢性非传染性疾病,尤其是T2DM,严重威胁着人类健康。T2DM 的发病机制主要是由于机体代谢紊乱,导致IR 及胰岛功能障碍,胰岛素分泌减少、敏感性降低,使机体糖脂代谢异常[11]。中草药中很多功效成分具有调节糖脂代谢,增强机体抗氧化能力的作用。
茯苓复合提取物中茯苓多糖能使细胞肝脏糖原含量增加,通过加速糖原的合成,表现出降血糖活性[12]。人参中含有的酚类物质和人参皂苷可降低细胞对葡萄糖的摄取和转运,调节DM 大鼠血清中INS 水平,明显降低尿糖排泄水平[13]。刺五加叶能抑制α-葡糖苷酶活性,抑制人肠道细胞对2’-脱氧D-葡萄糖(DG)的吸收,通过葡萄糖转运蛋白抑制细胞内的DG 摄取[14]。本研究结果表明:给予高糖高脂喂养联合腹腔注射STZ 后,大鼠体质量明显降低,FBG>11.1 mmol·L-1,表明T2DM 模型大鼠建模成功。DM 伴发IR 常用HOMA-IR 评价IR 程度,INS 能够降低血糖,增加葡萄糖的去路,发挥其降糖功能。GC 能促进脂肪和蛋白质分解,抑制糖原合成,升高FBG 水平。检测INS 和GC 水平,能直观体现机体的胰岛分泌状态,是临床上诊断和确诊DM 常用指标[15]。本研究结果显示:给予低、中和高剂量茯苓复合提取物后T2DM 模型大鼠体质量血清中INS 水平明显升高,FBG 水平和血清中GC 水平及HOMA-IR 均明显降低,表明不同剂量茯苓复合提取物中的功效成分可平衡大鼠能量代谢,调节INS 分泌水平,改善大鼠IR,具有调节T2DM 模型大鼠血糖功效。茯苓多糖是一种膳食纤维,能改善餐后血糖,降低脂类吸收[16-17];刺五加叶子含有31.8%的膳食纤维,膳食纤维已被证明可降低血清中TG 和TC 水平,并通过抑制膳食胆固醇吸收或胆汁酸再吸收而具有抗肥胖作用[18-20]。DM 大鼠脂肪代谢异常,表现为血清中TC、TG 和LDL-C 水平升高,HDL-C 水平降低。血脂是临床上评价DM 预防和治疗效果的常用指标。本研究结果显示:茯苓复合提取物可明显降低DM 大鼠血清中TG、TC 和LDL-C 水平,升高HDL-C 水平,具有调节血脂的功效。DM 会导致氧化应激增加,损伤多器官,降低抗氧化防御,并导致内皮功能障碍。MDA 是氧自由基攻击组织的产物[21],SOD 活性的高低反映机体清除氧自由基能力[22]。本研究结果表明:茯苓复合提取物可增加血清中SOD 活性,降低MDA 水平,提示复合物中功效成分可有效清除自由基,对抗自由基损伤。
表3 各组大鼠血清中TC、TG、LDL-C、HDL-C 和MDA 水平及SOD 活性Tab.3 Serum TC,TG,LDL-C,HDL-C and MDA levels and SOD activities of rats in various groups()

表3 各组大鼠血清中TC、TG、LDL-C、HDL-C 和MDA 水平及SOD 活性Tab.3 Serum TC,TG,LDL-C,HDL-C and MDA levels and SOD activities of rats in various groups()
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with metformin group.
综上所述,茯苓复合提取物可调节T2DM 大鼠体质量,有效降低T2DM 大鼠FBG 和GC 水平及HOMA-IR,提高INS 水平,改善脂代谢水平,提高机体氧化应激能力,可辅助治疗T2DM。

