水稻OsWHY1基因克隆及过表达与RNAi载体构建
何雅婷,居超明,陈建国
(湖北大学生命科学学院,湖北 武汉 430062)
0 引言
水稻(Oryzasativa)是最重要的粮食作物之一,是世界一半以上人口的主要食物来源[1].由于人口增长的压力越来越大,再加上生物和非生物胁迫导致的作物减产,迫切需要采用可持续战略来改善粮食供应[2-4].持绿(stay-green)性状的利用是克服当前作物产量瓶颈的一种重要策略,同时还可以提高品种的适应性和稳定性[5].持绿性是指模式植物和作物物种中叶片衰老延迟的可遗传的特征[6].在作物中,持绿性使植株能够保持绿色并在非生物胁迫下继续进行光合作用[7].持绿性与叶肉细胞的抗氧化状态和光系统II有关[8].在许多谷类作物中,持绿植株通常具有较高的叶绿素含量并且在籽粒灌浆期间对非生物胁迫更具耐受性.在高粱中观察到,在水分胁迫条件下的籽粒灌浆期间,具有这种性状的基因型比缺乏它的基因型保持更多的光合活性叶面积[9].由于水分胁迫,同化作用受限,持绿性在小麦籽粒灌浆期也起着重要作用[10].因此,研究水稻持绿性对作物改良具有重大意义.
whirly 1最初发现是参与水杨酸依赖性病原体应答(pathogen response,PR)基因表达的核转录因子[11],但后来的研究也在叶绿体中检测到whirly 1 蛋白[12].通过构建在叶绿体内能合成带有重组血凝素(HA)标签的whirly 1蛋白的转基因烟草证明了whirly 1能从叶绿体转移到细胞核[13].在拟南芥和大麦的叶绿体中,whirly 1被证明与转录活性染色质紧密相关,表明质体定位的whirly1主要在RNA代谢中起作用,而不是单纯作为DNA结合蛋白[14].此外,whirly 1被证明是玉米和拟南芥中质体核的最丰富的蛋白质之一[15].在拟南芥中,whirly 1是质体基因组稳定性所必需的[16],并且在大麦中发现它可以压缩核仁并调节质体DNA拷贝数[17].大麦中的whirly 1蛋白被鉴定为衰老相关基因HvS40的潜在调节因子[18].当植物在低光强度下生长时,野生型和RNAi-WHY1植物之间的衰老进程相似.同样,黑暗诱导的离体叶片的衰老不受whirly 1减少的影响.然而,当植物在高光强度下生长时,在野生型植物中过早诱导衰老,但在RNAi-WHY1植物中延迟.该结果表明,whirly 1在叶绿体和细胞核之间的光传感或应激通讯中起作用.干旱处理加速了野生型植物的叶片衰老,而RNAi-WHY1显示出持绿的表型.衰老相关基因和干旱胁迫响应基因的表达在转基因植物中被延迟[19].单链DNA结合蛋白whirly 1在拟南芥的叶片衰老过程中以发育阶段依赖性方式作为WRKY53的上游抑制剂起作用[20],WHY1突变体表现出早衰的表型.在该背景下,WRKY53和衰老相关蛋白酶基因SAG12的表达水平增加.whirly 1的双重定位使其成为研究在正常叶片发育和各种胁迫情况下将信号从叶绿体转导至细胞核的候选基因.本研究以籼稻品系金23B的cDNA为模板,克隆得到水稻whirly 1基因(OsWHY1)序列,对该基因进行了生物信息学分析.分别构建了OsWHY1过表达载体和干扰载体并成功转化农杆菌,为进一步研究该基因在水稻持绿性中的作用打下基础.
1 材料与方法
1.1 实验材料水稻品系金23B由本实验保存.选择生长健康的水稻叶片为材料,于-80 ℃保存.植物表达载体pU1300,PTCK303由本实验室保存.克隆载体pClone007 Blunt Vector和大肠杆菌DH5α感受态购自擎科生物技术公司.EasyTaq DNA Polymerase,T4 DNA连接酶购自全式金生物公司.Eastep Super总RNA提取试剂盒,GoScriptTM逆转录试剂盒购自Promega生物公司.普通琼脂糖凝胶DNA回收试剂盒,质粒小提试剂盒购自天根生化有限公司.BamHⅠ,SacⅠ,KpnⅠ,SpeⅠ购自诺唯赞生物公司.EHA105农杆菌感受态购自上海唯地生物技术有限公司.氨苄霉素,卡那霉素,利福平购自生工生物工程股份有限公司.
1.2 RNA提取及cDNA合成金23B的叶片总RNA的提取方法参考Eastep Super总RNA提取试剂盒说明书,用于PCR的cDNA合成方法详见GoScriptTM逆转录试剂盒说明书.
1.3OsWHY1基因的克隆及干扰片段的扩增根据NCBI上水稻WHY1预测序列,设计引物QC(表1),以金23B cDNA为模板扩增WHY1基因序列.PCR用EasyTaq DNA Polymerase,反应程序详见说明书,Tm值60 ℃,延伸时间1 min.经凝胶电泳后,切下目的片段,按照试剂盒说明书步骤进行回收.回收片段连接克隆载体pClone007 Blunt Vector,转化大肠杆菌DH5α,挑取菌落进行阳性鉴定,然后送武汉擎科生物公司进行测序.利用WHY1基因编码序列(coding sequence,CDS)引物(表1)以WHY1基因克隆质粒为模板扩增CDS,连接克隆载体,转化大肠杆菌DH5α;选取WHY1基因起始密码子到360 bp的片段作为干扰靶序列,设计添加有酶切位点的引物(表1).分别以WHY1基因克隆载体质粒为模板,扩增RNAi正反片段并连接到pClone007 Blunt Vector,转化大肠杆菌DH5α.
1.4 生物信息学分析利用NCBI上的ORFfinder查找OsWHY1基因的开放阅读框,并对其蛋白序列进行预测;运用ExPASy-ProtScale分析预测的蛋白序列;利用TMHMM对蛋白质进行跨膜分析;利用SWISS-MODEL软件在线预测蛋白质结构;利用NCBI上的protein blast搜索蛋白质同源序列;利用MEGA7.0根据neighbor-Joining构建系统进化树;利用DNAMAN进行蛋白质序列比对.
1.5 基因表达载体构建提取OsWHY1 CDS序列与干扰片段克隆载体质粒.用BamHⅠ与SacⅠ酶切OsWHY1 CDS序列质粒与pU1300质粒,琼脂糖凝胶电泳检测后切取目的条带用试剂盒回收,用T4连接酶按说明书配置体系(37 ℃反应30 min),连接产物转化大肠杆菌DH5α.对转化菌落进行阳性鉴定后,扩大培养,抽取质粒,进行PCR与酶切鉴定,鉴定无误后利用冻融法转化农杆菌EHA105,并进行菌落PCR鉴定,阳性菌加入50%甘油于-80 ℃保存.
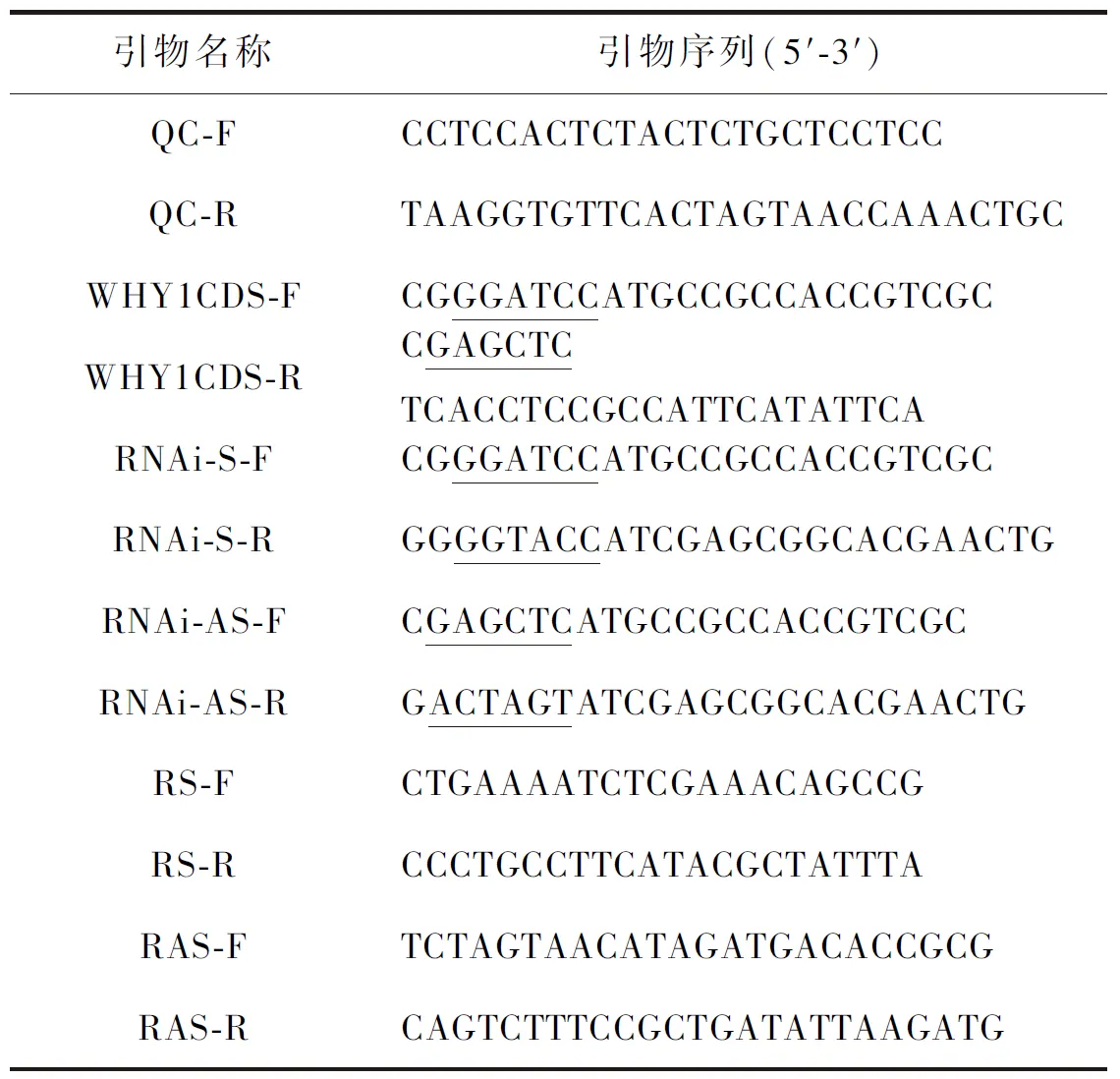
表1 基因克隆及载体构建引物信息
下划线为酶切位点

M:DL2000 DNA Marker;1~4:金23B总RNA图1 金23B总RNA凝胶电泳
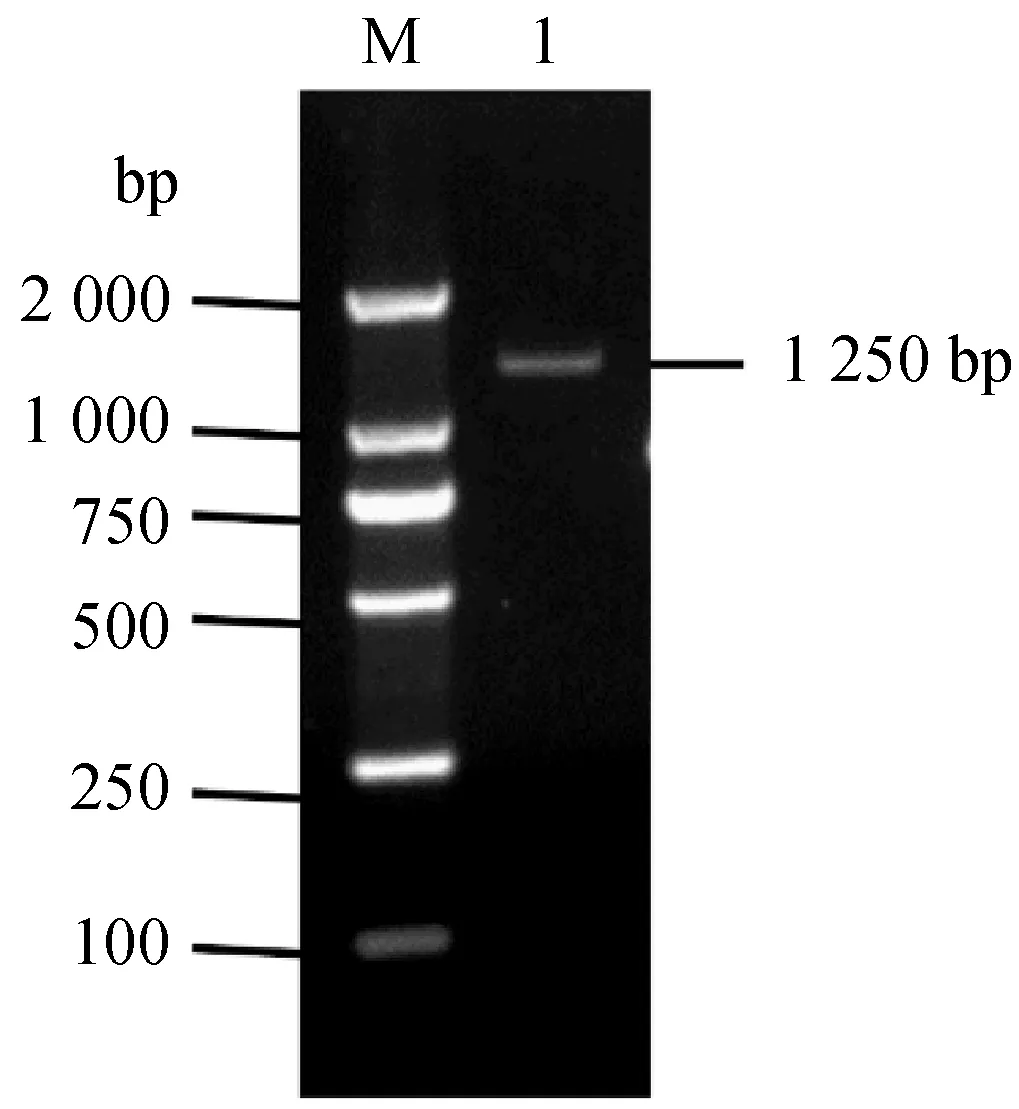
M:DL2000 DNA Marker;1:OsWHY1基因图2 水稻OsWHY1基因的PCR扩增
用SacⅠ与SpeⅠ双酶切正义链载体与PTCK303表达载体,回收片段后用T4连接酶连接,转化大肠杆菌DH5α,抽提质粒后用RS引物(表1)进行PCR验证.用KpnⅠ与BamHⅠ双酶切反义链载体与连接有正义链的PTCK303表达载体,回收片段后用T4连接酶连接,转化大肠杆菌DH5α,抽提质粒后用RAS引物(表1)进行PCR验证与SacⅠ与BamHⅠ双酶切验证.利用冻融法转化农杆菌EHA105,并进行菌落PCR鉴定,阳性菌液加入50%甘油于-80 ℃保存.
2 结果与分析
2.1 水稻总RNA提取本研究提取金23B叶片的总RNA,用微量核酸测定仪测得RNA的浓度为500~900 ng/μL,其OD260/280在1.8到2.0之间,经琼脂糖凝胶电泳鉴定RNA条带完整,可以用于后续试验(图1).
2.2OsWHY1基因cDNA序列克隆提取的金23B叶片总RNA经反转录得到cDNA,以该cDNA为模板,设计引物扩增得到OsWHY1基因全长序列,片段大小为1 250 bp(图2).连接克隆载体pClone007 Blunt Vector后进行测序,与NCBI上预测的OsWHY1基因序列比对正确后进行后续试验.
2.3WHY1基因的生物信息学分析利用NCBI上的ORFfinder分析发现该基因开放阅读框长度为825 bp,编码274个氨基酸.使用ExPASy-ProtScale软件对编码的氨基酸序列进行分析发现,该蛋白分子质量为30.359 kD,等电点为9.41,不稳定系数为61.15,平均亲水系数为-0.423,是不稳定的亲水蛋白(图3).使用TMHMM软件分析OsWHY1蛋白的跨膜区,预测结果表明该蛋白无跨膜区域(图4).使用NCBI上Conserved domains分析OsWHY1蛋白结构域,结果显示OsWHY1具有whirly结构域,属于whirly超级家族成员(图5).利用SWISS-MODEL软件在线预测并构建OsWHY1蛋白的三级结构,其主要结构由α-螺旋和β-折叠组成(图6).根据OsWHY1基因编码的蛋白质序列,在NCBI上用protein blast搜索并下载多个物种的WHY1基因同源序列.利用MEGA7.0构建WHY1基因进化树,结果表明籼稻与粳稻的亲缘关系最近,其次是野生稻(图7).选取6个与OsWHY1相似性较高的物种利用DNAMAN进行序列比对,结果如图8所示,籼稻(Oryzasativaindica)OsWHY1蛋白与粳稻(Oryzasativajaponica)、玉米(Zeamays)、小米(Setariaitalica)、黍(Panicummiliaceum)、高粱(Sorghumbicolor)、大麦(Hordeumvulgare)的相似性分别是99.6%、79.8%、83.1%、82.7%、78.7%和75.3%.

图3 OsWHY1蛋白亲疏水性分析

图4 OsWHY1蛋白跨膜区分析
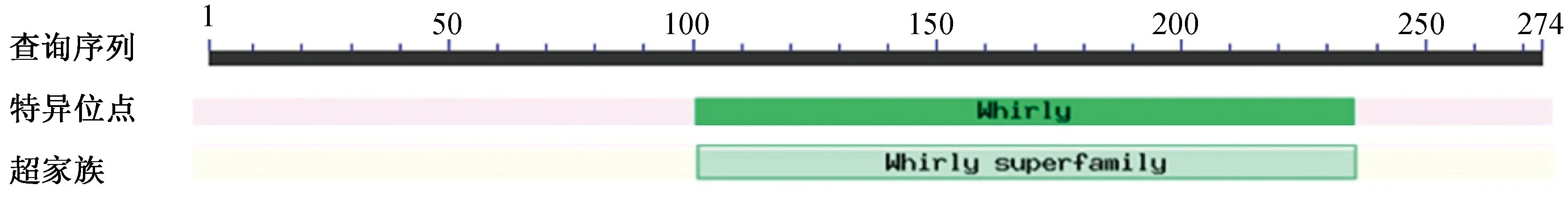
图5 OsWHY1蛋白结构域分析
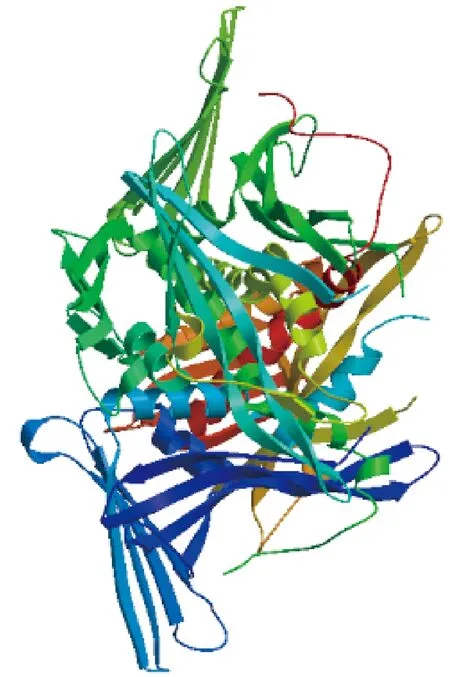
图6 OsWHY1蛋白三级结构预测模型
2.4OsWHY1超表达载体构建设计带有BamHⅠ与SacⅠ酶切位点的引物,以OsWHY1基因克隆质粒为模板,扩增WHY1基因CDS序列(图9),连接克隆载体.用BamHⅠ与SacⅠ双酶切该载体与表达载体pU1300(非空载)(图10),回收片段后用T4连接酶连接,转化大肠杆菌DH5α,抽提质粒双酶切验证(图11),送公司测序,测序结果正确后转化农杆菌EHA105,并对菌液进行PCR验证(图12).
2.5OsWHY1干扰载体构建分别设计带有KpnⅠ与BamHⅠ酶切位点、SacⅠ与SpeⅠ酶切位点的引物,以OsWHY1基因克隆质粒为模板,扩增360 bp干扰片段的正反链(图13),连接克隆载体.用SacⅠ与SpeⅠ双酶切正义链载体(OsWHY1-RNAi-S)与PTCK303表达载体(图14),回收片段后用T4连接酶连接转化大肠杆菌DH5α,用RS引物进行PCR验证(图15).用KpnⅠ与BamHⅠ双酶切反义链载体(OsWHY1-RNAi-AS)(图16)与连接有正义链的PTCK303表达载体(PTCK303-RNAi-S),回收片段后用T4连接酶连接转化大肠杆菌DH5α,用RAS引物进行PCR验证(图17).构建好的载体(PTCK303-OsWHY1)用SacⅠ与BamHⅠ双酶切检测(图18),然后送公司进行测序,测序结果正确后转化农杆菌EHA105并对菌液进行PCR验证(图19).

图7 OsWHY1与其他物种WHY1蛋白进化树分析
M:100 bp DNA Marker;1~2:OsWHY1基因CDS序列图9 OsWHY1基因CDS序列PCR
M:100 bp DNA Marker;1:pU1300表达载体双酶切;2:OsWHY1基因CDS序列克隆载体双酶切图10 pU1300表达载体与OsWHY1基因CDS序列T载BamHⅠ与SacⅠ双酶切

M:100 bp DNA Marker;1:pU1300-OsWHY1表达载体;2:双酶切pU1300-OsWHY1表达载体图11 pU1300-OsWHY1表达载体BamHⅠ与SacⅠ双酶切验证


图8 OsWHY1与其他物种WHY1蛋白序列比对

M:100 bp DNA Marker;1:pU1300-OsWHY1农杆菌PCR图12 pU1300-OsWHY1农杆菌PCR检测
M:100 bp DNA Marker;1:OsWHY1干扰片段正义链;2:OsWHY1干扰片段反义链图13 OsWHY1干扰片段正反链PCR

M:100 bp DNA Marker;1:OsWHY1-RNAi-S质粒双酶切;2:PTCK303表达载体双酶切图14 PTCK303表达载体与OsWHY1-RNAi-S质粒SacⅠ与SpeⅠ双酶切

M:100 bp DNA Marker;1:PTCK303;2:PTCK303-RNAi-S图15 PTCK303-RNAi-S与PTCK303 PCR检测
M:100 bp DNA Marker;1:OsWHY1-RNAi-AS质粒双酶切图16 OsWHY1-RNAi-AS质粒KpnⅠ与BamHⅠ双酶切
M:100 bp DNA Marker;1:PTCK303;2:PTCK303-OsWHY1图17 PTCK303-OsWHY1表达载体与PTCK303 PCR检测
M:DL2000 DNA Marker;1~2:PTCK303-OsWHY1表达载体双酶切图18 PTCK303-OsWHY1表达载体SacⅠ与BamHⅠ双酶切检测
M:DL2000 DNA Marker;1:PTCK303-OsWHY1质粒RS引物PCR;2~3:PTCK303-OsWHY1农杆菌RS引物PCR;4:PTCK303-OsWHY1质粒RAS引物PCR;5~6:PTCK303-OsWHY1农杆菌RAS引物PCR图19 PTCK303-OsWHY1农杆菌PCR检测
3 讨论
Whirly 1在植物中被广泛研究,作为一种DNA单链结合蛋白,它具有多种功能.而作为一种细胞核与叶绿体双重定位的蛋白质,它也是研究叶绿体与细胞核之间信号转导的有效工具.到目前为止WHY1基因在水稻中的功能研究较少,OsWHY1基因的具体功能尚不清楚.本研究通过蛋白质同源序列比对发现whirly 1蛋白在各物种中的氨基酸序列相对保守,猜想OsWHY1可能具有与大麦和拟南芥WHY1基因相同的功能.构建超表达载体与RNA干扰载体并转化到个体中来改变基因的表达量是研究基因功能的常用手段.本研究成功构建了OsWHY1基因超表达与干扰载体,并将其转化到农杆菌中,而OsWHY1基因对水稻持绿性的影响还需要通过农杆菌转化法将载体转化进植株中进行验证,为探索OsWHY1基因在水稻持绿性方面的作用提供帮助.

