BamHⅠ+XhoⅠ双酶切质粒电泳弥散原因初探
金科华,张惠敏,杨志珅,金天颖,卢晓晓
(1湖北科技学院医药研究院,咸宁 437100;2湖北科技学院基础医学院基础医学研究所;3湖北科技学院基础医学院)
BamHⅠ+XhoⅠ双酶切质粒电泳弥散原因初探
金科华1,2,张惠敏3,杨志珅3,金天颖3,卢晓晓3
(1湖北科技学院医药研究院,咸宁 437100;2湖北科技学院基础医学院基础医学研究所;3湖北科技学院基础医学院)
目的 探讨TaKaRa公司(中国大连)快速限制酶BamHⅠ+XhoⅠ 37 ℃双酶切质粒pET-28a、pET-28a-SDHA产生弥散的原因。 方法 比较4种条件下酶切对弥散的影响:①BamHⅠ+XhoⅠ 37 ℃双酶切Elution Buffer(EB)洗脱或水洗脱的质粒;②NdeⅠ+XhoⅠ 37 ℃双酶切EB洗脱或水洗脱的质粒;③先BamHⅠ 30 ℃酶切,再XhoⅠ 37 ℃酶切;④BamHⅠ分别于30 ℃、37 ℃单酶切。 结果 ①BamHⅠ+XhoⅠ 37 ℃双酶切EB或水洗脱的质粒均产生严重弥散;②NdeⅠ+XhoⅠ 37 ℃双酶切EB洗脱或水洗脱的质粒无弥散;③BamHⅠ 30 ℃酶切+XhoⅠ 37 ℃酶切,无弥散;④BamHⅠ 30 ℃单酶切无弥散,37 ℃单酶切严重弥散。 结论BamHⅠ+XhoⅠ 37 ℃酶切质粒电泳弥散是BamHⅠ在此温度下的星活性所致。
BamHⅠ; 双酶切; 弥散; 星活性
双酶切鉴定是判断DNA重组成功与否的重要方法[1-4]。限制酶在高pH、低离子强度、不合适的金属辅因子[5]、有机溶剂、高甘油浓度[6]条件下酶切易产生星活性,干扰鉴定结果的判读。然而,反应温度对限制酶星活性的影响鲜见报道。双酶切鉴定含琥珀酸脱氢酶亚基A(SDHA)cDNA(1995bp)的重组质粒pET-28a-SDHA(下称28a-SDHA)时,发现BamHⅠ 37 ℃酶切时出现强星活性,导致产物弥散,而30 ℃酶切时,弥散消除,现予以报道。
1 材料与方法
1.1 DNA和主要试剂
重组质粒28a-SDHA,28a-AMY1A(AMY1A,唾液淀粉酶A)为前期构建(插入pET-28a的BamHⅠ、XhoⅠ位点间)。质粒提取试剂盒、50×TAE购自生工生物工程(上海)股份有限公司。快速限制性内切酶及10×DNA Loading Buffer购自TaKaRa(大连)公司。
1.2 实验思路
为探索BamHⅠ+XhoⅠ 37 ℃双酶切质粒电泳弥散的原因,比较4个条件对弥散的影响:①不同溶液洗脱的质粒;②不同的限制酶组合双酶切;③不同温度分步双酶切;④同一酶不同温度单酶切。
1.3BamHⅠ+XhoⅠ 37 ℃双酶切EB洗脱、水洗脱的质粒

按上述步骤抽提质粒,换用60 μl超纯水洗脱质粒。按1.2双酶切、电泳。
1.4NdeⅠ+XhoⅠ 37 ℃双酶切EB、水洗脱的质粒
按1.3抽提质粒,将BamHⅠ更换为NdeⅠ,按1.3双酶切、电泳。
1.5BamHⅠ 30 ℃单酶切+XhoⅠ 37 ℃单酶切
取1.3 EB洗脱的质粒,BamHⅠ单酶切:28a(或28a-SDHA)6 μl+H2O 6.5 μl+BamHⅠ 1 μl+10×Buffer 1.5 μl,30 ℃酶切15 min。将反应管置65 ℃热灭活20 min,冰浴冷却。加10×Buffer 0.5 μl、XhoⅠ 1μl、H2O 3.5 μl,37 ℃酶切15 min。加3 μl 10×LBuffer终止反应,电泳检测。
1.6BamHⅠ 30 ℃、37 ℃分步单酶切
取1.3的质粒两份,一份30 ℃单酶切:28a(或28a-SDHA)6 μl+H2O 11 μl+BamHⅠ 1 μl+10×Buffer 2 μl,30 ℃酶切15 min;另一份,按相同酶切体系37 ℃酶切15 min。加3 μl 10×LBuffer 终止反应,电泳。
以上实验均为3次生物学重复。
2 结果
2.1BamHⅠ+XhoⅠ 37 ℃双酶切EB、水洗脱质粒均出现严重弥散
质粒28a(5 369 bp)经BamHⅠ+XhoⅠ双酶切应出现一条约5 300 bp的条带;28a-SDHA应出现约5 300 bp、约1 995 bp的带各1条。EB洗脱的28a、28a-SDHA经BamHⅠ+XhoⅠ 37 ℃双酶切后未出现上述条带,代之以严重的弥散(图1的 1,2泳道)。盐离子浓度会影响限制酶的活性,EB中含有一定量的盐离子,为排除其对酶活性的影响,以超纯水取代EB洗脱抽提的质粒,随后酶切。电泳显示BamHⅠ+XhoⅠ 37 ℃酶切水洗脱的质粒出现
与EB洗脱相似程度的弥散(图1的3,4泳道)。可见,弥散与洗脱质粒所用溶液无关。
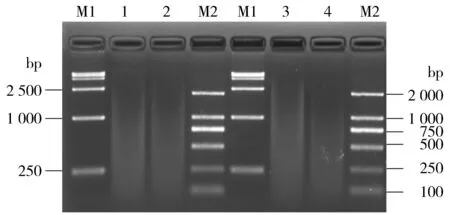
M1.DL15000 DNA Marker; M2.Trans2K DNA Marker; 1, 2.分别为BamHⅠ+Xho Ⅰ 37 ℃酶切EB洗脱的28a, 28a-SDHA; 3,4.分别为BamHⅠ+Xho Ⅰ 37 ℃酶切水洗脱的28a, 28a-SDHA图1 电泳检测BamHⅠ+Xho Ⅰ 37 ℃酶切EB、水洗脱质粒的产物Figure 1 Electrophoresis of product of plasmids eluted by EB or water and digested with BamHⅠ and Xho Ⅰ at 37 ℃
2.2NdeⅠ+XhoⅠ 37 ℃双酶切EB、水洗脱的质粒产物未出现弥散
XhoⅠ最适温度为37 ℃,弥散不可能是其37 ℃酶切产生的星活性所致。BamHⅠ使用说明书指出BamHⅠ在37 ℃酶切时具有与30 ℃相似的活性,但不够稳定。为此,推测弥散可能与BamHⅠ 37 ℃酶切产生的星活性有关。28a的多克隆位点中,NdeⅠ位点(不存在于SDHA cDNA中)位于BamHⅠ上游36 bp处,其最适温度为37 ℃。改用NdeⅠ+XhoⅠ酶切鉴定重组质粒。结果显示,无论EB洗脱还是水洗脱的28a和28a-SDHA,酶切产物均未出现弥散;载体大片段(绿色箭头示)和SDHA小片段(红色箭头示)分子量与理论值相符(图2A)。据图1、图2结果,初步推断弥散是BamHⅠ 37 ℃产生的星活性所致。
2.3BamHⅠ、XhoⅠ不同温度分步酶切质粒未出现弥散
为进一步证实2.3的推断,按1.5先BamHⅠ 30 ℃酶切,再XhoⅠ 37 ℃酶切。结果显示,酶切产物未出现弥散,载体大片段(绿色箭头示)和SDHA小片段(红色箭头示)清晰可见,分子量正确(图3)。可见,弥散确为BamHⅠ 37 ℃酶切产生的星活性所致。
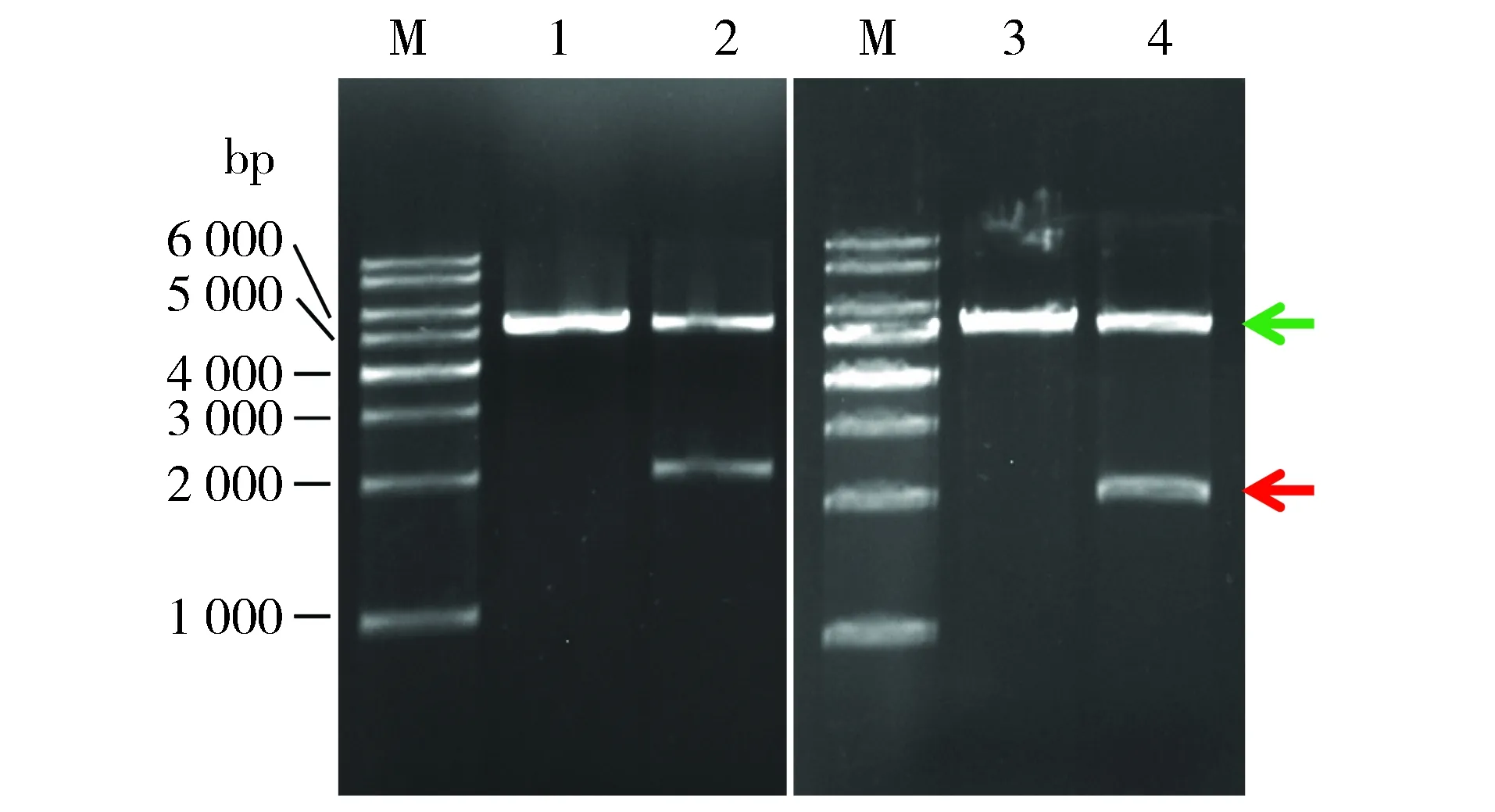
M.1 kb DNA Ladder;1,2.分别为Nde Ⅰ+Xho Ⅰ 37 ℃酶切EB洗脱的28a, 28a-SDHA;3,4.分别为Nde Ⅰ+Xho Ⅰ 37 ℃酶切水洗脱的28a, 28a-SDHA图2 电泳检测Nde Ⅰ+Xho Ⅰ 37 ℃酶切EB、水洗脱质粒的产物Figure 2 Electrophoresis of product of plasmids eluted by EB or water and digested with Nde Ⅰ plus Xho Ⅰ at 37 ℃
M.1 kb DNA Ladder;1,2.分别为BamHⅠ 30 ℃+Xho Ⅰ 37 ℃酶切EB洗脱的28a, 28a-SDHA图3 电泳检测BamHⅠ 30 ℃+Xho Ⅰ 37 ℃酶切质粒的产物Figure 3 Electrophoresis of product of plasmids digested with BamHⅠ at 30 ℃ plus Xho Ⅰ at 37 ℃
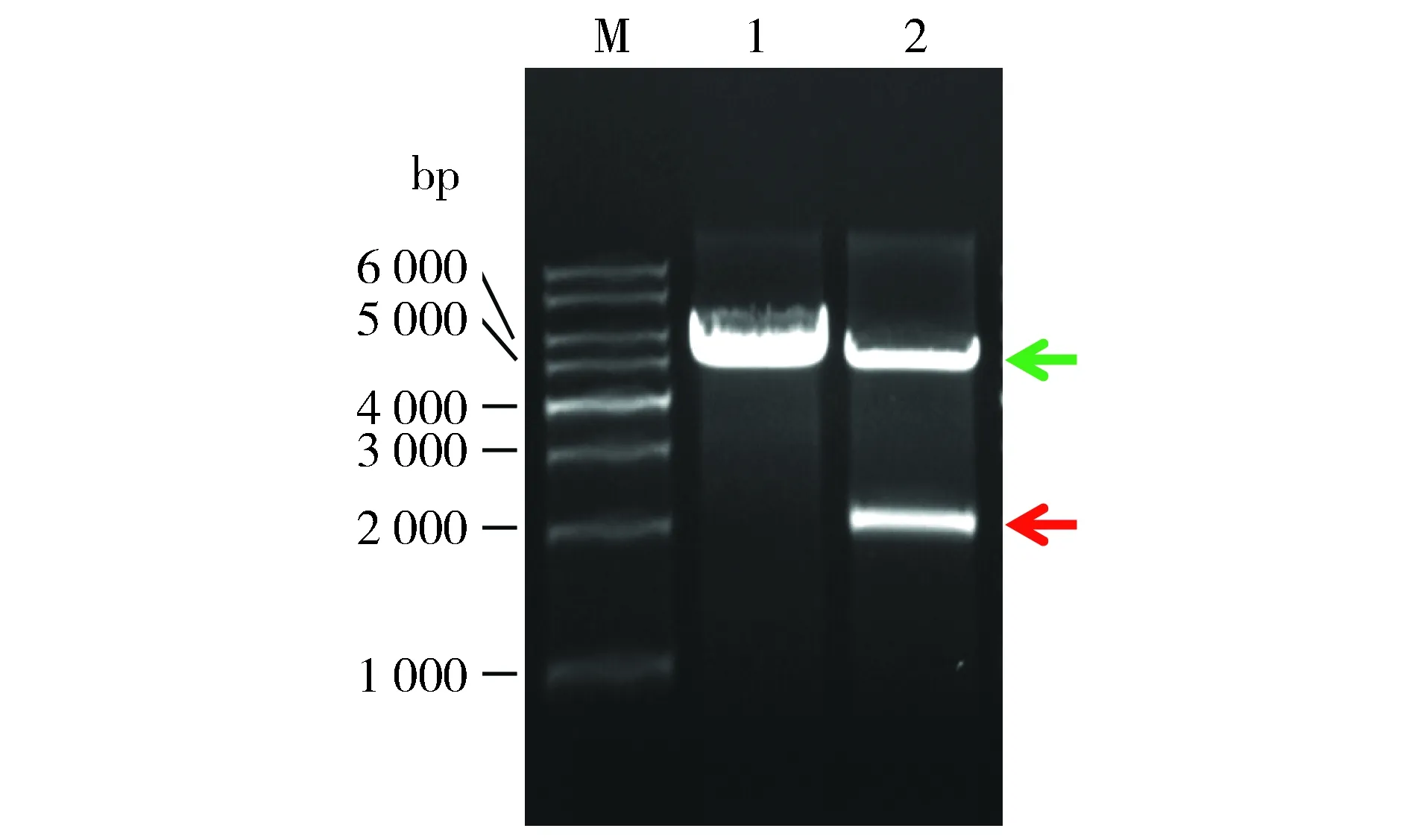
2.4BamHⅠ 30 ℃单酶切无弥散、37 ℃单酶切弥散严重
为佐证弥散由BamHⅠ的星活性所致,按1.6对质粒进行BamHⅠ单酶切。结果显示,30 ℃酶切未出现弥散;37 ℃酶切严重弥散(见图4),但较之BamHⅠ+XhoⅠ双酶切明显减轻。可见,弥散为BamHⅠ在37 ℃的星活性所致,且XhoⅠ与之双酶切加重弥散。
3 讨论
琼脂糖凝胶电泳弥散与陈旧的电泳缓冲液、过高的电压及不正确的酶切体系有关。本文所用电泳缓冲液均新鲜配制,每电泳5次即行更换,故弥散与电泳缓冲液无关;所用电场强度6 V/cm,在合理范围内,故可排除电场强度对弥散的影响。据此推测,弥散源自不正确的酶切导致的星活性。
M.1 kb DNA Ladder; 1, 2.分别为BamHⅠ 30 ℃酶切28a、28a-SDHA的产物; 3,4.分别为BamHⅠ 37 ℃酶切28a、28a-SDHA的产物图4 BamHⅠ不同温度酶切对弥散的影响Figure 4 The effect of BamHⅠ digestion at different temperatures on smear
导致限制性内切酶产生星活性的因素众多,如错误的缓冲液、酶切时间过长、酶切体系甘油浓度过高等。限制酶缓冲液均经过厂家反复优化,使用厂家推荐的缓冲液,限制酶均能达到100%活性,本文使用推荐的缓冲液;酶切时间短(15 min);酶切体系甘油浓度为5%。故本实验出现的星活性与上述因素无关。为此,推测弥散可能是酶切温度不当出现的星活性所致。
BamHⅠ使用说明书指出:BamHⅠ最适酶切温度为30 ℃,在37 ℃也具有极高活性,但不够稳定。“不够稳定”易被理解为活性时高时低,不易被理解为出现星活性,导致酶切产物弥散,故此描述不易引起重视。加之双酶切省时省力,科研人员常忽略这种含糊的描述,直接与其他最适温度为37 ℃的酶于37 ℃双酶切。如此酶切易出现弥散,而不以为然。标准条件下BamHⅠ识别的经典序列为GGATCC[8];非标准条件下识别经典序列的概率极大降低,识别非经典序列GGAACC、GGCTCC、GAATCC和GGATCN[9]的概率升高。非经典序列在28a内出现的次数分别为2,1,0,8,在SDHA cDNA内出现的次数分别为1,1,0,8,累计在28a-SDHA内出现21次,为此在37 ℃酶切产生弥散不难理解。
BamHⅠ 37 ℃酶切出现星活性并非偶然现象。平行抽提、酶切的重组质粒28a-AMY1A,出现与28a-SDHA类似的弥散(结果未列)。
BamHⅠ 37 ℃单独酶切的弥散程度低于与XhoⅠ双酶切,可见两种最佳酶切温度不同的限制酶在其中一种酶的最佳温度下双酶切,处于最适温度的酶会加重非最适温度酶的星活性,其机制有待研究。
总之,本文发现BamHⅠ+XhoⅠ 37 ℃双酶切的质粒电泳弥散的原因是BamHⅠ出现的星号活性。
[1] 王婷, 雷佳文, 李培武, 等. 抗黄曲霉毒素单链抗体在毕赤酵母X-33中的表达[J]. 中国油料作物学报, 2017, 39(1):113-116.
[2] 吕亚丰, 杨建林, 秦宇, 等. 人抗酶抑制因子-1的原核表达纯化及多克隆抗体的制备[J]. 生物技术通报, 2017, 33(3):193-198.
[3] 徐耀瑜, 胡玲玲, 陈永井, 等. CD80鼠-人嵌合抗体的CHO细胞表达及体外生物学功能的初步研究[J]. 中国免疫学杂志, 2009, 25(2):114-117.
[4] 李华, 杨婷, 岳磊, 等. 人呼吸道合胞病毒截短F1蛋白的原核表达及其免疫原性评价[J]. 中国生物制品学杂志, 2017, (1):19-24.
[5] Hsu M, Berg P. Altering the specificity of restriction endonuclease effect of replacing Mg2+with Mn2+[J]. Biochemistry, 1978, 17(1):131-138.
[6] Nasr M, Thomas D. Relaxation of recognition sequence of specific endonuclease HindIII [J]. Nucleic Acids Res, 1986, 14(2):811-821.
[7] 金科华, 刘洁. 质粒抽提策略对双酶切鉴定的影响[J]. 山西医科大学学报, 2015, 46(6):559-561.
[8] Roberts RJ, Wilson GA, Young FE. Recognition sequence of specific endonucleaseBamHI from Bacillus amyloliquefaciens H [J]. Nature, 1977, 265(5589):82-84.
[9] Robinson CR, Sligar SG. Heterogeneity in molecular recognition by restrictionBamHⅠ,PvuⅡ,and EcoRV specificity [J]. Proc Natl Acad Sci USA, 1995, 92(8):3444-3448.
PreliminaryexplorationonthecausesofplasmidsmearproducedbydoubledigestionwithBamHⅠandXhoⅠ
JIN Kehua1,2,ZHANG Huimin3,YANG Zhishen3,JIN Tianying3,LU Xiaoxiao3
(1MedicineResearchInstitute,HubeiUniversityofScienceandTechnology,Xianning437100,China;2BasicMedicineResearchInstitue,BasicMedicalCollege,HubeiUniversityofScienceandTechnology;3BasicMedicalCollege,HubeiUniversityofScienceandTechnology)
ObjectiveTo explore the causes of the smear of plasmids(pET-28a and pET-28a-SDHA), doubly digested byBamHⅠ andXhoⅠ(Takara, Dalian, China)at 37 ℃.MethodsThe effects of plasmid digestion under four conditions on smear were compared. First,BamHⅠ andXhoⅠ codigested plasmids eluted by elution buffer(EB) or water at 37 ℃. Second,NdeⅠ andXhoⅠ codigested plasmids at 37 ℃. Third, plasmids were digested byBamHⅠ at 30 ℃ and followed byXhoⅠ at 37 ℃. Fourth, plasmids were digested byBamHⅠ at 30 ℃ or 37 ℃.ResultsThe serious smear appeared in plasmids after eluted by EB or water, and digested byBamHⅠ andXhoⅠ at 37 ℃. But the smear did not appear in the above-mentioned plamids digested by Nde Ⅰ andXhoⅠ at 37 ℃, or byBamHⅠ at 30 ℃ plusXhoⅠ at 37 ℃. What’s more, the smear did not appear in plasmids digested byBamHⅠ at 30 ℃, but did when digested at 37 ℃.ConclusionThe smear of plasmids doubly digested byBamHⅠ andXhoⅠ at 37 ℃ is caused by the star activity ofBamHⅠ digestion at 37 ℃.
BamHⅠ; double digestion; smear; star activity
湖北科技学院校级科研基金资助项目(KY2014074)
金科华,男,1978-12生,博士,讲师,E-mail:striveapple@126.com
2017-07-08
Q503
A
1007-6611(2017)11-1114-04
10.13753/j.issn.1007-6611.2017.11.006

