门静脉和下腔静脉不同阻断时间对肺动脉高压大鼠血浆和肺组织ET-1、NO、TXB2和HO-1表达的影响
周荣胜,刘庆波,颜 飞,王 强,李小刚,刘齐宁
(西安交通大学第一附属医院麻醉科,西安 710061;*通讯作者,E-mail:lqnhhlqnhh@163.com)
门静脉和下腔静脉不同阻断时间对肺动脉高压大鼠血浆和肺组织ET-1、NO、TXB2和HO-1表达的影响
周荣胜,刘庆波,颜 飞,王 强,李小刚,刘齐宁*
(西安交通大学第一附属医院麻醉科,西安 710061;*通讯作者,E-mail:lqnhhlqnhh@163.com)
目的 探讨门静脉和下腔静脉不同阻断时间对肺动脉高压大鼠血浆和肺组织中ET-1、NO、TXB2和HO-1表达的影响。 方法 80只健康清洁级雄性SD大鼠随机分为实验组和对照组,每组40只。根据门静脉和下腔静脉阻断时间的长短,两组均分为4个亚组:T1(0 min)、T2(15 min)、T3(30 min)、T4(45 min),每组10只。实验组腹腔注射野百合碱60 mg/kg,对照组注射同等剂量的生理盐水;3周后,经右侧颈外静脉插入聚苯乙烯管,测量右心室收缩压(right ventricular systolic pressure,RVSP)、肺动脉平均压(mean pulmonary artery pressure,mPAP)。开腹,解剖暴露,实验组和对照组大鼠门静脉和下腔静脉分别被阻断0,15,30,45 min。开放后取门静脉血、肺动脉血和肺组织,ELISA试剂盒检测血中内皮素-1(ET-1)、一氧化氮(NO)、血栓素B2(TXB2)、血红素氧化酶-1(HO-1)的表达。 结果 与对照组相比较,实验组RVSP和mPAP显著升高(P<0.05),表明肺动脉高压模型建立成功;在肺组织匀浆、肺动脉血、门静脉血中,实验组ET-1、TXB2和HO-1在门静脉和下腔静脉阻断0,15,30,45 min四个时间的表达均高于对照组,而实验组NO的表达均低于对照组,且差异有统计学意义(P<0.05);对照组内4个阻断时间两两比较,差异无统计学意义(P>0.05);实验组门静脉和下腔静脉阻断时间越长,ET-1、TXB2和HO-1的表达越高,NO的表达越低,且差异有统计学意义(P<0.05)。 结论 随着门静脉和下腔静脉阻断时间的增长,ET-1、TXB2的表达增高,NO的表达降低,对肺动脉高压大鼠的危害越大;同时HO-1表达增高,这对肺动脉高压大鼠可能有一定的保护作用。
门静脉-下腔静脉阻断; 肺动脉高压; ET-1; NO; TXB2; HO-1
终末期肝病常可累及肺血管,有研究显示6.3%-8.5%患者合并有肺动脉高压(pulmonary arterial hypertension, PAH),而肺动脉高压是肝移植围手术期间高死亡率的主要原因,防治肺动脉高压是降低肝移植围手术期死亡率的关键[1]。门静脉和下腔静脉阻断是肝移植手术过程中常用的操作,对机体及血流动力学的影响很大,对于本身有肺动脉高压的患者来说影响更大。因此,探讨门静脉和下腔静脉阻断对PAH患者的发展机制并找到处理对策,阻断肺动脉高压的恶性循环,减少并发症的发生,对提高病人的术后生存具有重要的意义。通过文献检索,我们发现有关门静脉和下腔静脉阻断对PAH患者影响的文献很少,大都集中在围术期治疗方面,而对门静脉和下腔静脉阻断时间长短对围术期肺动脉高压的影响却鲜有报道。本实验首先建立大鼠肺动脉高压模型,然后对门静脉和下腔静脉采取不同阻断时间,检测血浆和肺组织中ET-1、NO、TXB2和HO-1的含量变化,探讨不同阻断时间对PAH大鼠ET-1、NO、TXB2和HO-1表达的影响,为PAH患者围手术期的防治提供临床指导作用。
1 材料与方法
1.1 实验动物及主要试剂、仪器
健康清洁级雄性SD大鼠80只,体质量230-280 g,由西安交通大学医学院实验动物中心提供。适应性喂养3-4 d后,进行实验。野百合碱(美国Sigma公司提供);大鼠ET-1 ELISA试剂盒、大鼠NO ELISA试剂盒、大鼠HO-1 ELISA试剂盒和大鼠TXB2ELISA试剂盒均为武汉博士德(Boster)生物工程有限公司提供;DG3090自动酶标洗板机(南京华东电子集团医疗装备有限责任公司)、ELx808吸收光酶标仪(美国伯腾仪器有限公司)、finnpipette移液器(美国Thermo Scientific)等仪器由西安交通大学医学部实验中心提供。
1.2 动物分组和模型制备
80只健康清洁级雄性SD大鼠随机分为实验组和对照组,每组40只。根据门静脉和下腔静脉阻断时间的长短,两组均分为4个亚组:T1(阻断0 min)、T2(阻断15 min)、T3(阻断30 min)、T4(阻断45 min),每组10只。适应性喂养3 d后,实验组腹腔注射野百合碱60 mg/kg,对照组注射同剂量的生理盐水。同等条件下喂养3周,每天记录大鼠的活动情况、进食情况、体质量变化、毛发的光滑度和有无死亡等。3周后,先麻醉,然后进行门静脉和下腔静脉阻断实验,取门静脉血和肺动脉血,放血处死大鼠后,取右肺上叶置于10%中性福尔马林溶液浸泡固定。
1.3 肺动脉平均压、右心室收缩压测定
10%乌拉坦(1 000 mg/kg)大鼠腹腔注射麻醉后,仰卧固定在手术台上。小心分离气管,插入气管导管,用调整好参数的动物呼吸机辅助控制呼吸;分离右侧颈外静脉,将与压力换能器连接并且充满肝素溶液的聚苯乙烯管插入右侧颈外静脉,按顺序通过右心房、右心室、肺动脉,测量右心室收缩压(RVSP)、肺动脉平均压(mPAP)。
1.4 门静脉血、肺动脉血、肺组织匀浆的制备

1.5 肺组织形态学观察(HE染色)
取部分肺组织经过脱蜡,水化,染色,脱水,透明,封片,在光镜下观察肺组织病理形态学变化,采集图像。
1.6 ELISA法检测ET-1、NO、TXB2和HO-1含量
1.7 统计学分析
所有数据以均数±标准差形式表示。采用SPSS17.0软件包进行分析。组间比较采用独立样本t检验。检验水准取α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 肺组织形态学观察
对照组大鼠肺组织呈淡红色,未见出血点、瘀点或瘀斑;实验组可见两肺表面苍白,并可见点状出血灶和瘀斑。光镜下,可见对照组肺组织结构完整,无炎性细胞浸润,血管壁未见增厚;实验组肺组织血管壁增厚,肺间质增厚水肿,有大量炎性细胞浸润,肺泡腔大小不一,且有破裂,可见红色渗出液(见图1)。
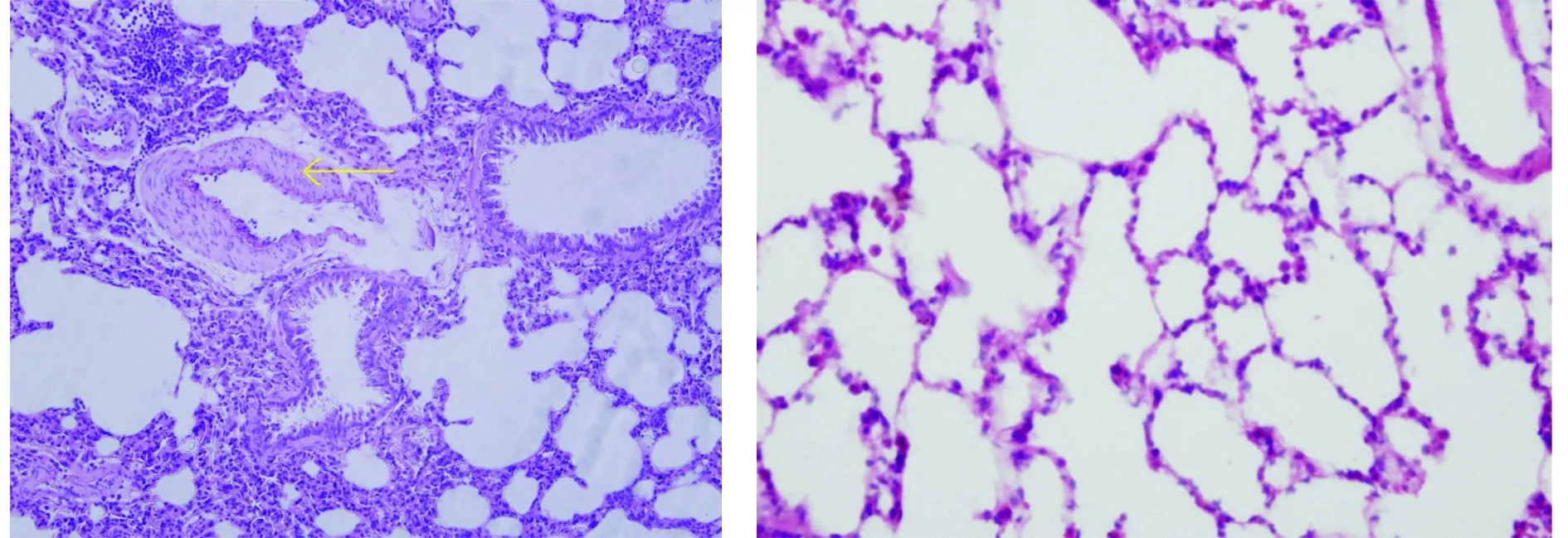
A.实验组 B.对照组图1 肺组织HE染色 (×200)Figure 1 Pathology of lung tissues by HE (×200)
2.2 右心室收缩压及肺动脉平均压的测定
与对照组相比,实验组大鼠的RVSP和mPAP均显著升高(P<0.05,见表1),表明肺动脉高压的模型建立成功。
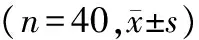

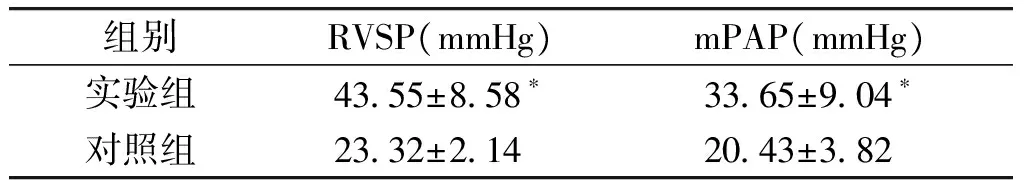
组别RVSP(mmHg)mPAP(mmHg)实验组4355±858∗3365±904∗对照组2332±2142043±382
与对照组比较,*P<0.05
2.3 ET-1的表达水平
在肺组织匀浆、肺动脉血、门静脉血中,实验组ET-1在门静脉和下腔静脉阻断0,15,30,45 min的表达均高于对照组,且差异有统计学意义(P<0.05);组内4个阻断时间两两比较,对照组差异无统计学意义(P>0.05),实验组ET-1的表达水平随阻断时间的增长而增高,且差异有统计学意义(P<0.05,见表2)。
2.4 NO的表达水平
在肺组织匀浆、肺动脉血、门静脉血中,实验组NO在门静脉和下腔静脉阻断0,15,30,45 min四个时间的表达均低于对照组,且差异有统计学意义(P<0.05);组内4个阻断时间两两比较,对照组差异无统计学意义(P>0.05),实验组NO的表达水平随阻断时间的增长而降低,且差异有统计学意义(P<0.05,见表3)。
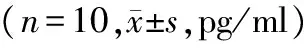

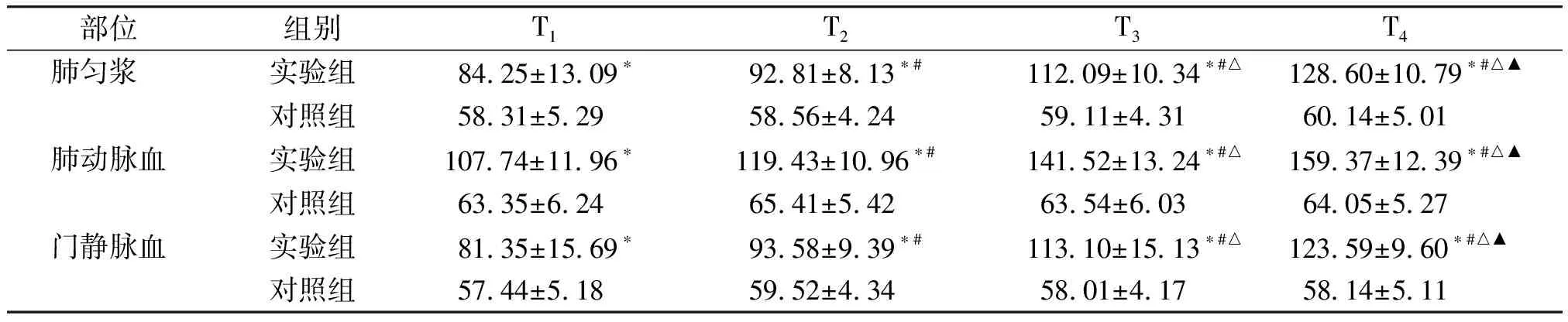
部位组别T1 T2 T3 T4 肺匀浆 实验组 8425±1309∗ 9281±813∗#11209±1034∗#△12860±1079∗#△▲对照组 5831±529 5856±424 5911±431 6014±501肺动脉血实验组10774±1196∗11943±1096∗#14152±1324∗#△15937±1239∗#△▲对照组 6335±624 6541±542 6354±603 6405±527门静脉血实验组 8135±1569∗ 9358±939∗#11310±1513∗#△12359±960∗#△▲对照组 5744±518 5952±434 5801±417 5814±511
与对照组比较,*P<0.05;实验组组内比较:与T1比较,#P<0.05;与T2比较,△P<0.05;与T3比较,▲P<0.05
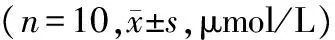


部位组别T1 T2 T3 T4 肺匀浆 实验组 5129±874∗ 4209±975∗# 3675±720∗#△ 3245±499∗#△▲对照组11633±157111743±124411911±143111743±1202肺动脉血实验组 4483±996∗ 3668±794∗# 3113±407∗#△ 2808±463∗#△▲对照组12348±142212543±131212634±138912568±1372门静脉血实验组 4391±807∗ 3453±741∗# 3019±374∗#△ 2579±486∗#△▲对照组11479±112911647±121411379±108911539±1258
与对照组比较,*P<0.05;实验组组内比较:与T1比较,#P<0.05;与T2比较,△P<0.05;与T3比较,▲P<0.05
2.5 TXB2表达水平
在肺组织匀浆、肺动脉血、门静脉血中,实验组TXB2在门静脉和下腔静脉阻断0,15,30,45 min四个时间的表达均高于对照组,且差异有统计学意义(P<0.05);组内4个阻断时间两两比较,对照组差异无统计学意义(P>0.05),实验组TXB2的表达水平随阻断时间的增长而增高,且差异有统计学意义(P<0.05,见表4)。
2.6 HO-1表达水平
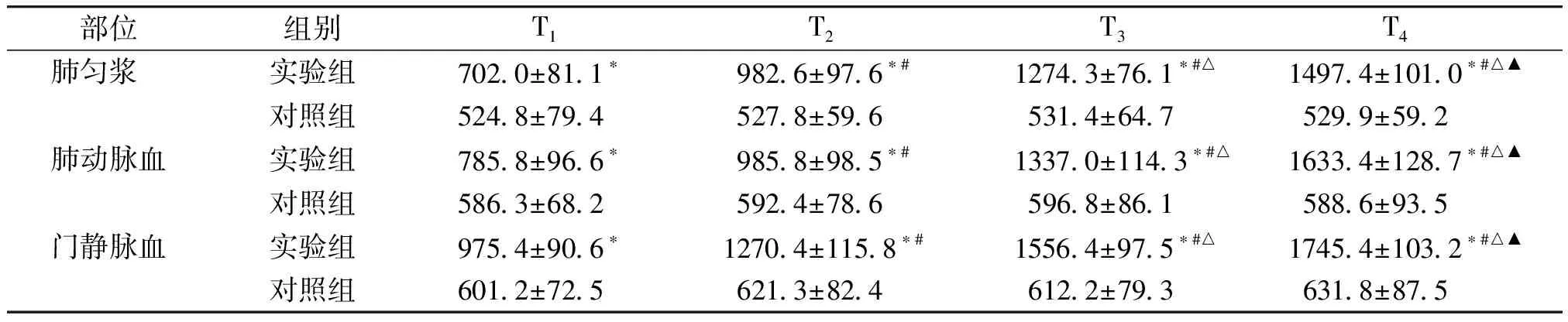
在肺组织匀浆、肺动脉血、门静脉血中,实验组HO-1在门静脉和下腔静脉阻断0,15,30,45 min四个时间的表达均高于对照组,且差异有统计学意义(P<0.05);组内4个阻断时间两两比较,对照组差异无统计学意义(P>0.05),实验组HO-1的表达水平随阻断时间的增长而增高,且差异有统计学意义(P<0.05,见表5)。
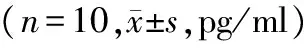

部位组别T1 T2 T3 T4 肺匀浆 实验组7020±811∗ 9826±976∗#12743±761∗#△14974±1010∗#△▲对照组5248±794 5278±596 5314±647 5299±592肺动脉血实验组7858±966∗ 9858±985∗#13370±1143∗#△16334±1287∗#△▲对照组5863±682 5924±786 5968±861 5886±935门静脉血实验组9754±906∗12704±1158∗#15564±975∗#△17454±1032∗#△▲对照组6012±725 6213±824 6122±793 6318±875
与对照组比较,*P<0.05;实验组组内比较:与T1比较,#P<0.05;与T2比较,△P<0.05;与T3比较,▲P<0.05
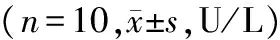

部位组别T1 T2 T3 T4 肺匀浆 实验组3490±353∗3877±234∗#4671±337∗#△5795±339∗#△▲对照组 725±112 732±155 743±201 777±189肺动脉血实验组3969±412∗5001±350∗#5866±463∗#△6849±503∗#△▲对照组 732±087 745±123 801±181 766±162门静脉血实验组3218±459∗3895±398∗#4560±306∗#△5345±282∗#△▲对照组 711±096 719±102 736±123 748±135
与对照组比较,*P<0.05;实验组组内比较:与T1比较,#P<0.05;与T2比较,△P<0.05;与T3比较,▲P<0.05
3 讨论
肺动脉高压(PAH)是各种原因引起的静息状态下右心导管测得的肺动脉平均压≥25 mmHg的一组临床病理生理综合征,由肺血管重塑引起肺循环血流动力学改变,最终可导致右心衰竭,甚至死亡[2]。能引起肺动脉高压的病因很多,其中终末期肝病是引起肺动脉高压的一个重要原因。终末期肝病PAH的出现对肝移植患者危害极大,术前主要表现为呼吸和肺交换功能障碍,PAH是肝移植围术期高死亡率的主要原因之一。由于肝脏血管丰富,在行肝部分切除时,往往需要阻断门静脉甚至下腔静脉来减少术中出血,目前国内外最常用的是Pringle法;而肝移植时则需要采用全肝血流阻断的方法,即同时阻断肝上和肝下腔静脉,但这种方法易引起全身血流动力学不稳定,同时引起内环境的剧烈变化,甚至其他远隔器官如肾、肺等功能受损。有研究显示门静脉和肝后下腔静脉阻断与开放后,肺组织与肺动脉病理性损伤明显加重[3]。目前的研究主要集中在门静脉和下腔静脉阻断对肺组织病理生理、相关细胞因子等的改变,阻断时间长短对肺组织细胞因子表达的影响的研究很少,而阻断时间长短对外科手术具有重要的指导意义。因此,我们的实验首先是建立PAH模型,然后阻断门静脉、肝上和肝下下腔静脉,检测相关指标,观察不同阻断时间对PAH大鼠血浆和肺组织中ET-1、NO、TXB2和HO-1表达的影响。
野百合碱在实验室常用来建立肺动脉高压动物模型,野百合碱诱导的大鼠肺动脉高压的模型,其病理生理及作用特点与临床患者PAH的形成机制类似,到目前为止,是一种比较理想的PAH模型造模选择。通过查阅文献,野百合碱的实验剂量采用60 mg/kg[4]。本实验实验组测得的RVSP[(43.55±8.58)mmHg]和mPAP[(33.65±9.04)mmHg]明显大于25 mmHg,符合PAH诊断,说明我们的模型建立成功。
在肺动脉高压机制的研究中,目前认为血管内皮产生的局部活性介质是产生肺动脉高压的一个重要因素,其中NO和ET-1、TXB2和PGI2是与肺动脉高压关系密切的两个平衡系统[5,6]。ET-1是目前认为活性最强的缩血管活性物质,能够促进肺动脉平滑肌细胞的DNA合成与增殖;其受体有两种亚型,ETA和ETB,前者位于外周小动脉,介导收缩,与细胞增殖有关,后者位于外周血管平滑肌细胞,促进NO和PGI2的释放,介导血管舒张和抑制内皮素转换酶表达[7]。TXB2和PGI2是花生四烯酸内环氧酶代谢途径产生,前者具有强烈的血管收缩作用,后者具有强烈的扩张血管、抑制血小板聚集和抑制平滑肌增殖的作用,正常情况下,两者处于动态平衡[8]。由于肺脏是ET/NO产生的重要地方,也是TXB2和PGI2合成的主要场所,当两大系统失调时,即ET-1和TXB2的合成增多,NO和PGI2的合成减少时,可以导致PAH的形成[9]。因此,对于PAH大鼠NO和ET-1、TXB2和PGI2含量的测定,可以反映PAH的严重程度,作为本实验分析的指标。本实验中,实验组ET-1和TXB2的含量升高,NO含量降低,这与心源性PAH中含量变化一致,再次验证本实验PAH模型成功,可以继续进行下一步实验。实验组门静脉和下腔静脉阻断时间越长,ET-1和TXB2的含量越高,NO含量越低,说明阻断的时间越长,对围术期产生PAH大鼠的影响越大,其后果也越严重。这可以提示我们对于PAH患者手术时,尽量缩短门静脉和下腔静脉的阻断时间,对于术后PAH的治疗和并发症的预防,有很重要的意义。
HO-1是血红素代谢限速酶,分布在多种组织和器官中,如心脏、肝脏、肺脏等部位,在应激状态时表达量会显著增多,具有抗凋亡、抗氧化及抗炎症等活性,同时对细胞内和细胞间的信号传导具有调节作用,细胞受到损伤后参与调节细胞自身稳态的过程[10]。近几年来,国内外学者越来越重视HO-1与PAH发生发展的关系,研究显示HO-1及其代谢产物CO通过调节血管舒张以及抑制血管平滑肌细胞增殖等多种途径参与PAH的形成[11,12]。本实验中,PAH大鼠随着门静脉和下腔静脉阻断时间的延长,肺组织匀浆、肺动脉血和门静脉血产生HO-1的含量是逐渐增多的,这提示我们,HO-1可以在一定程度上保护因阻断时间延长而加重的PAH,这对于PAH患者术后的预防和治疗有一定的指导意义。
综上所述,门静脉和下腔静脉阻断时间越长,PAH大鼠表达的ET-1、TXB2的含量越高,NO的含量越低,说明阻断时间越长,对于PAH大鼠的危害越大;而HO-1也随着阻断时间的延长表达增加,对PAH大鼠可能具有一定保护作用。PAH患者进行门静脉和下腔静脉阻断手术的过程复杂多样,本实验仅仅研究的是门静脉和下腔静脉阻断时间与PAH的关系,还有没有其他因素对PAH产生影响,有待于我们进一步研究。
[1] Porres-Aguilar M, Altamirano JT, Torre-Delgadillo A,etal. Portopulmonary hypertension and hepatopulmonary syndrome:a clinician-oriented overview[J].Eur Respir Rev,2012,21(125):223-233.
[2] Opitz C,Rosenkranz S,Ghofrani HA,etal. ESC guidelines 2015 pulmonary hypertension:diagnosis and treatment[J].Dtsch Med Wochenschr,2016,141(24):1764-1769.
[3] 池信锦,黑子清,金亦,等.门静脉和下腔静脉阻断与开放后门静脉高压犬肺动脉和肺组织超微结构改变[J].中华移植杂志:电子版,2009,3(2):43-47.
[4] Tofovic PS, Zhang X, Petrusevska G.Progesterone inhibits vascular remodeling and attenuates monocrotaline-induced pulmonary hypertension in estrogen-deficient rats[J].Prilozi, 2009,30(1):25-44.
[5] 张欢欢,韩冰,廉银珠,等.不同水平高血压患者血清Klotho蛋白、NO、ET-1的表达水平及相关性[J].中国老年学杂志,2015,35(2):596-599
[6] 李筠,周爱卿.血栓素/前列环素与先天性心脏病肺动脉高压的关系[J].实用儿科临床杂志,2001,16(1):3-4.
[7] Leung JW, Wong WT, Koon HW,etal. Transgenic mice over-expressing ET-1 in the endothelial cells develop systemic hypertension with altered vascular reactivity[J].PLoS One, 2011,6(11):e26994.
[8] Schieffer B, Bünte C, Witte J,etal. Comparative effects of AT1-antagonism and angiotensin-converting enzyme inhibition on markers of inflammation and platelet aggregation in patients with coronary artery disease[J].J Am Coll Cardiol,2004,44(2):362-368.
[9] 李瑞,马奔,李影,等.花生四烯酸细胞色素p450氧化酶基因对肺动脉高压大鼠血浆和组织中ET-1、NO、TXA2和PGI2变化的影响[J].中国分子心脏病学杂志,2012,12(4):242-245.
[10] 王茂爱,岳立辉,赵砚丽.血红素加氧酶-1对器官移植保护作用的研究进展[J].国际麻醉学与复苏杂志,2009,30(6):576-579.
[11] Morita T, Mitsialis SA, Koike H,etal. Carbon monoxide controls the proliferation of hypoxic vascular smooth muscle cells[J]. J Bilo Chem, 1997, 272(52): 32804-32809.
[12] 张玉坤,王导新,朱涛,等.染料木黄酮通过上调血红素氧合酶-1表达减缓野百合碱诱导的大鼠肺动脉高压[J].南方医科大学学报,2012,32(2):151-154.
EffectofdifferentblockingtimeinportalveinandinferiorvenacavaonexpressionofET-1,NO,TXB2andHO-1inplasmaandlungtissueofpulmonaryarterialhypertensionrats
ZHOU Rongsheng, LIU Qingbo, YAN Fei, WANG Qiang, LI Xiaogang, LIU Qining*
(DepartmentofAnesthesiology,FirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China;*Correspondingauthor,E-mail:lqnhhlqnhh@163.com)
ObjectiveTo investigatethe effect of different blocking time in portal vein and inferior vena cava on expression of ET-1,NO,TXB2and HO-1 in plasma and lung tissue of pulmonary arterial hypertension rats.MethodsEighty healthy and clean male SD rats were randomly assigned into experimental group and control group. The two groups were divided into four subgroups according to the blocking time of the portal vein and inferior vena cava: T1(0 min), T2(15 min), T3(30 min),T4(45 min).The rats in experimental group were intraperitoneally injected with monocrotaline 60 mg/kg, while the rats in control group were injected with equal dose of normal saline.The right ventricular systolic pressure(RVSP) and average pulmonary artery pressure(mPAP) were measured using polystyrene tube via the right external carotid vein after treatment for three weeks. After laparotomy and anatomical exposure,the portal vein and inferior vena cava were blocked for 0, 15, 30, 45 min, respectively. Portal venous blood, pulmonary artery blood and lung tissue were taken after vessel opening. The expression of ET-1,NO,TXB2and HO-1 was detected by ELISA.ResultsCompared with control group, RVSP and mPAP were significantly increased in experimental group(P<0.05).The pulmonary hypertension model was established successfully. The expression of ET-1, TXB2and HO-1 in lung tissue homogenate, pulmonary artery and portal vein were significantly higher than those in control group at 0 min, 15 min, 30 min and 45 min after portal vein and inferior vena cava blocking, while the expression of NO in experimental group was lower than that in control group.There was no statistically significant difference in the expression of ET-1, NO, TXB2and HO-1 between four subgroups in control group(P>0.05).In experimental group, as the portal vein and inferior vena cava blocking time increased, the expression of ET-1, TXB2and HO-1 increased(P<0.05), while the expression of NO decreased(P<0.05).ConclusionWith the increase of blocking time in the portal vein and inferior vena cava, the expression of ET-1 and TXB2increases, the expression of NO decreases, and the risk of pulmonary hypertension in rats becomes greater. The expression of HO-1 also increases at the same time, which may have protective effect from pulmonary hypertension rats.
portal vein-inferior vena cava block; pulmonary hypertension; ET-1; NO; TXB2; HO-1
陕西省科技计划项目(2006K14-G2-(9));西安交通大学第一附属医院青年创新基金资助项目(2014YK14);西安交通大学第一附属医院教学改革研究项目(17YB17)
周荣胜,男,1981-04-生,硕士,主治医师,E-mail:zrs972@sina.com
2017-07-10
R544.1
A
1007-6611(2017)11-1124-05
10.13753/j.issn.1007-6611.2017.11.008

