用匀浆法提取鲜姜黄中姜黄素
张 胜,李湘洲,杨艳红,李瑞敏
(中南林业科技大学,湖南 长沙 410004)
用匀浆法提取鲜姜黄中姜黄素
张 胜,李湘洲,杨艳红,李瑞敏
(中南林业科技大学,湖南 长沙 410004)
以鲜姜黄为原料, 对姜黄素的匀浆提取进行了研究,确定采用75%乙醇为溶剂,匀浆3 min,转速8 000 r/min,料液比为1∶9(g/mL)为最佳提取条件。姜黄素的提取率可达63.45%。相对回流提取法,匀浆提取具有操作简便,提取率高的优点。
鲜姜黄;姜黄素;匀浆提取
姜黄素(curcumin)是一种黄色略带酸性的二苯基庚烃物质[1],主要从姜黄科属植物如姜黄Curcuma longaL.的块根里提取。 由于姜黄素具有抗氧化[2]、抗肿瘤[3]、抗艾滋病毒[4]等活性,是近些年来天然产物研究领域的热点化合物之一。
关于姜黄素的提取工艺报道较多,主要可分为溶剂提取法,酶法辅助提取,超声或微波辅助提取,超临界CO2萃取法等[1]。溶剂提取法设备简单、操作方便,为大生产常用方法,常用溶液提取方法包括乙醇水溶液回流提取、碱水加热浸提、表面活性剂水溶液(如水杨酸钠、异丙基苯磺酸钠等)浸提。但姜黄素在光照下和碱液中不稳定[5];超临界萃取法则成本较高[6]。匀浆法是指将适当溶媒加入到新鲜的生物组织中,在匀浆搅拌刀的强力作用下,细胞液中的活性成分迅速溶出到溶媒中的过程。具有成分提取率高,能耗低,提取不加温,提取速度快等优点[7]。 该法过去主要应用于分子生物学试样中的遗传物质的提取。近年来祖元刚等学者将其改进后应用应用于植物活性成分的提取,例如茄尼醇[7],长春碱[8],苦楝素[9],原花青素[10],花色苷[11]等活性成分的提取,但将此法应用于姜黄素的提取还未见文献报道。
1 材料与方法
1.1 试验材料及试剂
鲜姜黄2011年采于广西南宁;经中南林业科技大学喻勋林教授鉴定为姜科植物姜黄的块状根茎。将姜黄表面的附着泥土除去,切成小块混合,以保证样本的均匀性。干姜黄购于长沙益丰药店,粉碎过40目后备用。
姜黄素对照品(批号:110823-201004),购于天津一方科技有限公司,纯度为98.8%;乙腈与甲醇为色谱纯,购于天津大茂试剂有限公司;其它试剂为分析纯。
1.2 主要仪器、设备
JJ-2B型组织捣碎匀浆机(金坛市友联仪器研究所); LC-20A高效液相色谱仪(日本岛津公司)。
1.3 实验方法
1.3.1 姜黄素的测定
高效液相测定方法参考文献[12]: C18反相色谱柱(5 μm,4.6 mm×250 mm); 流动相梯度洗脱程序为:A相:乙腈;B相:0.01 mol·L-1的磷酸二氢钾溶液(用磷酸调整pH至2.5);流动相按表1 程序进行。流速:1.0 mL·min-1;检测波长:425 nm,柱温:30 ℃。精密称定姜黄素对照品适量甲醇溶解后配制成对照品溶液。
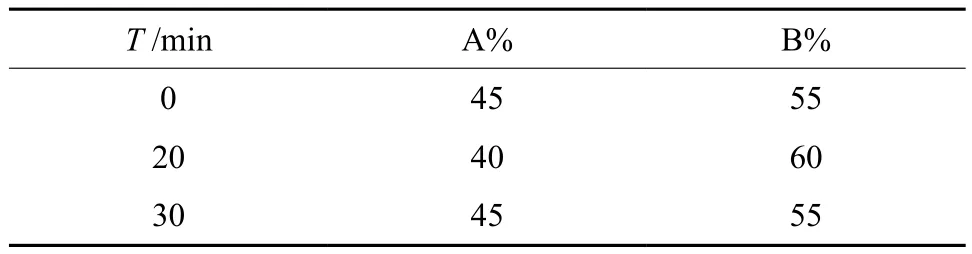
表1 流动相梯度洗脱程序Table 1 Mobile-phase gradient elution process
鲜姜黄中姜黄素的含量测定:精密称取鲜姜黄约10 g,置具塞锥形瓶中加入体积分数为75%乙醇70 mL后回流120 min,放冷,再称定重量,用75%乙醇补足因蒸发减失的重量,摇匀,离心,取上清液进行测定。含量计算公式为:

式(1)中Y为鲜姜黄中姜黄素含量(%);c为上清液中姜黄素的浓度(mg/mL);V为提取液体积(mL);m为鲜姜黄质量(mg)。
匀浆法提取鲜姜黄中姜黄素的提取率:精密称取鲜姜黄约10 g,加定量提取溶剂后匀浆´提取,匀浆液离心,取上清液进行含量测定,并根据鲜姜黄中姜黄素的含量计算提取率。提取率计算公式为:

式(2)中X为姜黄素提取率(%);c为姜黄素的浓度(mg/mL);V为提取液体积(mL);m为鲜姜黄质量(mg);Y为鲜姜黄原料中姜黄素的含量(%)。
1.3.2 乙醇体积分数的选择
称取5份鲜姜黄,按照料液比为1∶7(g/mL),分别加入95%,85%,75%,65%,55%浓度的乙醇水溶液,匀浆提取3 min,保持转速为10 000 r/min。每个实验重复测定3次,取平均值。计算姜黄素的提取率。
1.3.3 匀浆时间对姜黄素提取率的影响
称取5份鲜姜黄,按照料液比为1∶7(g/mL),将75%的乙醇溶液加入鲜姜黄原料中,匀浆转速设置为10 000 r/min,匀浆时间为1,2,3,4和5 min,每个实验重复测定3次,取平均值。计算姜黄素的提取率。
1.3.4 匀浆转数对姜黄素提取率的影响
称取5份鲜姜黄,按照料液比为1∶7(g/mL),将75%的乙醇溶液加入鲜姜黄原料中,匀浆转速设置为14 000 r/min,12 000 r/min,10 000 r/min,8 000 r/min,6 000 r/min,匀浆提取时间为3 min,每个实验重复测定3次,取平均值。计算姜黄素的提取率。
1.3.5 料液比对姜黄素提取率的影响
称取5份鲜姜黄,料液比分别设置为1∶3,1∶ 5,1∶ 7,1∶ 9,1∶ 11(g/mL), 将75%的乙醇溶液加入鲜姜黄原料中,匀浆转速设置10 000 r/min,匀浆提取时间为3 min,每个实验重复测定3次,取平均值。计算姜黄素的提取率。
1.3.6 匀浆提取方法的参数优化
采用正交设计助手软件,设计正交实验,以姜黄素提取率作为考察指标,对料液比、匀浆时间及匀浆转速进行优化 ,从中筛选姜黄素匀浆提取的最优条件。
2 结果与分析
2.1 乙醇体积分数的确定和鲜姜黄中姜黄素的含量
经测定,鲜姜黄中姜黄素含量为0.55%。姜黄素提取率受乙醇浓度的影响如图1 所示。根据图1,可以发现姜黄素的提取率随着乙醇浓度的增加而逐渐增加, 当乙醇浓度高于75%时, 提取率逐渐趋于稳定。考虑到生产过程中节约成本的因素,选择乙醇浓度为75%。

图1 姜黄素提取率与乙醇浓度的关系Fig.1 Relations of ethanol concentration and extraction yield of curcumin
2.2 匀浆时间的影响
由图2可知,在一定的时间内,姜黄素提取率在1~3 min时升高,峰值在3 min时出现,之后开始下降。鲜姜黄块在高速运转的匀浆机绞刀的作用下,迅速破碎,细胞壁破碎后,游离在细胞液中的姜黄素溶出,并迅速向溶媒中扩散。而匀浆时间延长,物料粉碎过细,匀浆液黏度较大,成糊状,反而影响了姜黄素的传质速度。

图2 姜黄素得率-匀浆时间的关系Fig.2 Relations of homogenized extraction time and extraction yield of curcumin
2.3 匀浆转数的影响
由图3可知,姜黄素的提取率在匀浆转速为6 000~10 000 r/min范围内升高,峰值在10 000 r/min时达到峰值,提取率随之下降。原因是提取溶剂随着转速增大而与物料接触几率增加,从而提取率增加;但转速过高时,物料过度粉碎,细胞中的粘液质使匀浆液浓度增大,姜黄素扩散速率降低。
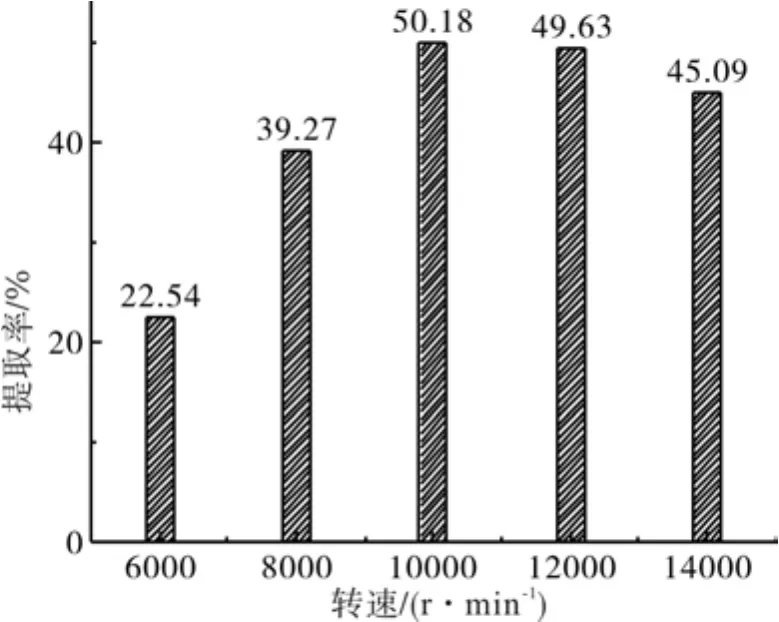
图3 姜黄素得率-匀浆转数的关系Fig.3 Relations of extraction yield of curcumin and homogenate revolution
2.4 料液比的影响
由图4可知,姜黄素的提取率受料液比影响较大。姜黄素的提取率在料液比为1∶9以下时呈逐渐提高的趋势,料液比高于1∶9以后,提取率增加的趋势变缓。结果说明当料液比在一定范围内增加可以促使姜黄素从植物细胞内扩散到溶媒中,但是料液比太大时,反而使姜黄素的绝对浓度降低。

图4 姜黄素得率-料液比的关系Fig.4 Relations of extraction yield of curcumin and ratio of solid to liquid
2.5 提取参数的优化
根据匀浆时间、转速以及料液比单因素对姜黄素提取率的影响,设计正交因素水平表(见表2),并进行实验,实验结果见表3。

表2 正交因素水平表Table 2 Factors and levels of orthogonal test
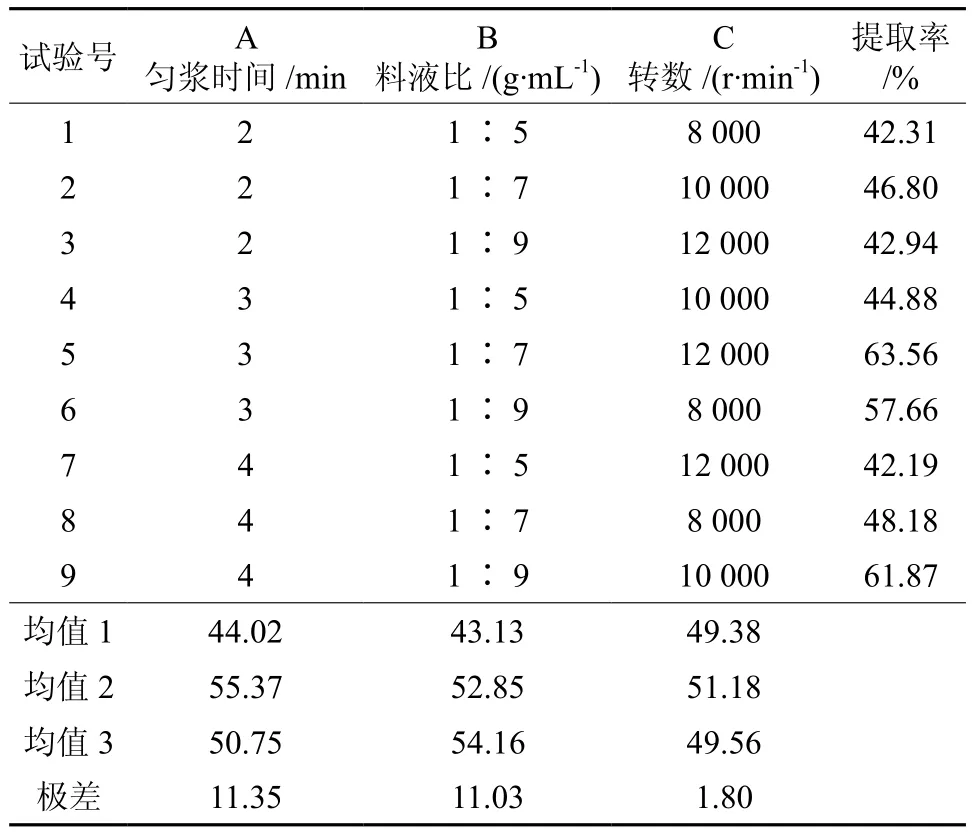
表3 正交实验结果Table 3 Results of orthogonal test

表4 方差分析结果†Table 4 Results of variance analysis
由表2直观分析可知, 在对姜黄素的提取率的影响因素中,匀浆时间影响最显著,料液比其次,匀浆转数影响最小。最佳提取工艺参是匀浆提取时间3 min,料液比1∶9,匀浆转数10 000 r/min。按着最优方案进行3次重复实验,姜黄素的平均提取率为63.45%。根据方差分析结果,发现匀浆时间与料液比对姜黄素提取率具有显著性影响。
2.6 匀浆法提取干姜黄中的姜黄素
按1.3.1项下对干姜黄中的姜黄素含量进行测定。另称取干姜黄粉末3份,各约10 g,2.5所获得的最佳条件下进行匀浆提取,离心提取液,取上清液进行检测,取平均值。 分别按式(1)与式(2)计算姜黄素的含量与提取率。
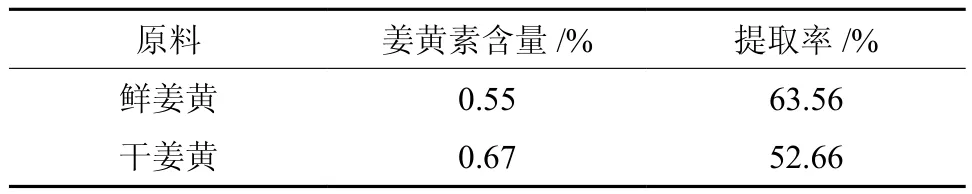
表5 匀浆提取作用下鲜姜黄与干姜黄的比较 n=3Table 5 Comparisons of homogenate extraction yield between fresh and dry Curcuma longa
由表5可知,如果采用匀浆提取法,鲜姜黄中姜黄素的提取率为63.56%,而干姜黄为52.66%,所以,匀浆法更适用于鲜姜黄中姜黄素的提取。
3 讨 论
本研究将匀浆法首次应用到鲜姜黄中姜黄素的的提取, 优化了提取条件为:提取溶剂为体积分数75%的乙醇,匀浆时间为3 min,匀浆转数8 000 r/min,料液比为1∶9(g/m L)。同时发现匀浆提取法的对鲜姜黄中姜黄素的提取率优于干姜黄,原因是鲜姜黄中细胞液丰富,在匀浆过程中姜黄素较易扩散到提取溶媒中。
姜黄素对光照敏感,在姜黄炮制与储存过程中极易降解流失。回流提取耗能大,提取时间长。如能在姜黄产地就近应用匀浆法提取鲜姜黄中的姜黄素,既有效避免了姜黄素的降解,同时节约成本。本研究优选得到的匀浆提取工艺条件,可以推广用于姜黄素的工业提取,同时也对其它植物中有效成分的提取具有参考作用。
[1] 李湘洲, 张炎强, 旷春桃, 等. 姜黄色素的生物活性和提取分离研究进展[J]. 中南林业科技大学学报, 2009,29(3):190-194.
[2] Weber W M, Hunsaker L A, Abcouwer S F,et al.Anti-oxidant activities of curcumin and related enones[J]. Bioorganic &medicinal chemistry, 2005, 13(11):3811-3820.
[3] Ruby A J, Kuttan G, Dinesh Babu K,et al. Anti-tumour and antioxidant activity of natural curcuminoids[J]. Cancer letters,1995, 94(1): 79-83.
[4] Sui Z, Salto R, Li J,et al. Inhibition of the HIV-1 and HIV-2 proteases by curcumin and curcumin boron complexes[J].Bioorganic & medicinal chemistry, 1993, 1(6): 415-422.
[5] 高秀强,刘敏彦,董 超,等.中药姜黄中姜黄素的提取工艺研究[J],2008,17(12):56-57.
[6] 宿树兰,吴启南,欧阳臻,等.超临界CO2萃取测定姜黄中姜黄素的实验研究[J].中国中药杂志, 2004, 29(9): 857-860.
[7] 祖元刚, 赵春建, 李春英, 等. 鲜法匀浆萃取烟叶中茄尼醇的研究[J]. 高校化学工程学报, 2005, 19 (6): 757- 761.
[8] 张 琳, 杨 磊, 贾 佳, 等.匀浆法提取长春花中长春碱、 文多灵和长春质碱[J].高校化学工程学报,2008,29(5):768 -773.
[9] 杨磊,李家磊,祖元刚,等.印楝种子中印楝素A的匀浆提取工艺[J],东北林业大学学报,2008,36(9):65-67.
[10] 贾 佳,杨 磊,祖元刚.落叶松树皮原花青素的匀浆提取及响应面法优化[J],林产化学与工业,2009,23(3):78-84.
[11] 杨 磊,贾 佳,祖元刚. 蓝莓总花色苷匀浆的提取条件优化及抗氧化活性[J],食品科学,2009,30(20):27-32.
[12] 赵 欣, 袁 丹, 王启隆, 等. 姜黄提取物中姜黄素类成分定量分析法研究[J]. 药物分析杂志, 2005, 25(6): 643-647.
Technique of homogenized extraction of curcumin from fresh Curcuma longa
ZHANG Sheng, LI Xiang-zhou, YANG Yan-hong, LI Rui-min
(Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
By taking freshCurcuma longaL. as the row materials, the extraction process of homogenzed extraction of curcumin from freshCurcuma longawas studied. The results show that the optimum technology parameters were found as follows: extraction time 3 min,ethanol concentration 75%,homogenization velocity 10 000 r/min,ratio of material to liquid 1∶ 9; the extraction rate of curcumin was more than 63.45% under the optimized conditions; the method had many advantages such as simplicity of operation,rapidly and high eff i ciency compared with ref l uxing extraction process.
freshCurcuma longaL.; curcumin; homogenized extraction
S759.82
A
1673-923X(2014)10-0123-04
2013-10-11
国家林业公益性行业科研专项资助(20120460103)
张 胜(1975- ),男,河北南宫人,高级工程师,主要从事天然产物化学与利用研究;E-mail:gingshen123@126.com
李湘洲(1965-),女,湖南郴州人,教授,博士研究生导师,主要从事天然产物化学与利用研究;E-mail:rlxz@163.com
[本文编校:文凤鸣]

