超级细菌blaNDM-1和mcr-1基因双重TaqMan荧光定量PCR检测方法的建立
屈素洁,施开创,尹彦文,冯淑萍,陆文俊
(广西壮族自治区动物疫病预防控制中心,南宁530001)
2009年12 月,世界上首次报道在印度发现携带新德里金属β-内酰胺酶1(new delhi metallo-βlactamase-1,NDM-1)、具有超强耐药性的肺炎克雷伯氏菌,除对替加环素和多粘菌素敏感外,对β-内酰胺类、碳青霉烯类、大环内酯类、氨基糖苷类及喹诺酮类的多种抗菌药物均具有耐药性[1]。此后,这种耐药的“超级细菌”陆续在巴尔干半岛各国、美国、加拿大、荷兰、中国等国家被报道,呈世界性分布[2-3]。目前,携带blaNDM-1基因的细菌分布广泛,主要发现于肠杆菌科的大肠杆菌、肺炎克雷伯氏菌、阴沟肠杆菌、沙门氏菌以及莫拉菌科的鲍曼不动杆菌、索氏志贺菌等[3-4]。2016年,我国科学家在世界上首次从来自养殖场的大肠杆菌分离株中发现黏菌素耐药基因mcr-1基因[5],证实其编码的MCR-1蛋白具有磷酸乙醇胺转移酶活性,可催化磷酸乙醇胺与脂多糖表面类脂A结合,介导黏菌素耐药。此后,在丹麦、泰国、尼日利亚、法国、英国、加拿大、美国、德国、突尼斯、日本、越南等国家也有相关报道被相继发表[4,6]。同时携带blaNDM-1基因和mcr-1基因的大肠杆菌、阴沟肠杆菌、无丙二酸枸橼酸杆菌等[7-9],加上blaNDM-1基因和mcr-1基因均可通过质粒在相同和不同菌种间水平和垂直传播[10-11],使得临床致病菌的耐药性和多重耐药性问题日益严重,给临床医学、兽医学及食品安全等带来严峻挑战,加强对携带blaNDM-1基因和mcr-1基因细菌的监测和防控尤为重要。当前,国内外许多学者针对blaNDM-1基因和mcr-1基因检测已研究建立了不少快速检测方法,其中针对blaNDM-1基因主要有普通PCR、TaqMan荧光定量PCR、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、基因芯片技术等[12-15],针对mcr-1基因主要有普通PCR、TaqMan荧光定量PCR、SYBR Green荧光定量PCR、LAMP等[16-19],但迄今未见同时检测blaNDM-1基因和mcr-1基因的快速检测方法的相关报道。本研究以blaNDM-1基因和mcr-1基因为靶基因,分别设计特异性引物和TaqMan探针,通过优化各种反应条件,成功建立了同时检测blaNDM-1基因和mcr-1基因的双重TaqMan荧光定量PCR检测方法,为临床监测blaNDM-1基因和mcr-1基因携带菌提供了有效的技术手段。
1 材料和方法
1.1 标准菌株和分离菌株鸡白痢沙门氏菌(CVCC538)、大肠杆菌(ATCC25922)、多杀性巴氏杆菌(CVCC386)、鼠伤寒沙门氏菌(ATCC14028)标准株均购自国家兽医微生物菌毒种保藏中心;肺炎克雷伯氏菌、变形杆菌、金黄色葡萄球菌、枯草芽孢杆菌标准株由广西大学基础兽医学教研室提供;55株鸡源致病性沙门氏菌分离株由本中心实验室于2014-2017年分离、鉴定和保存[20];10株生鲜畜禽产品源大肠杆菌分离株由广西兽医研究所细菌病研究室提供[21]。
1.2 主要试剂Mini Plasmid Kit质粒提取试剂盒、E.coliDH5α感受态细胞购自天根生化科技(北京)有限公司;MiniBEST Agarose Gel DNA Extraction试剂盒、MiniBEST Viral RNA/DNA Extraction核酸抽提试剂盒、EcoR Ⅰ内切酶、Hind III内切酶、pMD18-T载体、Premix ExTaqTM(Probe qPCR)荧光定量试剂盒均购自宝生物工程(大连)有限公司。
1.3 引物与探针设计根据已发表的blaNDM-1基因(GenBank登录号:FN396876)和mcr-1基因(GenBank登录号:KP347127)序列,针对blaNDM-1~blaNDM-12基因和mcr-1~mcr-8基因的保守区域,采用Primer Express 3.0软件,分别设计特异性引物和TaqMan探针(表1)。引物和探针由宝生物工程(大连)有限公司合成。
1.4 重组质粒标准品构建根据blaNDM-1基因和mcr-1基因保守序列,体外分别合成保守区域126 bp和107 bp的单链DNA片段。以此为模板,分别利用引物对NDM-F/R、mcr-F/R进行扩增,获得blaNDM-1基因126 bp和mcr-1基因107 bp目的片段,PCR回收产物连接至pMD18-T载体,转化DH5α感受态细胞,阳性克隆增菌后提取质粒,进行PCR、酶切和测序鉴定。正确构建的重组质粒分别命名为p-NDM-1和p-mcr-1,作为本研究的阳性标准品。根据Raymond报道的方法[22]计算重组质粒拷贝数,即先用核酸蛋白分析仪测定D260,计算质粒浓度,然后换算成拷贝数。拷贝数=质粒浓度×6.02×1023/(660×质粒总长度)
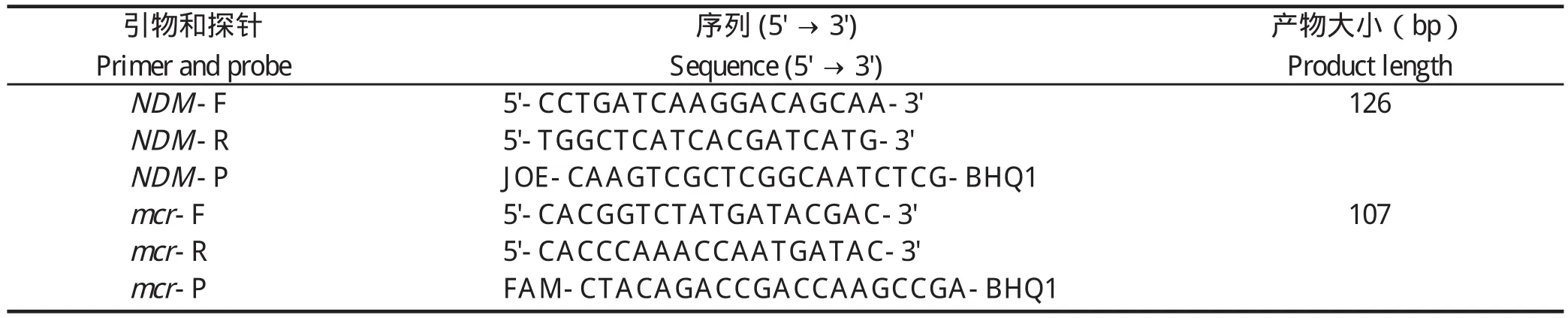
表1 本研究所用引物和探针Table 1 Primers and TaqMan probes used in this study
1.5 反应条件的优化和标准曲线的绘制将2种重组质粒标准品p-NDM-1、p-mcr-1作为模板,应用2对特异性引物和TaqMan探针,在同一反应体系中进行双重TaqMan荧光定量PCR扩增,优化各种反应条件。建立总体积为20 μL的多重反应体系,分别对退火温度(52℃、54℃、56℃、58℃、60℃、62℃)、引物浓度(25 pmol/μL引物0.2 μL、0.4 μL、0.6 μL、0.8 μL、1.0 μL)和探针浓度(25 pmol/μL探针0.1 μL、0.2 μL、0.4 μL、0.6 μL、0.8 μL)进行优化,以获得TaqMan荧光定量PCR的最佳反应条件。将2种重组质粒标准品10倍系列稀释成1.63×102~1.63×108拷贝/μL,作为模板,按照优化的TaqMan荧光定量PCR反应条件进行扩增,绘制扩增曲线及标准曲线。
1.6 特异性试验以从大肠杆菌、鸡白痢沙门氏菌、多杀性巴氏杆菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌、变形杆菌、金黄色葡萄球菌、枯草芽孢杆菌标准株提取的基因组DNA为模板,以制备的质粒标准品为阳性对照、灭菌ddH2O为阴性对照,在优化反应条件下进行荧光定量PCR扩增,验证其特异性。
1.7 敏感性试验将标准品p-NDM-1、p-mcr-1进行1 0倍系列稀释,等比例混合成浓度为1.63×101~1.63×107拷贝/μL。以此为模板,根据已优化的反应条件进行双重荧光定量PCR,分析其敏感性。同时,以引物对NDM-F/R、mcr-F/R进行普通PCR扩增,与所建立的双重荧光定量PCR进行敏感性比较。
1.8 重复性试验将重组质粒标准品p-NDM-1、p-mcr-1进行10倍系列稀释,等比例混合,取3个浓度梯度1.63×103、1.63×104、1.63×105拷贝/μL为模板,进行组内和组间重复性试验。
1.9 临床样品检测将本实验室分离鉴定、保存的55株鸡源致病性沙门氏菌以及广西兽医研究所提供的10株生鲜畜禽产品源大肠杆菌分离株进行复苏、增菌培养,提取总DNA。应用所建立的双重荧光定量PCR,检测blaNDM-1基因和mcr-1基因。
2 结果
2.1 重组质粒标准品的构建分别以合成的单链DNA为模板,利用引物对NDM-F/R、mcr-F/R进行PCR扩增,获得与预期大小一致的126 bp、107 bp目的片段。PCR产物经回收、连接、转化,阳性克隆增菌后提取质粒,经PCR鉴定、酶切鉴定和测序鉴定,证明成功构建了2种重组质粒,分别命名为p-NDM-1、p-mcr-1(图1)。将重组质粒作为阳性标准品,测定质粒浓度,并换算成拷贝数。
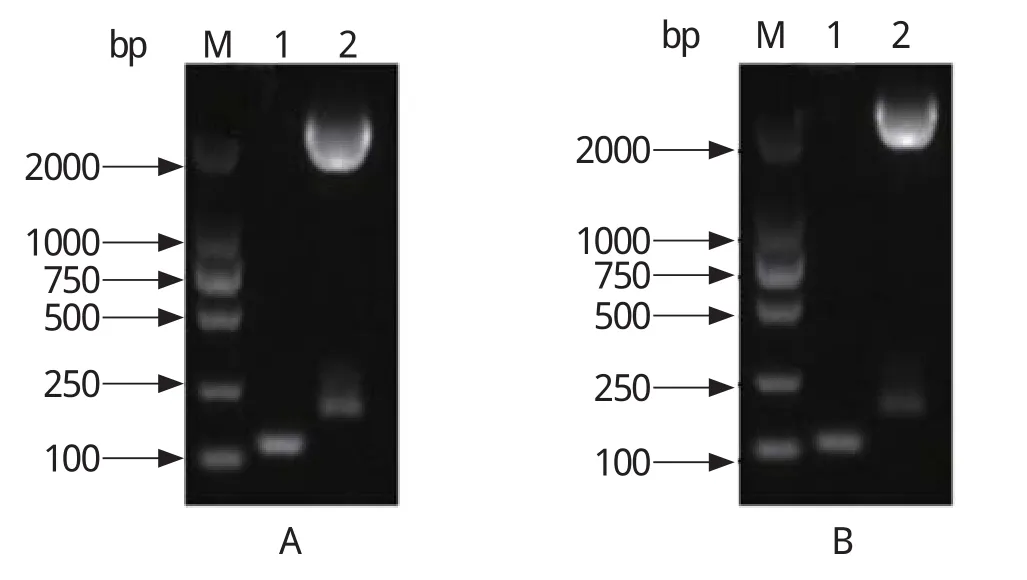
图1 重组质粒p-NDM-1(A)和p-mcr-1(B)的鉴定Fig.1 Identification of the recombinant plasmid p-NDM-1(A) and p-mcr-1 (B)
2.2 双重荧光定量PCR反应条件的优化结果经过对退火温度、引物浓度、探针浓度等条件进行反复试验和优化,获得双重荧光定量PCR最佳反应条件。PCR反应体系(20 μL):Premix ExTaqTM(Perfect real time)10 μL,Rox参比染料(50×)0.2 μL,NDM-F/R和mcr-F/R上、下游引物(25 pmol/μL)各0.6 μL,NDM-P和mcr-P探针(25 pmol/μL)各0.4 μL,模板2.0 μL,灭菌ddH2O 4.4 μL。反应程序:95℃预变性30 s;95℃变性5 s,56℃延伸30 s,40个循环,同时收集荧光信号。
2.3 双重荧光定量PCR 标准曲线的绘制以等比例混合的质粒标准品p-NDM-1、p-mcr-1 10倍系列稀释成1.63×102~1.63×108拷贝/μL为模板,按照优化的双重荧光定量PCR反应条件进行扩增,绘制扩增曲线(图2A)及标准曲线(图2B)。结果,两种质粒起始模板量与Ct值之间存在良好的线性关系,p-NDM-1和p-mcr-1的相关系数R2分别为1和0.99。
2.4 特异性试验以质粒标准品以及大肠杆菌、鸡白痢沙门氏菌、多杀性巴氏杆菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌、变形杆菌、金黄色葡萄球菌、枯草芽孢杆菌总DNA为模板,进行双重荧光定量PCR扩增。结果,质粒标准品p-NDM-1和p-mcr-1出现特异性扩增,而以其他细菌DNA为模板时无扩增曲线,表明所建立的双重荧光定量PCR具有很强的特异性(图3)。
2.5 敏感性试验以浓度为1.63×101~1.63×107拷贝/μL的质粒标准品p-NDM-1、p-mcr-1为模板,进行荧光定量PCR和普通PCR。结果显示,双重荧光定量PCR检出下限均为1.63×101拷贝/μL(图4),普通PCR检出下限均为1.63×103拷贝/μL(图5),双重荧光定量PCR比普通PCR敏感性高100倍。
2.6 重复性试验以等比例混合的浓度为1.63×103、1.63×104、1.63×105拷贝/μL的质粒标准品p-NDM-1、p-mcr-1为模板进行重复性试验。结果显示,组内和组间重复性试验的变异系数为0.58%~1.90%,均小于2%(表2),具有良好的重复性。
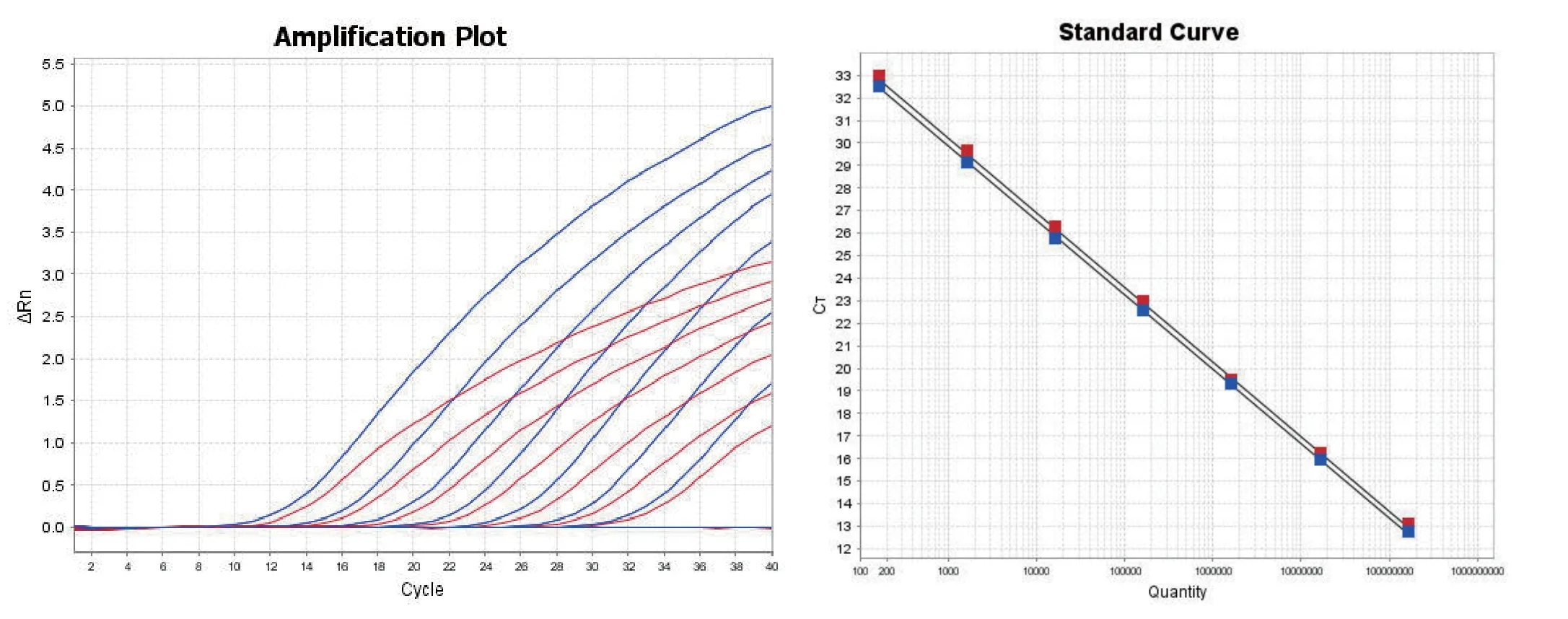
图2 双重荧光定量PCR扩增曲线(A)和标准曲线(B)Fig.2 Dynamic curves (A) and standard curves (B) of the duplex real-time PCR
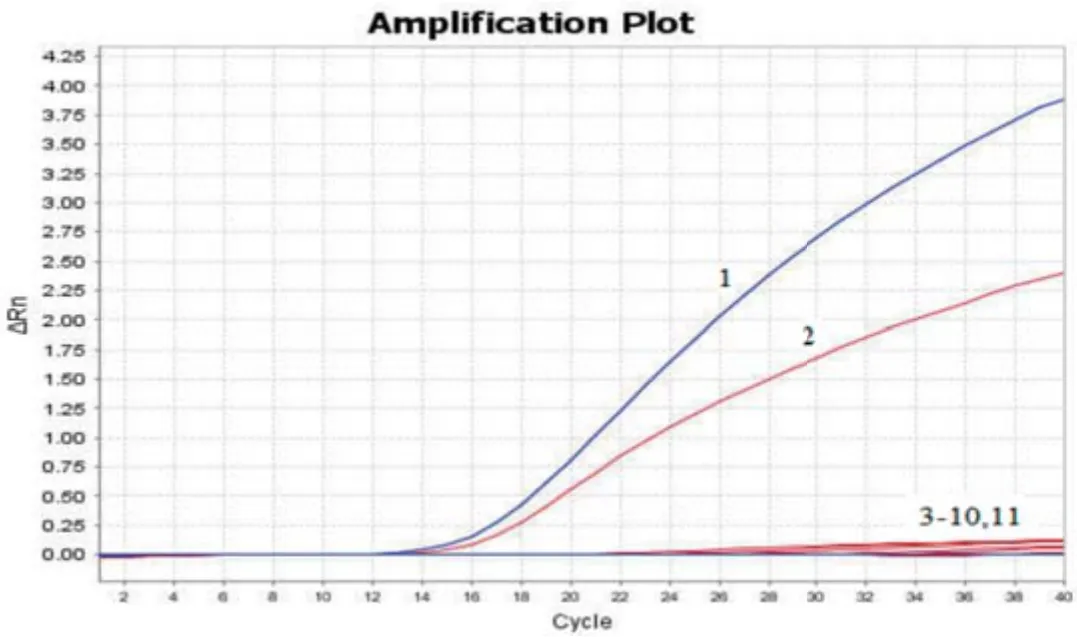
图3 双重荧光定量PCR特异性试验Fig.3 The specificity test of the duplex real-time PCR
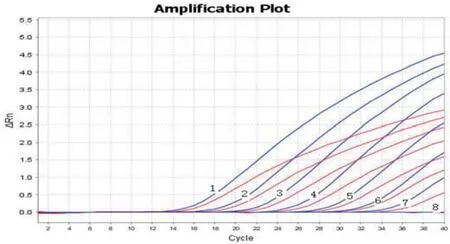
图4 双重荧光定量PCR敏感性试验Fig.4 The sensitivity test of the duplex real-time PCR
2.7 临床样品检测应用本研究建立的双重荧光定量PCR,对55株于2014-2017年采自广西的鸡源致病性沙门氏菌分离株、10株2015-2016年采自广西的生鲜畜禽产品源大肠杆菌分离株进行blaNDM-1基因和mcr-1基因检测。结果显示,在55株沙门氏菌分离株中均未检测到携带blaNDM-1基因和mcr-1基因(图6),在10株大肠杆菌分离株中检测到2株携带blaNDM-1基因、1株携带mcr-1基因(图7),未发现同时携带2种基因的分离株。
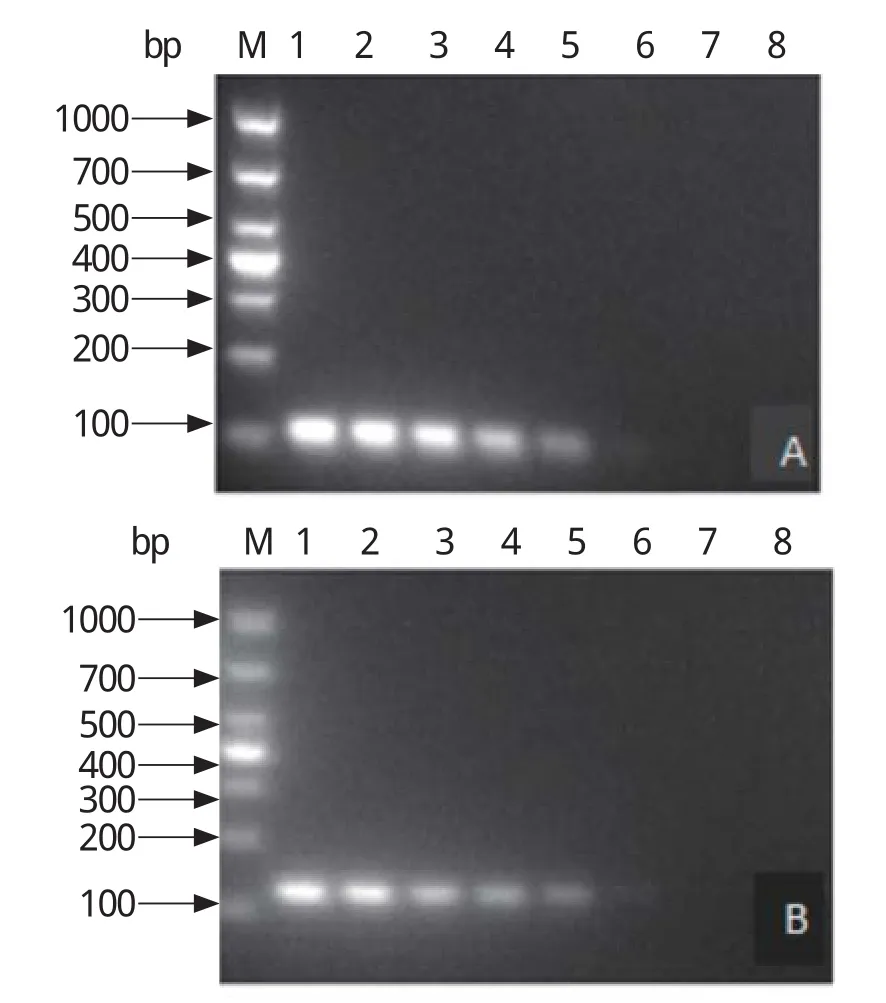
图5 普通PCR敏感性试验Fig.5 The sensitivity test of the conventional PCR
3 讨论
自从发现超级细菌携带blaNDM-1基因和mcr-1基因以来,该现象引起全世界范围内的高度关注。国内外许多学者针对blaNDM-1基因[12-15]、mcr-1基因[16-19]研究建立了普通PCR、TaqMan荧光定量PCR、SYBR Green荧光定量PCR、LAMP等快速检测方法,但上述方法均只针对单个基因进行检测,迄今未见同时检测blaNDM-1基因和mcr-1基因的快速检测方法的相关报道。本研究针对blaNDM-1基因及其变异体(blaNDM-2~blaNDM-12)[23]、mcr-1基因及其变异体(mcr-2~mcr-8)[24]序列的保守区域,设计2对特异性引物和2条TaqMan探针,以构建的含有blaNDM-1基因和mcr-1基因片段的重组质粒作为阳性标准品,通过优化各种反应条件,首次成功建立了同时检测blaNDM-1基因和mcr-1基因的双重荧光定量PCR检测方法。该方法具有操作简便、高通量、敏感性高、特异性强、重复性好等优点,可用于blaNDM-1基因和mcr-1基因的临床监测和检测。
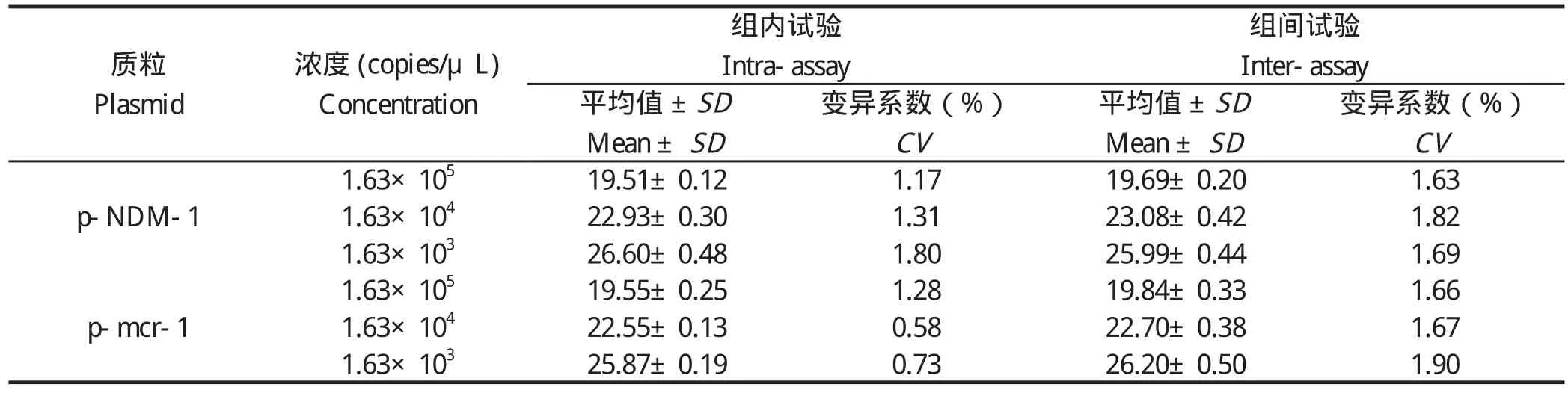
表2 双重荧光定量PCR的重复性分析Table 2 Reproducibility assay of the duplex real-time PCR
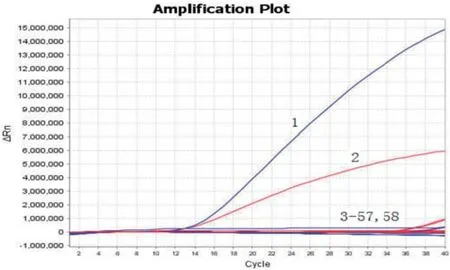
图6 沙门氏菌分离株的检测结果Fig.6 The detection results of Salmonella isolates
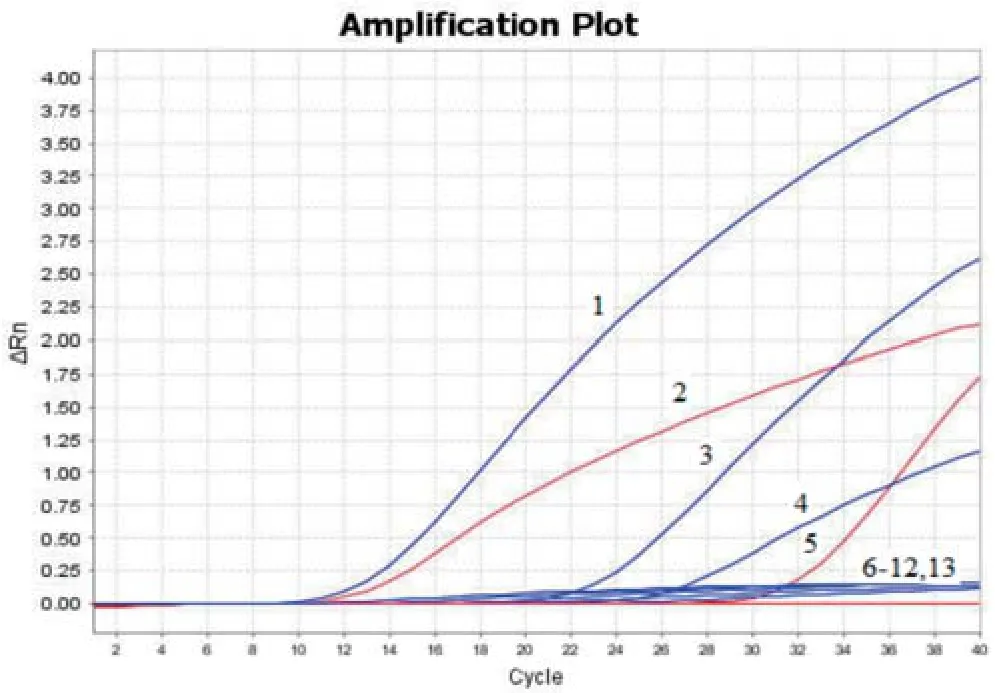
图7 大肠杆菌分离株的检测结果Fig.7 The detection results of Escherichia coli isolates
迄今,发现携带blaNDM-1基因的细菌主要是大肠杆菌、肺炎克雷伯氏菌、鲍曼不动杆菌、沙门氏菌等[3,25],携带mcr-1基因的细菌主要是大肠杆菌、沙门氏菌、肺炎克雷伯氏菌和阪崎肠杆菌等[4,26]。其中,沙门氏菌、大肠杆菌作为主要的人畜共患病原菌,是blaNDM-1基因和mcr-1基因的重要携带者,但不同地域、不同时间的检测阳性率有所差异。在携带blaNDM-1基因方面,2013-2015年,Hu等[27]从中国8个城市分离的1162株人源细菌检测blaNDM-1基因,结果显示45株为阳性(3.9%,45/1162),其中大肠杆菌14株(31.1%,14/45)、肺炎克雷伯氏菌12株(26.7%,12/45)、醋酸钙不动杆菌9株(20.0%,9/45)、肠炎沙门氏菌4株(8.9%,3/45)、阴沟肠杆菌3株(6.7%,3/45)以及鼠伤寒沙门菌、弗氏柠檬酸杆菌、产酸克雷伯氏菌各1株(2.2%,1/45)。鲜少有关于动物源沙门氏菌携带blaNDM-1基因比例情况的报道。在携带mcr-1基因方面,2002-2015年,Campos等[28]对来自葡萄牙的1010株人源、猪源沙门氏菌进行检测,结果显示,分离株均能检测到mcr-1基因,其中人源分离株阳性率为0.8%(4/522)、猪源分离株阳性率为2.4%(7/296)。2012-2015年,Carnevali等[29]对来自意大利的4437株沙门氏菌分离株(人源3294株、动物源1143株)进行mcr-1基因检测,结果显示,人源分离株阳性率为0.3%(10/3294),动物源分离株阳性率为1.3%(15/1143)。2013-2014年,Yi等[30]对我国华南和华中地区屠宰场分离的142株猪源沙门菌进行检测,结果发现mcr-1基因检出率为14.8%(21/142)。张荣民[31]从肉鸡产业链条(种鸡场-商品鸡场-肉鸡屠宰场-超市)中收集鸡、狗、家燕、养殖人员粪便以及污水和苍蝇共739份样本中分离到161株大肠杆菌、55株肺炎克雷伯菌、29株阴沟肠杆菌共245株(33.2%,245/739)碳青霉烯耐药肠杆菌科细菌,均呈blaNDM-1基因阳性,其中37株大肠杆菌同时携带mcr-1基因。2014-2016年,张纯萍等[32]对来自我国12个省的450株鸡源沙门氏菌进行检测,未检测出mcr-1基因阳性的沙门氏菌。本研究中的55株鸡源致病性沙门氏菌,对苯唑西林、阿莫西林、链霉素、磺胺甲恶唑、四环素和呋喃妥因等多种抗菌素多重耐药[20],对多粘菌素E的耐药率为98.18%(54/55),但未发现同时携带blaNDM-1基因和mcr-1基因的分离株,这可能是除了blaNDM-1基因和mcr-1基因,还有其他基因影响细菌对多粘菌素的耐药,此原因有待进一步研究。而本研究中的10株大肠杆菌已对多种抗菌药物具有耐药性(主要集中在12~18重耐药)[21],其中有2株分离株携带blaNDM-1基因、1株分离株携带mcr-1基因,该结果提示我们要高度重视生鲜畜禽产品的细菌耐药问题。同时,要加强监测,必要时应扩大监测面、增加监测量,以切实做好耐药细菌的监测和防范。
总之,本研究成功建立了同时检测blaNDM-1基因和mcr-1基因的双重TaqMan荧光定量PCR方法,为临床监测携带blaNDM-1基因和mcr-1基因的超强耐药菌提供了一种快速、简便、敏感和特异的技术手段。
——一道江苏高考题的奥秘解读和拓展

