基于iTRAQ技术分析柔嫩艾美耳球虫感染后CEF细胞的差异表达蛋白
王 璐,朱顺海,赵其平,黄 兵,韩红玉,刘桂玲,2,李志行,2,赵焕之,董 辉
(1. 中国农业科学院上海兽医研究所 农业农村部动物寄生虫学重点实验室,上海 200241;2. 上海师范大学生命与环境科学学院,上海 200234)
鸡球虫病是由艾美耳属(Eimeriaspp.)球虫引起的一种广泛流行的寄生虫病,每年给养鸡业造成严重的经济损失[1]。目前,控制球虫病的方法主要是使用抗球虫药物或疫苗,但广泛使用抗球虫药已导致鸡体产生严重的耐药性[2],疫苗因成本较高且存在毒力反强等问题而使其使用受限[3]。因此,迫切需要研究新的方法来控制鸡球虫病。柔嫩艾美耳球虫(E. tenella)是7种鸡艾美耳球虫中的一员[4],具有很强的致病力。柔嫩艾美耳球虫属于严格的细胞内专性寄生虫,有着复杂的生活史,必须依靠宿主细胞才能完成其生活周期。阻止虫体入侵细胞和在细胞内的发育是预防和控制球虫病的有效方法。因此,鉴定与虫体入侵相关的关键分子将有助于开发新的抗球虫药物和疫苗。
寄生虫感染细胞是一个复杂的过程,其间宿主细胞会发生一系列的反应以抵抗寄生虫的入侵与发育,同时,虫体也会调控宿主细胞的某些机能活动以创造更利于自身发育和繁殖的条件。已有研究表明,感染镰形艾美耳球虫(E. falciformis)后,小鼠上皮细胞中吲哚胺2,3-双加氧酶1(indoleamine 2,3-dioxygenase1)的表达会显著增加,并且这一现象会在寄生虫感染过程中持续存在,升高的吲哚胺2,3-双加氧酶1对维持寄生虫最佳发育有重要作用[5]。在微小隐孢子虫(Cryptosporidium parvum)的感染过程中,宿主细胞整合素α2(integrin α2)可能作为感染部位F肌动蛋白上游调控元件的一部分,与虫体发生相互作用[6]。以上研究表明,宿主细胞在寄生虫入侵和细胞内发育中起着不可或缺的作用。目前,艾美耳球虫入侵宿主细胞机制的研究主要集中在虫体蛋白上,而与艾美耳球虫相关的宿主蛋白研究鲜有报道。
相对和绝对定量同位素标记(iTRAQ)技术结合液相色谱串联质谱(LC-MS/MS)技术已经成为一种强有力的定量蛋白质组学方法,与传统的蛋白质组学技术相比具有明显的优势,如定量准确、高效率样品分离、高鉴定率、适用范围广等,该技术已成功应用于探索病毒[7]和细菌[8]与宿主相互作用机制的研究。本研究运用iTRAQ联合LC-MS/MS技术,对原代鸡胚成纤维(chicken embryo fibroblast,CEF)细胞在柔嫩艾美耳球虫子孢子入侵72 h后的差异表达蛋白进行了筛选,为深入研究柔嫩艾美耳球虫与宿主之间的互作关系提供了重要的基础数据。
1 材料与方法
1.1 虫株和实验动物柔嫩艾美耳球虫上海株(资源编号:CAAS21111611),由中国农业科学院上海兽医研究所动物原虫病团队保存。三黄鸡购自上海某鸡场,无球虫的条件下饲养,饲料和饮水中不添加任何抗球虫药物。
1.2 试剂和仪器PBS溶液、DMEM、胰蛋白酶、SDT裂解液购自美国Gibco公司;细胞培养瓶购自美国Corning公司;Q-Exactive质谱仪、Easy nLC1000纳升级液相色谱仪购自美国Thermo Finnigan公司;AKTA Purifier 100纯化仪购自GE Healthcare;低温高速离心机、真空离心浓缩仪购自美国Eppendorf公司;可见紫外分光光度计购自尤尼柯公司;600 V电泳仪(GE Healthcare EPS601)购自Manuale公司。
1.3 CEF细胞制备按照Witter等[9]的方法进行CEF细胞的制备,具体步骤为:取10日龄SPF鸡胚3只,去除头、四肢、内脏等部分,取肌肉组织,预冷PBS冲洗3次,充分剪碎至肉糜状,预冷PBS重悬后,3000×g离心10 min,弃上清液,重复此步骤。沉淀用预冷DMEM重悬后,3000×g离心10 min,弃上清液,加入0.25%胰蛋白酶15 mL,37℃消化1 h,期间每20 min震荡混匀1次。消化后100 μm滤膜过滤,滤液中加入完全培养基(DMEM+10%FBS+1%双抗)后,3000×g离心10 min,弃上清液,重复1次,用适量完全培养基吹打混匀细胞沉淀后移入细胞培养瓶中,37℃、5%培养箱内培养。
1.4 柔嫩艾美耳球虫卵囊的收集、纯化及子孢子的提取1日龄三黄鸡在无球虫的条件下饲养至14日龄后,接种柔嫩艾美耳球虫孢子化卵囊,每只接种2.0×104个卵囊。收集接种后6~8 d鸡粪便中的卵囊,通氧至卵囊孢子化率达90%左右时,用饱和食盐水飘浮法和次氯酸钠法对孢子化的卵囊进行纯化。在纯化好的孢子化卵囊沉淀中加入PBS,用玻璃珠震荡破壁至卵囊破壁率达到90%,3000×g离心8 min,用HBBS缓冲液重悬沉淀后,转移至锥形瓶内,向其中加入0.5%的胰蛋白酶和7%的鸡胆汁,吸管轻轻吹打后在41℃水浴锅中消化约1 h,镜检若有大部分子孢子释放出来时,离心、洗涤,用G3砂芯漏斗纯化子孢子。收集滤液,子孢子沉淀用PBS洗涤3次后,计数。
1.5 入侵实验CEF细胞(1.5×106个细胞/瓶)接入T25细胞培养瓶中,加入完全培养基37℃、5%CO2培养至细胞密度80%左右。新鲜子孢子在DMEM(含2%血清、5%双抗)中37℃、5%CO2孵育2 h,3500×g离心10 min,弃上清液,完全培养基重悬后,按子孢子与细胞2∶1比例接入细胞中,37℃、5%CO2培养12 h,更换细胞培养液,以洗去未入侵的子孢子,继续培养60 h。设置不加入子孢子的细胞为对照组。所有试验设置3个重复。
1.6 样品的收集与细胞全蛋白的提取收集子孢子入侵72 h和不入侵的细胞样品,预冷PBS洗3次,加入SDT(4% SDS、1 mmol/L DTT、150 mmol/L Tris-HCl pH8.0、蛋白酶抑制剂)裂解液,匀浆均匀后,进行超声和沸水浴裂解,4℃、15 000×g离心15 min,取上清液,BCA法测定蛋白质浓度后,低温保存。
1.7 酶解、肽段定量和标记各取200 μg样品,加入200 μL UA buffer(8 mol/L尿素,150 mmol/L Tris-HCl pH8.0)混匀后加入超滤离心管,14 000×g离心15 min。再加入200 μL UA buffer 14 000×g离心15 min,弃滤液。加入100 μL IAA(50 mmol/L IAA in UA),600 rpm振荡1 min,避光室温孵育30 min,14 000×g离心10 min。加入100 μL UA buffer,14 000×g离心10 min,重复2次。加入100 μL Dissolution buffer,14 000×g离心10 min,重复2次。加入40 μL Trypsin buffer(2 μg Trypsin in 40 μL Dissolution buffer),600×g振荡1 min,37℃孵育16 h进行酶解。14 000 ×g离心10 min,取滤液,D280肽段定量[10]。各组样品肽段分别取80 μg,按照AB SCIEX公司iTRAQ Reagent-8plex Multiplex试剂盒说明书进行标记。标记分组如下:实验1-113、实验2-114、实验3-115、对照1-116、对照2-117、对照3-118。
1.8 SCX分级使用AKTA Purifier 100(GE Healthcare)和层析柱Polysulfoethyl 4.6×100 mm column(5 μm、200Å)(PolyLCInc, Maryland,U.S.A)对样品进行分级处理。将标记后的所有肽段混合,进行SCX预分级。SCX分级后,收集洗脱36份fraction,根据SCX色谱图合并成15份,冻干后C18 Cartridge(Sigma)脱盐。
1.9 质谱分析每份样品采用纳升流速HPLC液相系统Easy nLC进行分离。色谱柱用95%的A液(0.1%甲酸水溶液)平衡后,样品加至上样柱Thermo scientific EASY column(2 cm×100 μm 5μm-C18),再经分析柱Thermo scientific EASY column(75 μm×100 mm 3 μm-C18)分离,流速为300 nL/min。相关液相梯度如下:0 min~50 min,B液(0.1%甲酸,84%乙腈水溶液)线性梯度从0%到40%;50 min~58 min,B液线性梯度从40%到100%;58 min~60 min,B液维持在100%。
经毛细管高效液相色谱分离后的样品用Q-Exactive质谱仪(Thermo Finnigan)进行质谱分析。分析时长:60 min;检测方式:正离子;母离子扫描范围:300-1800 m/z;一级质谱分辨率:70 000 at m/z 200;AGC target:3e6,一级Maximum IT:10 ms;Number of scan ranges :1,Dynamic exclusion:40.0 s。多肽和多肽的碎片的质量电荷比采集方法:每次全扫描后采集10个碎片图谱(MS2 scan);MS2 Activation Type:HCD;Isolation window:2 m/z;二级质谱分辨率:17 500 at m/z 200;Microscans:1;二级Maximum IT:60 ms;Normalized collision energy:30 eV;Underfill ratio:0.1%。
1.10 数据分析用软件Mascot2.2和Proteome Discoverer1.4(thermo)进行查库鉴定及定量分析。使用数据库:uniprot_gallus_gallus_36088_20170518.fasta(蛋白质序列:36 088条;下载日期:20170518)。
1.11 生物信息学分析根据蛋白质的丰度水平,实验组与对照组差异倍数>1.3 or <0.77,且p<0.05[11-12]时,认定为差异蛋白,结合Gene ontologv(http://www.geneontologv.org/)、KEGG、STRING、uniprot(http://www.uniprot.org/)数据库对差异蛋白进行GO注释及代谢通路分析。运用显著性差异检验方法,用COG数据库对差异蛋白质富集的GO条目以及显著性富集的Pathway进行比对,对这些蛋白质功能进行分析。
1.12 qPCR验证差异表达蛋白收集子孢子感染72 h和未感染的细胞样品,用Trizol试剂按说明书提取细胞总RNA。使用DNaseI去除总RNA中基因组DNA,参照RNeasy® Mini Kit说明书对总RNA进行纯化,用SuperScript Ⅲ反转录酶试剂盒进行第一链cDNA的合成,用QIA quick® PCR试剂盒纯化cDNA。本次试验
以β-actin作为内参,共检测10个基因,引物信息见表1。按照TaKaRa荧光定量试剂盒说明书进行试验操作,反应体系:cDNA(1 μL)、SYBRR Premix Dimer Eraser(2×)(10 μL)、ROX Reference DyeⅡ(1μL)、无RNase水(7.2 μL)和10 mmol/L正向和反向引物(各0.4 μL)。用Q5荧光定量PCR仪进行扩增,第一阶段:预变性,1个循环,95℃30 s;第二阶段:40个循环,95℃ 5 s,60℃ 30 s;第三阶段:溶解曲线。每个样本设置3个重复,按照公式:ΔΔCt=(Ct目的RNA-Ct内参)处理组-(Ct目的基因-Ct内参)对照组)对目的基因mRNA的Ct值作转换,表示试验组表达量于对照组的倍数改变。用SPASS 21.0对其进行比较,P值为0.05。
1.13 Western blot验证差异表达蛋白子孢子感染72 h和未感染的细胞,预冷PBS洗涤3次,然后加入细胞裂解液和蛋白酶抑制剂,冰上裂解30 min,最后收集细胞裂解液,4℃、12 000×g15 min,收集上清液即蛋白。BCA法检测细胞总蛋白浓度,以β-actin为参照调整蛋白样品上样量。蛋白样品经SDS-PAGE后电转至PVDF膜上,用5%脱脂乳(PBS稀释)4℃封闭12 h,PBST洗涤3次,加入兔FABP4抗体(1∶200稀释,本实验室制备),37℃孵育2 h,经洗涤加入荧光二抗(1∶5000),孵育1 h后,PBST洗涤4次,再经PBS洗涤1次后,用Odyssey双色红外激光成像系统成像,Image J软件对图片进行分析。

表1 荧光定量PCR的特异性引物序列Table 1 Sequences of gene-specific primers for qPCR assays
2.结果
2.1 差异蛋白的鉴定通过对原始数据的分析和统计,共定量到23 614个唯一肽段和3 967个蛋白质。将感染组和对照组进行比较,差异倍数≥1.3或≤0.7且P<0.05视为有差异[13],共鉴定到259个差异蛋白,其中上调蛋白145个,下调蛋白114个。下调最为明显的5个差异蛋白包括脂肪酸结合蛋白4(FABP4)、Staufen双链RNA结合蛋白2(STAU2)、DNA拓扑异构酶(TOP3A)、组蛋白1(H1)、起始识别复合物亚基5(ORC5);上调最为明显的5个蛋白包括甘油醛-3-磷酸脱氢酶(GAPDH)、DEAD box解旋酶20(DDX20)、Wnt家族复合物2B(WNT2B)和2个未知蛋白,详见表2。这表明虫体的入侵和发育会引起CEF细胞发生一系列蛋白质组的变化从而应对虫体的感染。
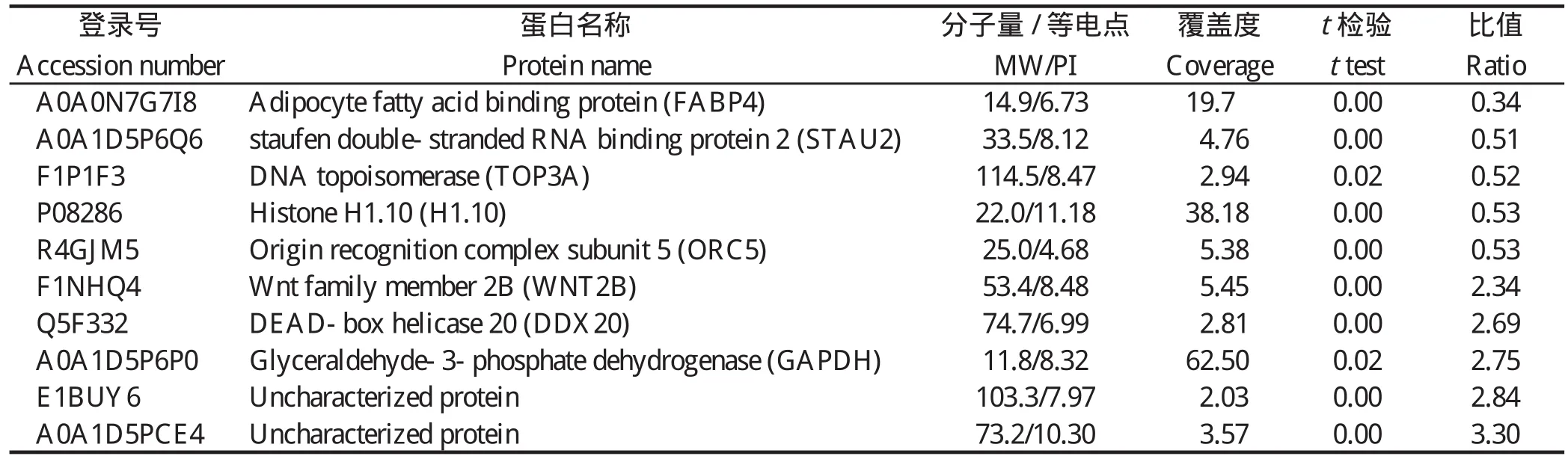
表2 前5个下调和上调差异表达蛋白Table 2 The top five down-regulate and up-regulate differentially expressed proteins
2.2 生物信息学分析GO分析结果显示,在生物学过程(biological process)方面,差异蛋白主要富集在细胞内过程(cellular process)15%、单一生物过程(single-organism process)13%、代谢过程(metabolic process)12%、生物调节(biological regulation)10%等(图1A),说明虫体感染会使宿主细胞发生一系列的生物过程。在细胞内组分(cellular component)方面,差异蛋白主要富集在细胞(cell)18%、细胞部分(cell part)17%、细胞器(organelle)16%、细胞器部分(organelle part)8%、膜(membrane)8%等(图1B)。在分子功能(molecular function)方面,差异蛋白主要富集在结合(binding)52%、催化活性(catalytic activity)29%、转运子活性(transporter activity)4%等(图1C)。
KEGG通路分析表明,差异蛋白富集到的通路主要有细胞外基质受体互作(E M C-receptor interaction)、糖酵解/糖异生(glycolysis/gluconeogensis)、粘着斑(focal adhesion)、氨基酸的生物合成(biosynthesis of amino acids)、半胱氨酸和蛋氨酸代谢(cysteine and methionine metabolism)等(图2)。
2.3 qPCR验证差异蛋白使用qPCR的方法检测了10个差异基因的mRNA水平变化。结果显示:ALDH1A2、MAP1B、MMP2、RPS27A、CNBP、MAEA、CD164、GAPDH等8个基因的mRNA水平变化与iTRAQ结果中蛋白水平变化相一致,而FABP4和TOP3A 2个基因的mRNA水平变化与iTRAQ结果中蛋白水平变化不一致。
2.4 Western blot验证差异蛋白用Western blot方法对差异蛋白FABP4在蛋白水平进行了验证。结果显示:与未感染组相比,子孢子感染72 h组细胞FABP4的表达量显著降低(图3),与iTRAQ的结果保持一致。
3 讨论

图1 柔嫩艾美耳球虫感染CEF细胞后259个差异表达蛋白的GO分析Fig.1 Gene ontology analysis of 259 proteins differentially expressed in CEF cells infected with Eimeria tenella
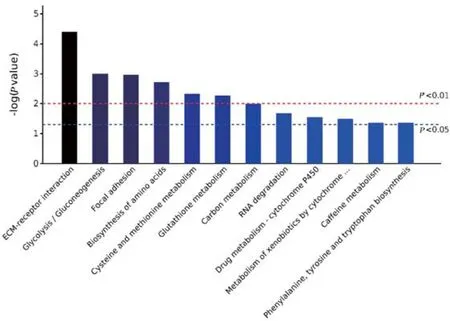
图2 富集的前10个KEGG通路Fig.2 Top 10 enriched KEGG processes
越来越多的证据表明,宿主细胞提供了球虫子孢子与宿主细胞识别和相互作用的前提条件[14],所以研究子孢子感染后的宿主差异表达蛋白对探究艾美耳球虫的感染机制有重大意义。本研究利用iTRAQ技术对柔嫩艾美耳球虫子孢子感染72 h的CEF细胞和未感染的CEF细胞之间的差异蛋白进行了筛选。选取CEF细胞作为宿主细胞,CEF细胞为鸡胚原代成纤维细胞,原代细胞比其它传代细胞更加适于虫体的入侵和发育,并且该细胞来源于鸡更贴近体内真实感染情况。我们共获得了259个差异蛋白,其中上调蛋白145个,下调蛋白114个。利用qPCR检测了10个差异蛋白在球虫感染后细胞的mRNA水平变化,以验证iTRAQ结果的准确性,发现8个基因的结果与iTRAQ的一致,而FABP4和TOP3A的结果不一致。利用Western blot对FABP4在球虫感染细胞中的蛋白水平变化,结果与iTRAQ的保持一致。验证的结果表明大多数差异表达蛋白的调控是在转录水平上直接进行的,但也有少量蛋白的表达水平与其基因转录水平不匹配,原因在于蛋白的丰度不仅取决于转录水平,还取决于翻译后修饰[15]。为了分析差异蛋白在球虫感染中的作用,将它们分为刺激和防御(stress and defense)、免疫反应(immune response)、代谢(metabolism)和凋亡(apoptosis)4个方面进行讨论。
当受到寄生虫感染时,宿主细胞的皮肤或粘膜屏障、天然免疫系统、抗寄生虫特异性免疫机制等会发生相应的变化以抵抗虫体的入侵。例如,肠上皮细胞会产生许多抗微生物多肽作为天然免疫的一部分以抵抗隐孢子虫的感染[16]。恶性疟原虫可诱导人外周血单核细胞IFN-β mRNA和蛋白的高表达[17]。本研究筛选出了一些与宿主应激和防御相关的差异蛋白,其中干扰素调节因子3(IRF3)在子孢子感染后明显上调(感染组/未感染组比值1.40),IRF3主要负责干扰素-β(IFN-β)的诱导,对干扰素反应的激活有着重要作用[18],其在天然免疫和适应性免疫的作用是当前研究的热点[19]。因此我们推测这些与刺激和防御相关的差异蛋白在宿主抵抗艾美耳球虫感染方面发挥重要作用。
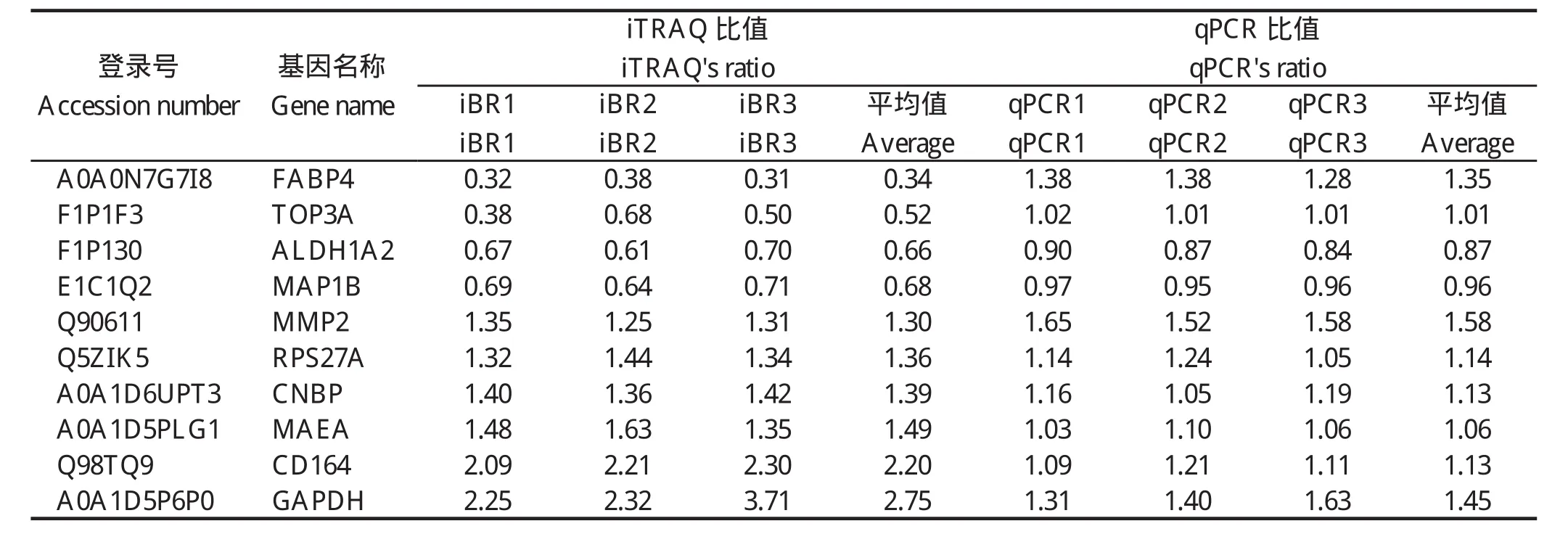
表3 差异表达蛋白的qRT-PCR验证Table 3 Verification of differently expressed proteins by qRT-PCR
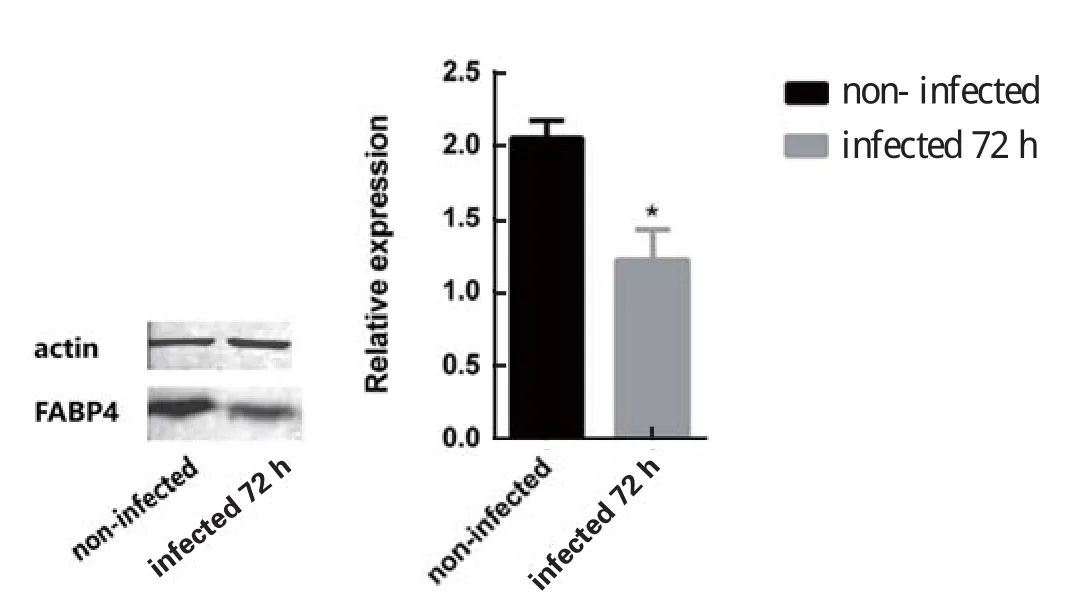
图3 差异表达蛋白的Western blot验证Fig.3 Verification of differently expressed proteins by Western blot
宿主感染寄生虫后可通过不同的免疫机制调节机体免疫保护以清除虫体。例如,隐孢子虫感染宿主细胞时,宿主细胞会产生趋化因子来清除并杀死隐孢子虫[20]。同时,寄生虫也拥有强大而多变的免疫扭转策略,能够逃避宿主免疫攻击,造成宿主持续性感染[21]。Mangan等[22]研究发现,曼氏血吸虫感染后可诱导IL-10 B细胞增加,保护小鼠抵抗实验诱导的系统性过敏反应。本研究发现,子孢子感染后自噬相关蛋白5(ATG5)呈明显下调表达(感染组/未感染组比值0.66),ATG5在自噬泡的形成过程中起重要作用[23],并具有促凋亡活性[24],这与本研究发现子孢子感染后Caspase-3呈下调表达结果一致。在原代巨噬细胞中,干扰素(IFN-γ)/LPS破坏刚地弓形虫寄生液泡膜和寄生虫清除时需要ATG5的参与[25]。我们推测,在球虫子孢子感染宿主细胞后,虫体会抑制宿主细胞ATG5产生,以防止被宿主清除。
顶复门原虫需要从宿主细胞内获取营养物质来维持自身的发育和增殖[26]。本试验所鉴定出的与代谢相关的通路主要有脂质代谢通路、氨基酸合成通路、核苷酸合成代谢等,其中brahma相关基因1(Brg1)在子孢子感染后表达量增高(感染组/未感染组比值1.30)。Brg1是依赖ATP的染色质改变复合物的核心催化亚基[27],可以募集其他亚基并组成相应的重塑复合物、识别目的基因序列进而发挥染色质重塑[28],从而达到调节基因转录功能。据报道,Brg1可以通过参与调控RUNX2的表达,调控成骨分化过程的进行[29],也参与了细胞衰老、转录调控、细胞分化等多种生物学过程。Brg1的上调可能是由于虫体入侵后,引起宿主发生了一系列基因的表达的变化而引起的。
顶复门原虫如隐孢子虫[30]、泰勒虫[31]、弓形虫[32]、艾美球虫[33]均能够介导宿主细胞凋亡从而调控寄生虫在宿主内的发育。有研究表明,柔嫩艾美耳球虫可诱导NF-kappa B激活,以保护宿主细胞不受凋亡的影响使其有良好的发育环境,在裂殖体成熟后,引起NF-kappa B抑制,触发宿主细胞凋亡,从而促进裂殖子的逸出[32]。我们发现在子孢子感染后,Caspase-3的下调表达(感染组/未感染组比值0.66),可能是虫体通过抑制其表达,从而抑制宿主细胞的凋亡,以促进其在宿主细胞内的存活和发育。
本研究采用了iTRAQ联合LC-MS/MS技术来分析E. tenella感染和未感染的CEF细胞之间的差异蛋白质表达变化,共鉴定到259个差异蛋白,其中上调蛋白145个,下调蛋白114个,这些差异表达蛋白主要参与了细胞外基质受体互作、糖酵解/糖异生、粘着斑、氨基酸的生物合成、半胱氨酸和蛋氨酸代谢等生物学功能,具有结合活性、催化活性、转运子活性等分子功能。本实验的研究结果为探索寄生虫与宿主相互作用的机制提供了一个新的视角。

