1株3型禽腺病毒的分离鉴定
牛登云,徐兆强,陈 卓,马利芳,段宝敏,张小敏,冯敬敬
(天津渤海农牧产业联合研究院有限公司,天津 300308)
I群禽腺病毒属于禽腺病毒科禽腺病毒属,为双链DNA病毒,无囊膜,直径为70~90 nm,呈20面体对称结构。六邻体(Hexon)是主要的结构蛋白,含有型、群和亚群的特异性抗原决定簇[1]。Hexon蛋白由Hexon基因编码,ORF全长2829 bp,编码943个氨基酸,其抗原性强、暴露性好、具有群特异性[2]。
I群禽腺病毒除引起鸡包涵体肝炎、心包积水综合征外还会引起产蛋下降和肌胃糜烂等症状。垂直传播是该病的主要传播方式,水平传播也很重要。I群禽腺病毒共12个血清型,且含有相同的群抗原[3]。FAdV-4可引起心包积水综合征,FAdV-8b型可引起包涵体肝炎,其他血清型没有较为明显的临床症状[4]。实验室分离该病主要接种鸡肝癌细胞(chicken liver cancer cell,LMH)、鸡胚肾细胞(chicken embryo kidney cells,CEK),而对鸡胚成纤维细胞[1]和气管培养物不敏感[5]。通过接种鸡胚绒毛尿囊膜可以分离该病毒,但Cowen通过实验表明卵黄囊接种是一种分离该病毒的敏感途径[6]。
禽腺病毒广泛存在于鸡群中,特点就是感染率高、病原复杂,常与一些能导致禽类呼吸道疾病相关的病原微生物混合感染或者在免疫抑制时发生疾病,从而造成严重的损失,现在该病在所有养禽的国家基本上均有发生,对于该病的防控已经成为国际禽病研究中的热点问题。2015-2016年,作者在全国范围内对I群禽腺病毒的进行了分子流行病学调查,发现腺病毒的流行毒株以FAdV-4型为主且呈现由点到面的暴发趋势,零星出现FAdV-8b型,没有其他血清型的出现,且不同时间和地域分离到的FAdV-4型流行毒株其Hexon同源性均在98%以上,FAdV-8b型毒株也是如此;2017-2018年主要以基因型D型为主,其中包括FAdV-2、FAdV-3、FAdV-9和FAdV-11,但仍然以FAdV-4型为主[7]。
2017-2018 年共收集到220余份FAdV阳性样品,覆盖全国范围内各省份和地区的肉鸡、蛋鸡和水禽,且全部进行了病毒分离和鉴定,结果显示,分离的毒株主要以FAdV-4和FAdV-11为主,还有FAdV-1和FAdV-8毒株,1株FAdV-3。迄今为止,关于FAdV-3型禽腺病毒的相关文献相对较少,该病毒的致病特性、适应性、所引起的临床症状等研究较少,所以本研究选择对该病毒进行分离鉴定,以期为其相关性研究和后续产品的研发提供理论依据。
1 材料和方法
1.1 细胞、菌株和载体LMH细胞由本公司研发中心赠送,宿主菌E.coliDH5α和载体pMD18-T购自宝生物工程(大连)有限公司。
1.2 临床样本临床样本为2018年进行FAdV流行病学调查中经PCR鉴定为FAdV核酸阳性的肝脏样本。
1.3 病毒分离培养样本处理按照如下方法进行,采集肝脏剪碎与无菌PBS等体积融合后研磨,收集研磨液于离心管中,10 000×g离心5 min,取上清液通过0.22μm滤膜过滤,所得样本即为待分离样本。将LMH细胞复苏,采用10%胎牛血清DMEM-F12生长液,传代至稳定生长。待细胞长至75%~90%时,弃掉生长液,按培养液体积的1/10接种待分离样本,置于37℃、CO2培养箱吸附2 h后,弃掉液体,立即加入2%胎牛血清的DMEM-F12维持液继续培养2~5 d,每天观察细胞生长和病变(cytopathic effect,CPE)情况,若无CPE出现,则培养至第5 d后将细胞冻融3次后继续传代,传至3代仍无细胞病变则视为病毒样本阴性,若出现CPE则连续传3代,3代均有CPE的则视为有病毒,冻融3次后收获病毒,置-80℃条件下保存待鉴定。
1.4 细胞培养物的PCR鉴定将出现CPE的细胞培养物采用PCR进行初步鉴定,采用全式金病毒病毒DNA提取试剂盒进行DNA提取,方法按照说明书进行。PCR鉴定过程参照文献方法对Hexon基因进行扩增[8],且自行设计了针对FAdV-I群禽病毒通用引物,上游引物-F:5'-TGGACATGGGGGCGAC CTA-3',下游引物-R:5'-TTGCCTGTGGCGAAAG GCG-3',扩增产物大小为2500 bp。同时使用未接毒LMH细胞作为阴性对照。
1.5 Hexon基因的扩增和测序利用Hexon基因扩增引物对收获的细胞培养物进行Hexon基因片段的PCR扩增。反应体系为50 μL,其中dNTP 4 μL,10×PCR Buffer 5 μL,上、下游引物各2.5 μL,Ex-TaqDNA聚合酶0.5 μL,DNA 5 μL。PCR反应条件为:94℃预变性5 min;94℃变性1 min;67℃退火1 min;72℃延伸3 min,34个循环;72℃延伸10 min。将PCR产物经1%琼脂糖凝胶电泳进行检测,将阳性PCR产物胶回收后连接pMD18-T克隆载体,转化E.coliDH5α感受态细胞。挑取单克隆菌落,37℃过夜摇菌,菌液PCR鉴定为阳性的样品送北京华大基因公司进行测序。
1.6 病毒细胞半数感染量测定将PCR鉴定为阳性的分离株采用Reed-Muench方法进行病毒半数组织培养感染剂量(tissue culture infective dose, TCID50)测定。
1.7 鸡胚致病性检验及分析将PCR鉴定为阳性的分离株通过绒毛尿囊膜接种鸡胚,0.1 mL/枚,连续培养5 d,观察鸡胚死亡情况及胚体病变情况。
2 结果
2.1 临床样本剖检临床样本来源于陕西省延安市某养殖场,全场养殖量在10万羽左右。此次分离样本为商品代海蓝褐,17周龄开始发病,精神萎靡,羽毛蓬松,采食量下降,产蛋下降,19周龄死亡,PCR初步鉴定为FAdV和H9混合感染。剖检可见肝脏和肾脏出血、肿大(图1),胸腺呈现深红褐色,心脏有少部分坏死灶,法氏囊未见肿大和出血。
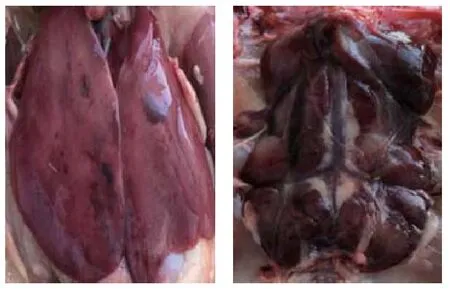
图1 临床样本剖检Fig.1 Clinical sample profile
2.2 病毒分离结果将处理后的肝脏接种LMH细胞,24 h内发现CPE产生,48 h后产生较明显的CPE,病变主要表现为细胞增大、变圆,折光度增高,贴壁性减弱,呈半悬浮状态。LMH细胞对照组无CPE出现。出现CPE的病毒传到第2~3代时,24 h细胞即可产生明显的CPE,96 h内90%细胞完全病变脱落(图2)。
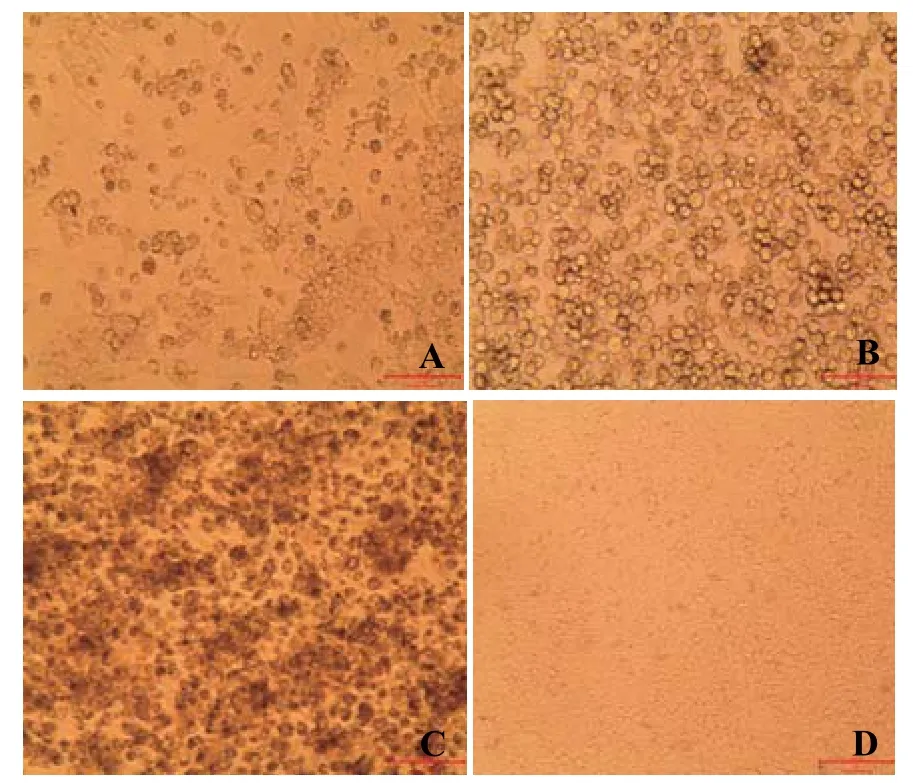
图2 LMH细胞接种结果Fig.2 The result of LMH cell infection
2.3 PCR鉴定结果将出现CPE的细胞培养物采用PCR的方法进行初步鉴定后,细胞培养物在2500 bp位置有一条目的条带,与预期结果相符,而正常LMH细胞为阴性,初步表明细胞培养物中有FAdV(图3)。
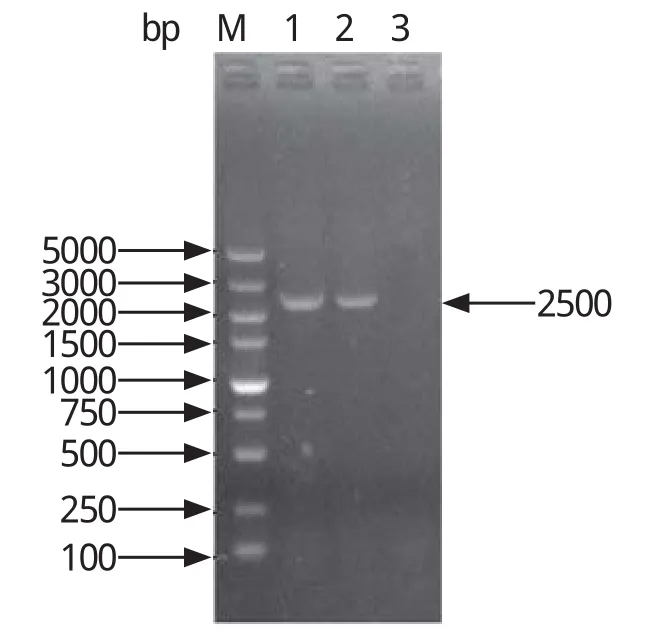
图3 分离株Hexon基因PCR鉴定Fig.3 The PCR identification of Hexon gene from isolate
2.4 Hexon基因同源性分析将测序得到的Hexon基因序列与GenBank上登录的12个血清型进行同源性比对分析,结果发现与FAdV-3参考毒株SR-49同源性为99.4%(图4)。与参考序列的Hexon基因比对发现,20 534、20 971、21 067、21 167、21 670、21 703、21 838、21 844、21 865位点出现碱基突变,20 308位点出现碱基缺失(图5)。
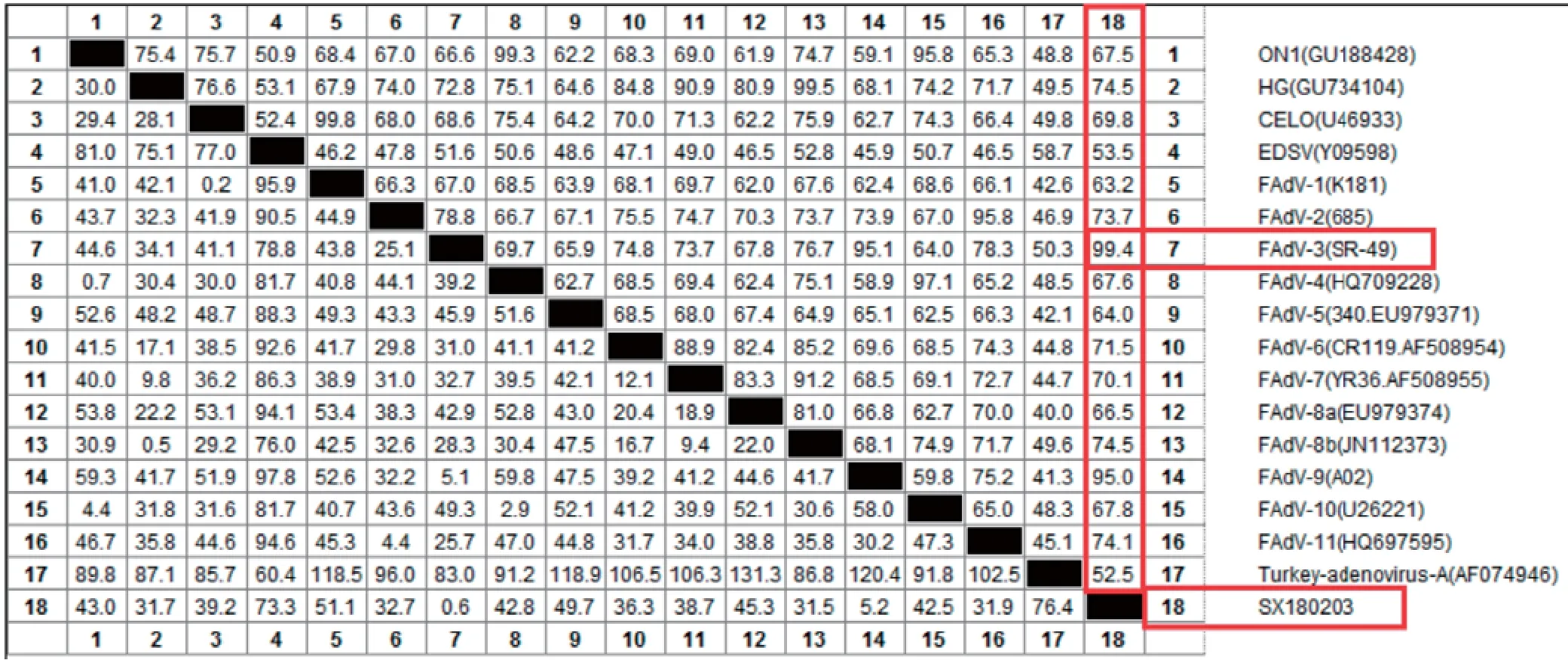
图4 同源性分析结果Fig.4 Homology analysis results

图5 Hexon基因碱基变异区域比较Fig.5 The comparison of Hexon gene nucleotide variation region between SR-49 and SX180203
2.5 Hexon基因系统进化分析使用MEGA 6.0软件对分离株株Hexon基因序列建立基因进化树,根据FAdV的基因型将其进行分组。从进化树分支和遗传距离可以发现,本研究分离的腺病毒与FAdV-3参考毒株位于基因进化树的同一分支上,基因型为D型,血清型为3型(图5)。
2.6 病毒TCID50测定将该毒株进行TCID50测定,按照Reed-Muench方法计算,得出TCID50为10-7.67/0.1 mL。
2.7 鸡胚致病性检验将分离毒株经绒毛尿囊膜接种至9~11日龄SPF鸡胚,阴性对照组接种无菌PBS。结果显示:分离毒株接种48 h时,开始出现死胚,96 h后鸡胚全部死亡,对照组全部正常;分离毒株接种的鸡胚胚体发红矮小、发育不良,剖检可见肝脏出血、有坏死灶,对照组正常(图7)。
3 讨论
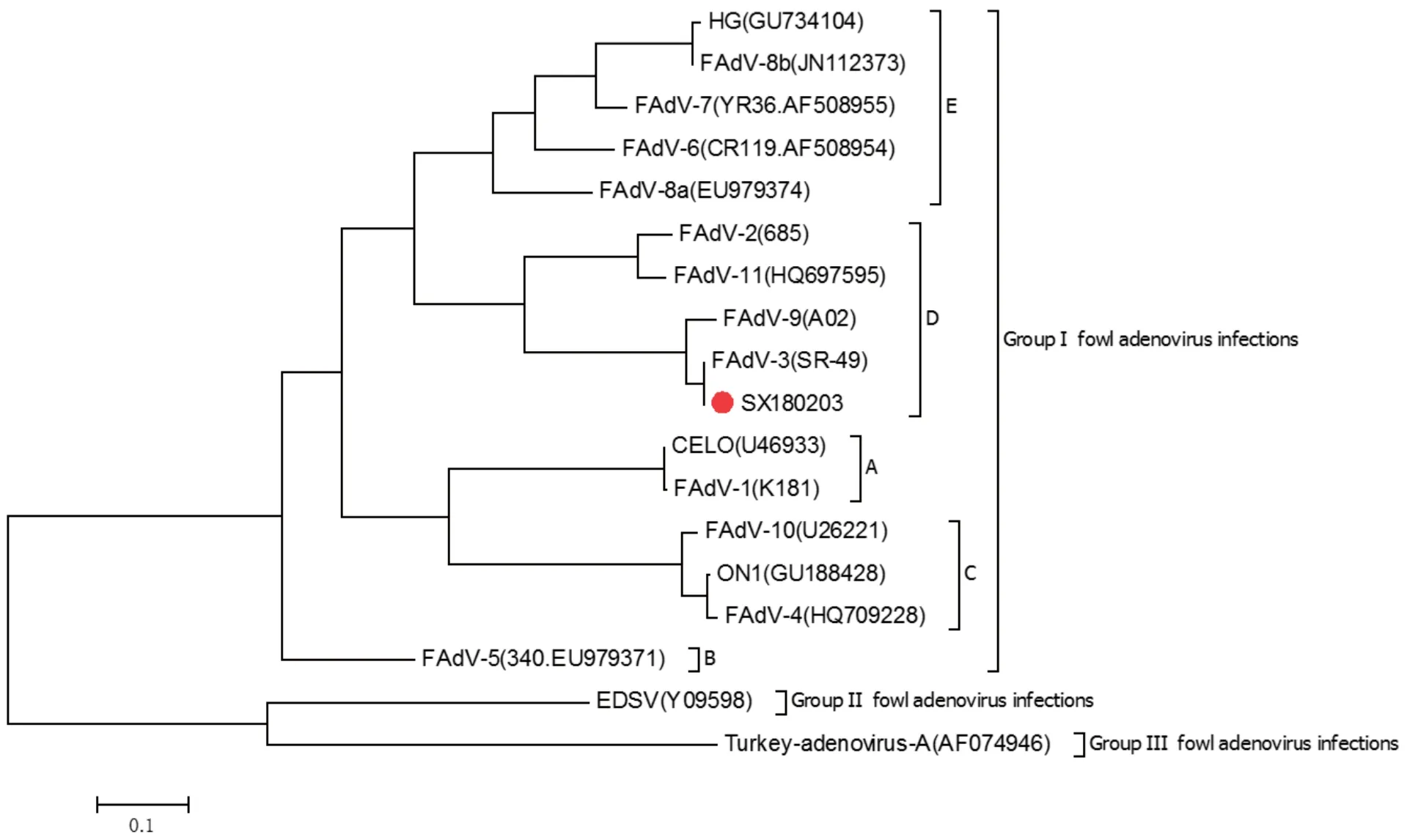
图6 进化树分析结果Fig.6 Evolutionary tree analysis
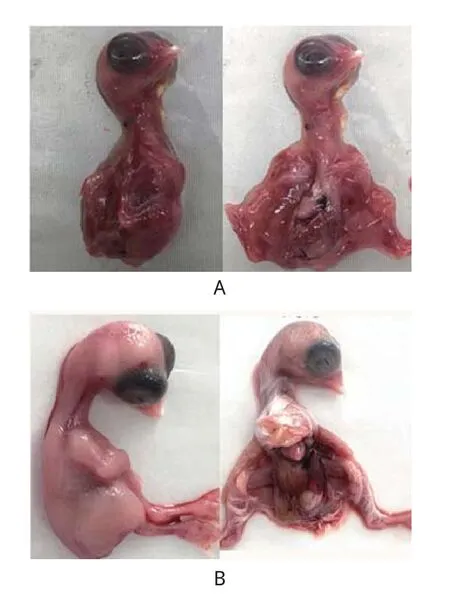
图7 鸡胚接种结果Fig.7 Results of chicken embryo inoculation
Ⅰ群禽腺病毒(FAV-I)主要流行于肉仔鸡饲养地区,以2~5周龄的肉鸡多发,也有10日龄以内发病的报道[9]。在同一农场中可以存在几种不同血清型,其中以血清型FAdV-4引起的肝炎-心包积水综合征(HHS)和基因D型引起的鸡包涵体肝炎(IBH)最为常见,可作为原发性病原诱发疾病[10],不同血清型对禽类致病性各有不同,所以对不同血清型腺病毒的分离鉴定及相关研究尤为重要。目前我国流行的FAV-I主要是FAdV-4、FAdV-8b、FAdV-11,在临床上主要的预防措施是疫苗免疫,且自家苗较多,随之而来的病毒传播风险也相应增加,根据2015-2018年本实验室对FAV-Ⅰ的分子流行病学调查得到,FAV-Ⅰ感染呈现逐年增加的态势,且感染宿主从以蛋鸡、肉鸡为主遍布到水禽、飞禽均可易感,以CAV、CIA、IBD等免疫抑制病混合感染为主,同一机体发病也会出现多种血清型腺病毒混合感染的情况,发病省份也从京、津、冀、鲁地区向全国各省份蔓延,演变成从一种少见疾病到常态化疾病[7]。纵观近几年国内外对禽腺病毒的研究,大多只针对肝炎-心包积水综合征和鸡包涵体肝炎的诱发病原,而对FAdV-3型的相关研究文献少之又少,虽然FAdV-3型只是少量出现,但不排除会出现像FAdV-4型由点到面的暴发趋势,因此应尽早做好预防工作。
本研究成功分离到1株I群禽腺病毒病毒,命名为SX180203,该分离株能感染LMH细胞,使细胞形态变圆、变大、贴壁性减弱,在鸡胚感染过程中,能使鸡胚胚体发育不良、肝脏出血坏死。该分离株不具备凝集大鼠和家禽红细胞的功能,对脂溶剂有抵抗力,能耐受弱酸、弱碱。这些生物学特征与I群禽腺病毒特征一致。通过对该分离株的Hexon基因进行测序分析,并与12个血清型的FAdV进行同源性分析,发现与3型参考毒株SR-49同源性为99.4%,序列遗传进化树也显示分离株与SR-49参考毒株属于同一分支,因此证明本研究分离株为I群禽腺病毒,血清型为3型,基因型为D型,且与参考序列核苷酸比对分析发现,有9个碱基位点出现变异,一个碱基位点缺失,说明FAdV-3型腺病毒出现了核苷酸变异,同时该分离株也为禽腺病毒血清3型毒株疫苗的研发提供了基础。

