鸭源新型鹅细小病毒TaqMan荧光定量PCR方法的建立及初步应用
曹旭阳,王宇飞,张志飞,魏笑笑,秦立廷,陈佶慧,滕巧泱,杨健美,刘芹防,陈鸿军,李泽君,李景环,李雪松
(1.内蒙古师范大学生命科学与技术学院,呼和浩特 010022;2.中国农业科学院上海兽医研究所,上海200241;3.山东新希望六和集团有限公司,青岛 266000)
水禽细小病毒包括能造成雏鹅和雏番鸭高发病率及高死亡率的鹅细小病毒(Goose parvovirus,GPV)和番鸭细小病毒(Muscovy duck parvovirus,MDPV),在临床上属于一种急性且具有高传染性的病原[1-2]。据报道,鹅细小病毒(GPV)只感染雏鹅和雏番鸭并引发“小鹅瘟”[3-4],并不能感染其他种类的鸭子。然而,近几年,一种由新型鹅细小病毒(Novel goose parvovirus,NGPV)引发的“喙萎缩-侏儒症(beak atrophy and dwarfism syndrome,BADS)”在我国各省的樱桃谷鸭和番鸭中相继暴发,感染持续时间更长,感染宿主更加广泛[5-6]。患BADS病鸭的典型症状是喙萎缩、舌突出、生长迟缓、麻痹和腹泻,患鸭体重明显下降且易骨折,该病导致僵鸭淘汰率高达80%,致使中国养鸭业遭受严重的经济损失[7]。
NGPV是线性单链的DNA病毒,该病毒无囊膜包裹且呈二十面体形态[8]。基因组包含两个ORFs,其中右侧的ORF框能编码3种衣壳蛋白质,分别命名为VP1、VP2和VP3蛋白[9]。其中VP3蛋白是构成病毒衣壳的主要蛋白,约占衣壳蛋白总量的80%,携带与受体结合的保护性抗原且最为保守稳定,能诱导机体产生抗体,常被用做基因工程目的抗原[10]。
目前检测NGPV的方法主要有传统的病毒分离、套式PCR法[11]、地高辛标记的核酸探针法[12]、酶联免疫吸附实验法[5]等,但现有的各种方法都有优缺点。传统的病毒分离,耗时且步骤繁琐。套式PCR法,虽然具有高敏感性和特异性,但不易定量,不易大批量检测。地高辛标记的核酸探针法,虽然具有更高的稳定性和特异性,能够克服常规PCR方法出现的假阳性,但其敏感性略低于PCR法,且不能对病毒拷贝数进行定量。荧光定量PCR(FQ-PCR)能够通过荧光信号强度来实时监测扩增产物的量,通过阳性标准曲线即可计算出目的基因的初始量,即能定性又能定量。此方法具有特异性强、高效、快速、灵敏度高且适用于大规模检样等优点,因此在分子检样中得到广泛应用[13-15]。本研究通过优化各种条件建立了一种敏感性高、特异性好的NGPV荧光定量PCR方法,并通过现地临床样品检测证明该方法具有良好的应用性和准确性,为该病原的临床检测提供一种有效的方法。
1 材料与方法
1.1 病毒株NGPV(鸭源新型鹅细小病毒)(A244株)、DRV(鸭呼肠孤病毒)、DTMUV(鸭坦布苏病毒)、GPV(鹅细小病毒)、DEV(鸭病毒性肠炎病毒)、MDPV(番鸭细小病毒)、H9亚型AIV(H9亚型禽流感病毒)、DHAV-I(I型鸭型肝炎病毒)、DHAV-Ⅲ(Ⅲ型鸭型肝炎病毒)均由中国农业科学院上海兽医研究所动物感染与禽新发病毒病团队保存和提供。
1.2 主要试剂Ezup柱式病毒DNA抽提试剂盒购自生工生物工程(上海)有限公司,DNA纯化回收试剂盒购自Axygen公司,E.coliDH5α感受态细胞购自Invitrogen公司,Phanta Max Super-Fidelity DNA Polymerase购自诺唯赞公司,小剂量质粒(去内毒素)抽提试剂盒购自Omega公司,Premix ExTaq(Probe qPCR)试剂盒和pMD19-T载体购自宝生物工程(大连)有限公司。
1.3 特异引物与探针的设计合成根据GenBank上的NGPV序列,设计了关于VP3基因的1条特异探针TaqMan5'-FAM-GPV-P,其序列为5'-FAMCAAGTCAARGAAGTCACAACGCA-BHQ1-3'以及1对适用于荧光定量PCR的引物,NGPV-VP3-F和NGPV-VP3-R,其序列分别为5'-CCCAAGTC TCTTAAATTCAAG-3',5'-CCCAGGACATACG GGAGTTG-3',扩增片段为143 bp。
1.4 阳性标准品的制备根据Ezup柱式病毒DNA抽提试剂盒说明书提取NGPV的DNA,并以NGPV的DNA为模板,使用1.3中的NGPV-VP3-F和NGPVVP3-R,通过Premix Ex-Taq进行PCR反应扩增NGPV的VP3基因片段,该目的片段大小为143 bp。反应条件为:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸50 s,30个循环;72℃延伸10 min,4℃保存。把目的片段切胶回收纯化后克隆至pMD19-T载体上,转化至DH5α感受态细胞中,送金唯智公司测序鉴定。按照小剂量质粒抽提试剂盒说明书提取序列正确的阳性质粒pMD19-VP3(143 bp)作为阳性标准品,检测其浓度并计算出阳性标准品的拷贝数。
1.5 荧光定量PCR反应体系的建立和优化以1.4中已知拷贝数的阳性标准品pMD19-VP3(143 bp)作为模板,利用Premix Ex-Taq(Probe qPCR)试剂盒中的试剂,总体系为20 μL,将探针和引物进行不同浓度的配比(浓度控制在0.2~1 μmol/L)来选择最佳浓度,根据SeqMan软件设计提供的引物与探针的最佳退火温度来调整反应温度与反应时间(Tm为56℃~60℃,T为20 s~40 s),循环参数分别为35、40和45,按照以上条件一一进行优化。
1.6 荧光定量PCR的标准曲线及敏感性将1.4中的阳性标准品pMD19-VP3(143 bp)按照10倍倍比稀释,并且每个稀释度做两次重复,进行荧光定量PCR扩增,同时对10倍倍比稀释好的阳性标准品进行普通PCR。
1.7 荧光定量PCR的特异性试验根据Ezup柱式病毒DNA抽提试剂盒提取GPV、MDPV的DNA,用天根病毒RNA病毒提取试剂盒提取H9亚型AIV、Ⅰ型DHAV、Ⅲ型DHAV、DRV和DTMUV的RNA,并进行反转录成cDNA。利用1.5建立的荧光定量PCR检测方法,对NGPV的核酸以及GPV、DTMUV、DRV、DEV、MDPV、H9AIV、DHAV-Ⅰ、DHAV-Ⅲ的核酸(DNA和cDNA)进行检测,以验证本方法的特异性。
1.8 荧光定量PCR的重复性试验将3.72×107、3.72×105、3.72×103拷贝/μL的NGPV阳性标准品作为模板,利用建立的定量PCR检测方法,并通过数据计算标准差(SD)和变异系数(CV)。
1.9 临床样品检测利用建立的荧光定量PCR检测方法和常规PCR方法,对采集自山东和江苏等地区的50份疑似感染NGPV的临床样品进行检测,以确定本实验建立的荧光定量PCR方法的临床应用性检测效果。
2 结果
2.1 标准品浓度的换算小剂量抽提的阳性标准品质粒浓度为200 ng/μL,根据公式换算后其拷贝数为3.72×107拷贝/μL。
2.2 反应体系的建立和优化结果以阳性标准品pMD19-VP3(143 bp)为模板,1.3中设计的VP3基因上下游引物浓度为0.4 μmol/L,探针浓度为0.8 μmol/L,荧光定量PCR反应程序为:95℃预变性30 s;95℃变性5 s,60℃延伸34 s,40个循环;并于每个循环延伸结束时收集荧光信号。结果表明,在此条件和反应程序中,可以检测到阳性标准品的最小Ct值,扩增曲线呈典型的S型。
2.3 标准曲线及敏感性试验结果将1.4中的阳性标准品pMD19-VP3(143 bp)按照10倍倍比稀释,梯度为3.72×109拷贝/μL~3.72×101拷贝/μL进行常规PCR和荧光定量PCR检测,结果如图2所示。常规的PCR方法只能检测到3.72×103拷贝/μL的阳性质粒模板,而荧光定量PCR方法却能检测到37.2拷贝数/μL的阳性质粒模板,这说明荧光定量PCR方法的灵敏度比常规PCR方法高100倍。由图1可知,梯度稀释的阳性质粒模板的标准曲线呈线性,其扩增方程式为Y=-3.456X+42.26,标准曲线的相关系数R2达到0.991,并且重复检测的结果一致,表明该方法具有良好的扩增效率。
2.4 特异性试验结果利用本试验建立的荧光定量PCR方法同时检测NGPV的核酸以及GPV、DTMUV、DRV、DEV、MDPV、AIV、DHAV-Ⅰ和DHAV-Ⅱ的核酸,结果显示(图3),该定量PCR方法能特异性的检测到NGPV核酸,出现特异的扩增曲线,而其他8种鸭主要病原的核酸检测均为阴性,说明本试验的引物与探针以及所建立的方法特异性良好,与其他鸭源病毒阳性样品均无交叉反应现象。
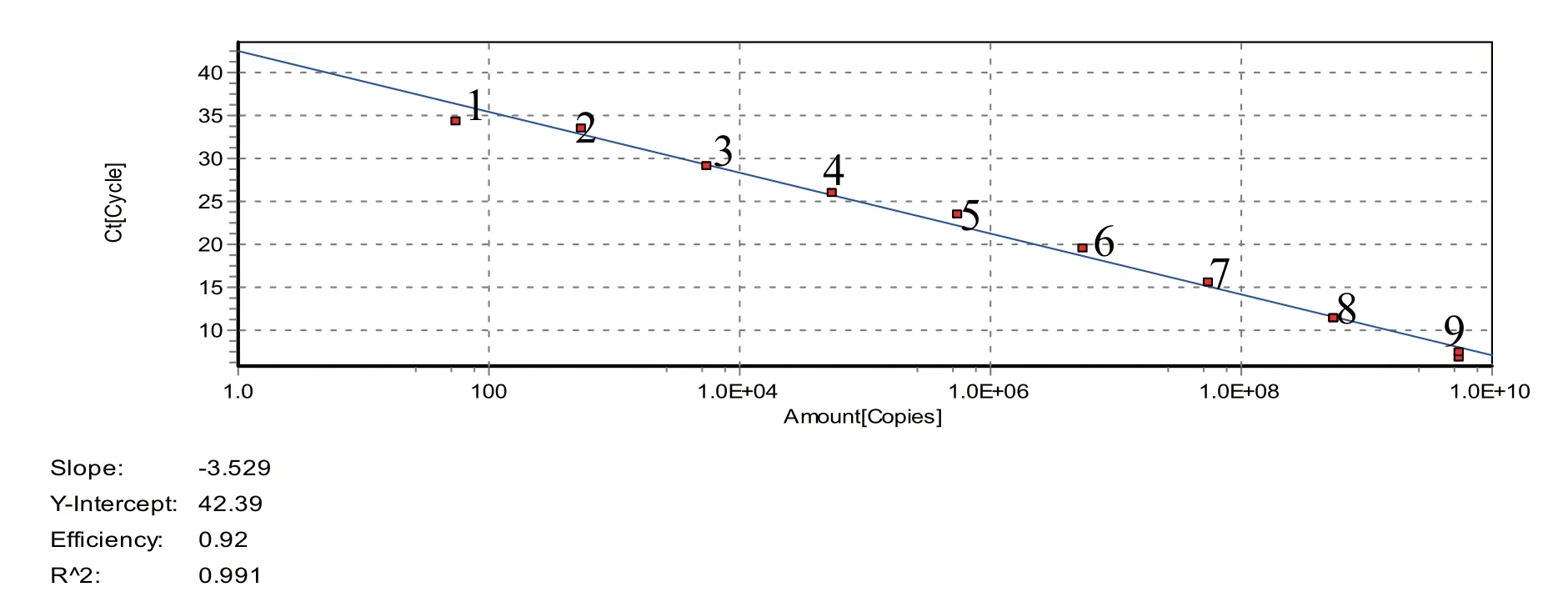
图1 荧光定量PCR标准曲线图Fig.1 The standard curve of the real-time PCR
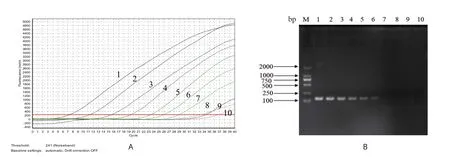
图2 荧光定量PCR(A)和常规普通PCR(B)敏感性比较Fig.2 Comparison of the sensitivity of real-time PCR (A) and conventional PCR (B)
2.5 重复性试验结果利用本实验建立的荧光定量PCR方法同时检测阳性标准品中的3.72×107、3.72×105、3.72×103拷贝/μL样品,进行3次荧光定量PCR检测,并且每个阳性样品做3个重复。结果显示:该方法的批内重复性变异系数CV在0.68%~1.81%,批间重复性变异系数CV在1.36%~2.20%,说明此方法的重复性良好。
2.6 临床样品检测结果利用建立好的荧光定量PCR检测方法,对来自山东和江苏等地区的50份疑似NGPV感染的样品进行检测,在50例样品中,TaqMan荧光定量PCR方法检测其中的39例样本为NGPV阳性,检出率为78%,常规PCR只检测出25例样本为NGPV阳性,检出率为50%(表2)。
3 讨论
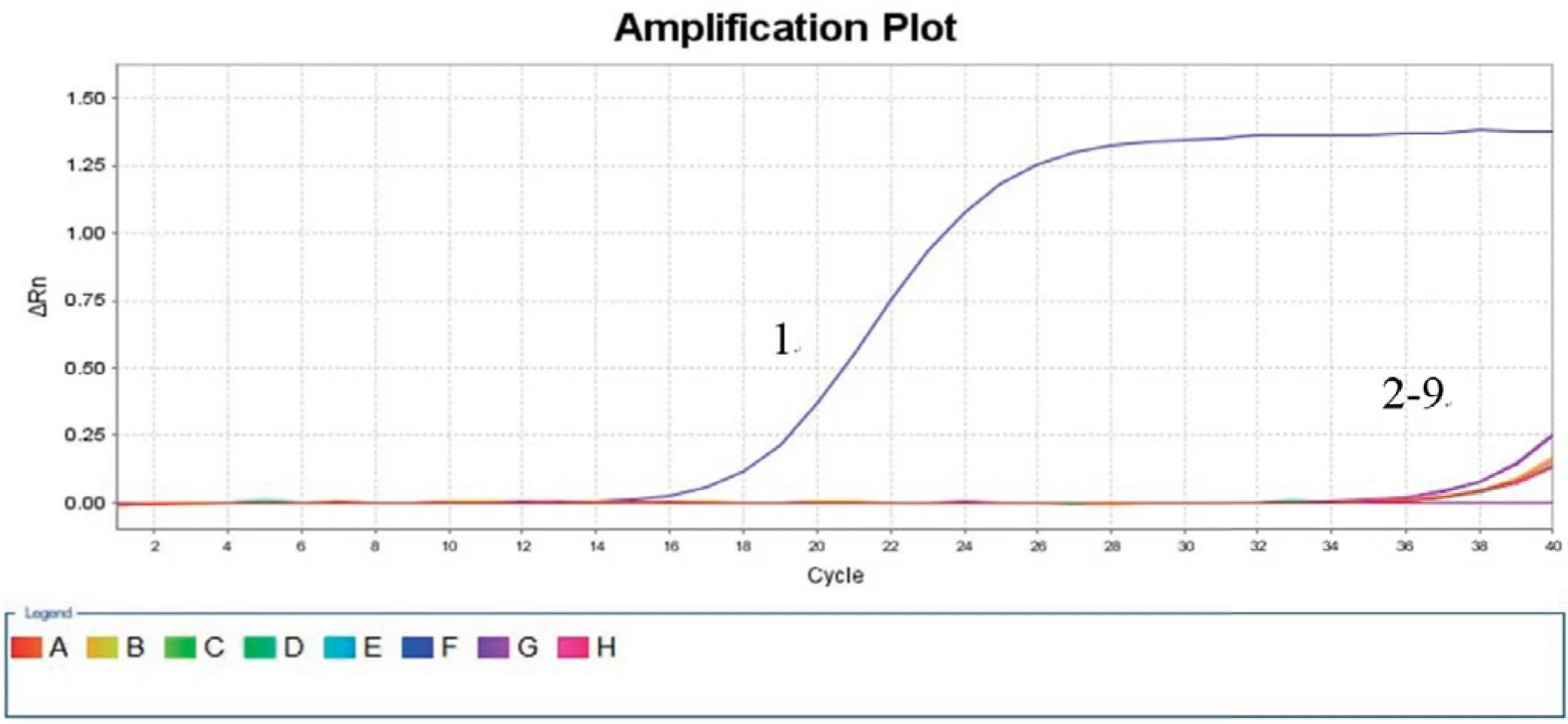
图3 特异性荧光定量PCR检测Fig.3 Specific detection of the real-time PCR
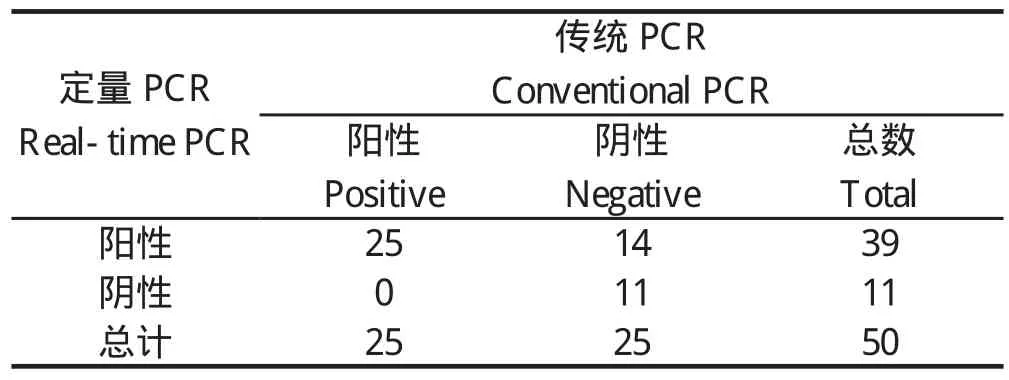
表2 应用荧光定量PCR和常规PCR检测临床样品Table 2 Results of NGPV detection by real-time PCR and conventional PCR for clinical samples
1956年,方定一[4]首次发现了GPV,随后Derzy[16]对该病原进行了更全面的研究。1971年后,在欧洲以及亚洲陆续报道一种新型鹅细小病毒(NGPV),我国也从2014年开始,山东、浙江、广西、江苏、福建等地区鸭群暴发类似于“喙萎缩-侏儒症”(BADS)的疾病[5]。吴蓓等[17]通过特异性引物对山东地区不同病死鸭群的10个脏器进行NGPV的普通PCR检测,发现鸭群个体平均感染率为82.5%,其中心脏在各脏器中检出率最高,可达到82.5%。该病毒可水平亦可垂直传播给雏鸭[18],病发日龄多为10~40 d,不仅影响肉鸭体重,还导致病死率大幅增加。目前,该病给我国养殖业已造成严重的损失。本研究建立了一种快速且敏感的检测NGPV的方法,以期为该病原的诊断提供一种初步有效的手段。
检测病毒的方法很多,包括免疫学方法和分子生物学方法。免疫学方法有一定的误差,而分子生物学方法更为精确。分子生物学常用的方法是荧光定量PCR[19-20]。TaqMan探针法是一种由核酸设计的引物和探针,具有高度特异性,同时比普通PCR结果更直观、精确。本研究根据NGPV相对保守的VP3基因序列,利用SeqMan软件设计了特异的引物与探针(长度最好在20~30 bp)并建立了荧光定量PCR,优化其引物、探针的浓度以及反应条件以达到最好的检测效果,并且通过与常规PCR的敏感性试验对比,发现本实验建立的荧光定量PCR方法比普通PCR方法高100倍,且能根据阳性标准品定量,而且本方法具有重复性好和特异高的特点。相比于已建立的NGPV荧光定量PCR方法外[19-20],本实验进行了荧光定量PCR与普通PCR的敏感性对比实验,以确立建立的荧光定量方法的有效性,同时本实验所构建的标准品载体所需的目的片段只有143 bp,最低检测拷贝数可达37个拷贝数,比之前的方法略敏感,在特异性检测方面选择了8种病毒进行验证,相比于前者特异性的检测更加的全面。因此,本研究建立的NGPV TaqMan 实时荧光定量PCR方法对于NGPV的检测具有准确性高、敏感性和特异性好、应用性强的特点,对该病的早期诊断、疾病防控具有重要的意义。

