铈锆共掺杂对二氧化钛光催化性能的影响研究
施凯旋,王瑞芬,安胜利
(1. 内蒙古科技大学 材料与冶金学院,内蒙古 包头 014010;2. 内蒙古先进陶瓷材料与器件重点实验室,内蒙古 包头 014010)
0 引 言
纳米TiO2光催化剂是一种N型半导体材料,光催化活性很高,氧化能力强[1],其在紫外光照射下可以完全将有机污染物降解为水、二氧化碳和一些小分子无机盐,尤其是对难降解有机污染物的处理具有明显优势,并且在发生反应时具有较好的光稳定性和较高的反应活性[2],是不可取代的绿色环保材料。但在水体污染净化方面,TiO2催化剂的失活,较低的光量子效率,复杂的反应环境等因素制约着光催化技术的应用[3]。研究表明,通过对半导体材料沉积贵金属[4]或其他金属氧化物[5]、硫化物[6]、掺杂无机离子[7]、光敏化以及表面还原处理[8]等方法引入杂质或缺陷,有助于改善TiO2的光吸收,提高稳态光降解量子效率及光催化性能,Dong等的研究表明[9-11],两种离子掺杂光催化剂的光催化活性一般高于单掺杂光催化剂和纯光催化剂。本文首次采用稀土元素铈和金属锆对TiO2共掺杂,通过一系列表征和光催化测试,得出铈锆掺杂对TiO2光催化剂的影响规律。
1 实 验
1.1 催化剂的合成
样品采用溶胶-凝胶法制备。配制0.1 mol/L的Ce(NO3)3和ZrOCl2标准溶液备用,以水作溶剂。准确量取钛酸丁酯17 mL、无水乙醇23 mL和冰醋酸10 mL混合均匀形成A溶液,将铈锆溶液按一定体积比混合,加水共15 mL,配制与TiO2掺杂摩尔百分比为0%、0.25%、0.5%、0.75%、1%、2%的B溶液。在持续搅拌条件下将B溶液缓慢滴入6份A液中(2 h),滴加完毕后在常温下继续搅拌2 h。将所得的胶体在90 ℃下干燥24 h,500 ℃焙烧2 h,冷却后研磨。将不同掺杂比例的样品标记为x%M-TiO2,M代表按一定体积比混合的铈锆Ce,Zr。
1.2 催化剂活性测试
光催化活性测试选用的目标污染物为亚甲基蓝和罗丹明B。将0.1 g催化剂加入100 mL浓度为20 mg/L亚甲基蓝(罗丹明B)溶液中。在无光照条件下强力搅拌30 min后,把液体移至300 W氙灯下进行降解,实验光照强度均为100 mW/cm2,每隔20 min取样测试降解率,共取样7次。
1.3 水接触角测试
称取0.1 g催化剂,滴加8~9滴硅酸乙酯(TEOS)搅拌均匀将其涂覆在载玻片上,在干燥箱中以5 ℃/min的加热速率进行升温,125 ℃下干燥3 h。在载玻片上滴4 μL水滴测量其水接触角(WCA),进行5次测量取最佳值。
1.4 催化剂的表征
光催化剂的XRD测试使用德国Bruker公司生产的D8-ADVANCE型高级衍射仪,测试条件是40 kV管压,40 mA的电流,Cu、Kaλ射线(λ=0.15406 nm);通过 Zeiss ULTRA55扫描电镜观测催化剂表面形貌;FTIR的测试在台湾斯特公司生产的FT-IR1200型傅里叶变换红外光谱仪上进行;DRS和PL谱的测试分别使用日本日立U-3900型紫外-可见分光光度计和U-4600荧光光谱仪;水接触角使用由德国dataphysics公司的OCA25视频光学接触角测量仪进行测试。
2 结果与讨论
2.1 XRD分析
图1(a)是不同掺杂比的TiO2催化剂进行XRD表征得到的图谱。所有样品具有明显的TiO2锐钛矿相特征衍射峰,2θ在25.3°、38.0°、48.2°、55.1°和62.9°处的特征衍射峰分别对应锐钛矿TiO2晶体的(101)、(004)、(200)、(105)、(204)晶面(标准JCPDS卡片73-1764)[12]。图中未出现氧化铈或氧化锆的衍射峰,这可能是由于掺入的Ce和Zr的量过低,或是强度低于仪器检测限所致,也可能是由于铈锆以离子替代的形式进入了TiO2晶格当中。
进一步观察图1(b)中放大的(101)晶面特征峰发现,掺杂以后的样品的衍射峰均向左发生偏移,根据布拉格方程2dsinθ=nλ可知[13],θ减小时sinθ减小,晶面间距d的值增大,说明晶格发生了一定程度的膨胀,这可能是由于半径更大的铈锆以离子替代的形式进入了TiO2的晶格所致。同时,衍射峰的半高宽较纯TiO2有宽化趋势,说明掺杂可使晶粒尺寸细化,晶粒的细化可能为掺杂样品提供更大的比表面。
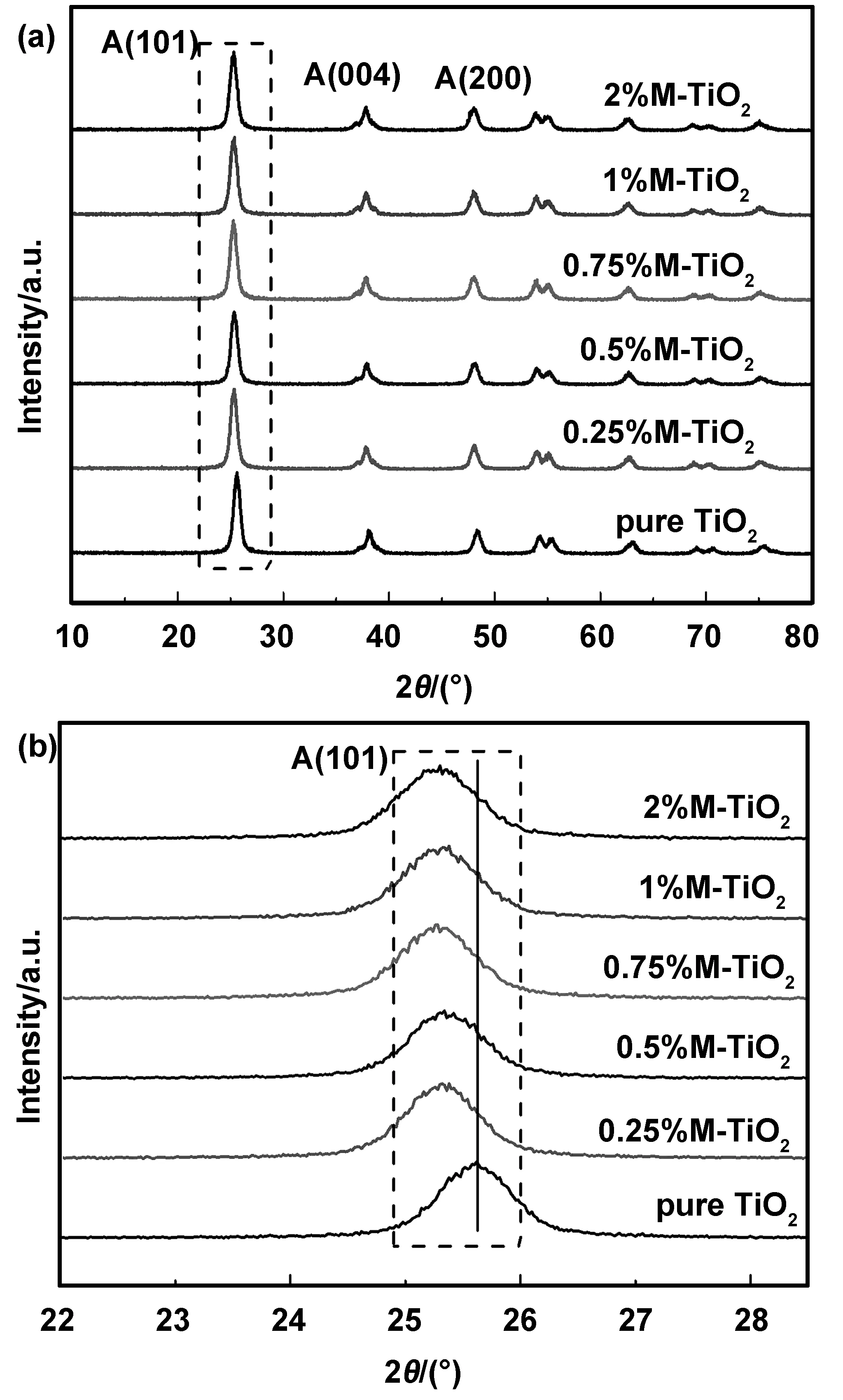
图1 不同样品的XRD图:(a)全角度范围XRD谱图,(b)第一主峰放大XRD谱图Fig 1 XRD patterns of different samples: (a) XRD spectrum of full angle range, (b) enlarged XRD spectrum of the first main peak
2.2 形貌分析
图2是纯TiO2和0.5%M-TiO2样品的SEM图,从图中可以看出,两种样品的形貌均由近似球状颗粒堆垛而成,整体聚集体呈现疏松的海绵状结构,且颗粒的粒径分布较为均匀。同时,由于颗粒为球状,聚集体也可提供丰富的孔洞结构。相比较而言,铈锆共掺杂样品颗粒聚集程度有所降低,同时颗粒间的堆垛更加疏松,颗粒间的孔洞更为丰富,这种形貌特征有利于提供更高的比表面积以及更丰富的孔洞结构,有利于光催化反应的进行。

图2 不同样品的SEM图 (a)纯TiO2,(b)0.5%M-TiO2Fig 2 SEM images of different samples: (a) pure TiO2; (b) 0.5% M-TiO2
2.3 FT-IR分析
图3是不同铈锆掺杂比例二氧化钛的FT-IR图谱,由图可知, 3 403 cm-1附近宽而强的吸收峰是非缔合的-OH基团的伸缩振动引起的,与表面吸附水有关,与它相似的在1 626 cm-1附近的峰也是属于TiO2表面的-OH基团的伸缩振动峰[14];在2 925 cm-1附近出现的峰归属于有机物煅烧后残留物中-CH-的伸缩振动峰,而1 387 cm-1处的吸收峰为其面内弯曲振动峰[15];2 340 cm-1处出现的较强吸收峰,是结构中的C=O(羰基)振动引起的[16],结构中的C=O可能来源于制样时空气当中的CO2所致;800~450 cm-1处的强吸收峰为TiO2晶体表面的Ti-O键的伸缩振动的吸收峰[17],铈锆掺杂样品中,该吸收峰均有钝化和变弱的趋势,说明其内部Ti-O所处的化学环境有所变化,与前述XRD结果中铈锆离子进入TiO2晶格的表征结果相一致。总体而言,与未掺杂TiO2谱图比较,在大波数范围内,掺杂后TiO2的吸收峰强度总体增强,这主要是因为掺杂引起基团间作用力发生改变,从而导致吸收峰的变形。
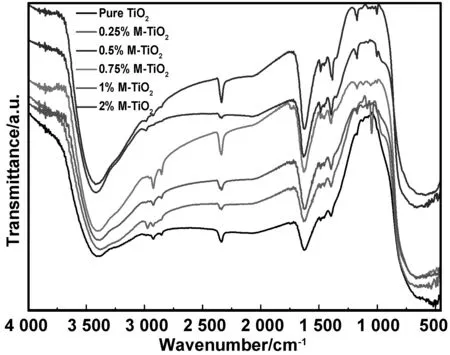
图3 不同样品的FT-IR图Fig 3 FT-IR patterns of different samples
2.4 UV-Vis DRS分析
图4(a)是纯TiO2和掺杂不同比例铈锆的TiO2光催化剂的UV-Vis图谱。由图可知,与纯TiO2的紫外-可见吸收光谱相比,掺杂Ce和Zr后,样品的吸收边带均有不同程度的红移,禁带宽度也相应有小幅度的减小,同时样品在可见光区的吸收也有一定的增强,特别是当掺杂量大于1%之后,掺杂样品对于可见光的吸收增强明显。二氧化钛为间接带隙型半导体,根据K-M方程,以(ahv)1/2为纵坐标,样品的带隙值(Eg)为横坐标作图,如图(b)所示。通过计算得出,6个样品掺杂量从0%到2%,其带隙值分别是2.75、2.62、2.54、2.52、2.44和2.39 eV,带隙值随掺杂量的增加而降低,说明掺杂可以拓宽光催化剂在可见光区的响应范围,理论上讲可有效提高掺杂样品对可见光的利用效率。

图4 (a)不同样品的UV-Vis图,(b)(ahv)1/2随带隙能量变化图Fig 4 UV-vis patterns of different samples and (ahv) 1/2 as a function of light energy
掺杂样品禁带宽度减小的原因,一方面可能由于离子掺杂引入了杂质能级,杂质能级与TiO2的导带和价带发生杂化,使导带向下移动,价带则向上移动,因而使得掺杂后的TiO2禁带宽度变小,在吸收谱中出现吸收边红移的现象;另一方面也可能是由于掺杂引起样品晶粒减小的同时也增加了TiO2颗粒的内部应力,而内部应力的增加会导致能带结构的改变,从而使带隙、能级间距变窄,使得紫外-可见吸收曲线边带发生红移。
2.5 PL分析
图5为实验所得样品的荧光光谱图(λexc=325 nm),在370~420 nm和450~500 nm处观察到了两组主峰。370~420 nm范围内的峰属于带隙跃迁的发射峰,450~500 nm范围内的峰可能归因于载流子的跃迁,PL谱中峰的强度主要取决于重组光生电子和空穴的分布。如图所示掺杂样品与纯TiO2具有相似的PL光谱,只是在荧光强度上有些差别。且PL谱图中并未出现新的发光峰,说明铈锆掺杂在此测定条件下并没有引起新的发光现象[18]。其他掺杂样品的荧光强度也比纯TiO2强度低,说明铈锆掺杂可以有效降低光生电子-空穴的复合几率,提高载流子寿命,从而有利于光催化活性的提高[19]。

图5 不同样品的PL图Fig 5 PL spectra of different samples
2.6 水接触角(WCA)测试
水接触角(WCA)是衡量液体对材料表面润湿性能的重要参数,也可反映材料的疏水性,通常而言,如果WCA高于90°,则表面是疏水的,如果WCA低于90°,则表面是亲水的。为了考察水对不同比例铈锆掺杂TiO2材料表面的润湿情况,将不同组成的光催化剂涂敷于载玻片,进行了水接触角测试。
图6表示的是涂覆不同样品载玻片上的水滴图像,由图可以看出,纯TiO2的WCA为75.2°,表明纯TiO2亲水性较强,涂覆不同掺杂样品的载玻片上WCA均有所增加,涂覆0.25%M-TiO2、0.5%M-TiO2、0.75%M-TiO2、1%M-TiO2和2%M-TiO2的载玻片,与水的WCA分别为80.9°、106.1°、100.2°、98.9°和102.8°,说明通过铈锆掺杂可提高TiO2材料表面与水的接触角。

图6 不同样品的水接触角Fig 6 Water contact angle of different samples
污染物降解的一般步骤是:污染物分子先吸附在光催化剂表面,再与空穴发生氧化反应实现分解。由以上水接触角测试结果可知,在光催化剂使用时,铈锆掺杂TiO2由于表面疏水性增强,可以释放出更多光催化剂表面来与污染物分子直接接触,有利于增强光催化剂表面对污染物的吸附和降解效果。
2.7 光催化活性和稳定性分析
光催化实验包括吸附和光催化两个步骤。图7是不同样品对亚甲基蓝(MB)的降解率随时间变化图,由图可以清晰地看出,共掺杂样品都可以不同程度提高二氧化钛对MB的降解效率。所有样品在黑暗条件下进行30 min吸附后,MB的降解率变化均很小(<3%)。给予光照之后,降解率均明显增大,当降解时间为60 min时,0.5%M-TiO2样品的降解速率明显增大,到140 min时降解率达到49.61%,为相同条件下纯TiO2样品降解率的2倍。

图7 不同样品对亚甲基蓝降解率对比图Fig 7 Comparison of methylene blue degradation rate of different samples
为了进一步考察上述降解性能最好样品0.5%M-TiO2对有机物的降解能力,进一步进行了罗丹明B(RhB)的降解实验。图8是0.5%M-TiO2和纯TiO2在可见光下降解RhB的降解率曲线对比图,前30 min的吸附过程与图7降解MB的过程非常类似,两种光催化剂的吸附率都较低,随后在光照条件下, 0.5%M-TiO2样品对RhB的降解率随时间延长逐渐增大,到140 min时降解率达到61.95%,约为纯TiO2的3倍,说明0.5%M-TiO2样品具有优良的光催化性能。

图8 纯TiO2和0.5%M-TiO2样品对罗丹明B降解率对比图Fig 8 Comparison of degradation rates of rhodamine B by pure TiO2 and 0.5% M-TiO2 samples
为了进一步考察光催化剂的使用寿命和稳定性,进行了光催化剂的循环使用实验,降解时间仍为140 min。将反应后的0.5%M-TiO2与污染物离心分离,再用去离子水洗涤多次烘干,最后研磨成粉体回收进行下一次光催化降解实验。
图9所示是0.5%M-TiO2降解RhB的循环利用降解率对比图,由图可知,随着使用次数的增加,光催化剂对RhB的降解率逐渐降低,当0.5%M-TiO2催化剂连续使用5次时,其对RhB的降解率由初始使用的61.95%降低到53.85%,5次循环使用后催化活性降低了约8%。因此本实验的催化剂在连续使用5次13 h,催化剂对活性废水仍具有较好的降解效果,这说明共掺杂光催化剂具有较好的使用稳定性。

图9 0.5%M-TiO2样品使用不同次数后罗丹明B降解率(反应条件和图8相同)Fig 9 Degradation rate of rhodamine B after 0.5%M-TiO2 sample used different times (the reaction conditions are the same as in Fig 8)
铈锆掺杂样品可见光下光催化活性的提高主要有以下几个方面的原因:首先由于掺杂引入的Ce和Zr离子半径均大于Ti的离子半径,掺杂引起TiO2的晶格膨胀,必然会带来晶格畸变,少量晶格畸变可形成电子捕获陷阱,从而利于空穴的分离迁移,增强其催化氧化能力;其次由掺杂引入了杂质能级,使得掺杂TiO2禁带宽度变小,增强了可见光的利用率;再次,掺杂使得TiO2的疏水性能增强,有利于污染物分子与光催化剂表面的直接接触,提高其光催化效率。
3 结 论
通过溶胶-凝胶法制备了铈锆掺杂的TiO2光催化剂,通过对其组成结构、形貌以及光催化性能进行分析,得出以下结论:实验制备的铈锆掺杂的TiO2光催化剂均为锐钛矿型TiO2,样品的形貌均呈海绵状,颗粒比较分散,粒径分布较均匀。UV-Vis图谱表明,纯TiO2对可见光的吸收很少,掺杂了铈锆的TiO2催化剂对可见光的吸收能力增强。荧光测试得出掺杂铈锆使得电子空穴复合几率减小,载流子浓度增加。光催化结果表明,在300 W氙灯下照射140 min,样品0.5%M-TiO2对亚甲基蓝和罗丹明B的降解率都达到最大值,分别为49.61%和61.95%,是纯TiO2光催化剂的2~3倍,且具有较好的稳定性。

