新生儿坏死性小肠结肠炎伴发肠穿孔危险因素的回顾性研究
王元惠,王皓洁,,刘志杰,詹江华
(1.天津医科大学研究生院,天津300070;2.乌鲁木齐儿童医院新生儿外科,乌鲁木齐830000;3.天津市儿童医院普通外科,天津300074)
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是一种累及回肠、结肠的肠道炎症坏死性疾病,也是新生儿期最常见的致死性外科疾病。研究显示,NEC在存活婴儿中发病率为0.5%~5.0%,死亡率约30%,而在需要外科手术治疗的患儿中可高达50%[1]。肠穿孔是新生儿期常见的危重症,起病急,病死率高(30%~70%),而NEC是新生儿肠穿孔最常见病因[2-3]。NEC伴发肠穿孔为其绝对手术指征[4]。所以,早期识别NEC伴发肠穿孔的危险因素,对于早期识别并采取相应的预防方案以避免穿孔具有重要意义。但目前国内外此方面的相关报道较少,本研究旨在分析NEC伴发肠穿孔的危险因素,以期为临床诊疗提供参考。
1 对象与方法
1.1 研究对象 选取2014年1月—2019年1月在乌鲁木齐儿童医院新生儿科收治的确诊为NEC伴发肠穿孔的患儿55例,并按照1:2配比随机选取同期收治的Bell’s分期≥Ⅱ期NEC未伴发肠穿孔的患儿110例作为对照组。纳入标准:(1)入院日龄≤28 d。(2)NEC 依据 Bell’s分期≥Ⅱ期[5-6]。(3)临床资料完整者。排除标准:(1)合并先天性消化道畸形者。(2)住院时间小于3 d。(3)胎龄、出生体重、腹部影像学检查资料等不完整者。NEC发病日龄:患儿出现呕吐、腹泻、腹胀、血便等任意症状或体征之一的日龄。NEC诊断标准:出现腹胀、呕吐、血便等临床症状,腹部X线或B超提示肠壁积气或门脉积气或手术证实为NEC者[7-8]。肠穿孔诊断标准:腹部立位X片提示膈下游离气体、包裹性或局限性气腹;或腹部彩超提示腹腔积液、肠蠕动消失、肠坏死;或腹腔穿刺证实腹腔内有消化道内容物;或手术中发现有穿孔的患儿[8]。预后良好:指达到临床治愈出院或临床症状明显好转,家属要求出院的患儿,出院后门诊或电话随访3个月患儿状态可。预后不良:指住院期间病情危重,家属要求放弃治疗或临床死亡的患儿。
1.2 研究方法 收集符合纳入标准患儿的临床资料:基本资料包括胎龄、出生体重、性别、NEC发病日龄及预后等;围生期资料包括母亲孕龄、围产期窒息、胎膜早破、羊水粪染、宫内窘迫、分娩方式;母亲孕期合并症包括妊娠肝内胆汁淤积症(ICP)、糖尿病及高血压等;出现NEC至肠穿孔期间的并发症包括呼吸衰竭、败血症、消化道出血、休克、凝血功能障碍、心功能不全、肝肾功损害及电解质紊乱等。
1.3 统计学处理 所有资料均采用SPSS 23.0统计学软件进行分析处理。正态分布的计量资料以x±s表示,组间采用独立样本t检验;偏态分布则以中位数和四分位间距M(Q1,Q3)表示,组间采用Mann-Whitney U检验。计数资料以n(%)表示,采用字2检验或Fisher’s检验。先单因素分析各变量,再对单因素分析中差异有统计学意义的变量进行多因素Logistic回归分析。利用受试者工作特征(ROC)曲线分析各独立危险因素对NEC伴发肠穿孔的预测价值。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患儿基本资料 本研究共计纳入符合标准患儿165例,其中NEC伴发肠穿孔组 55例,男34例;对照组 110例,男60例。两组在性别、NEC发病日龄的差异无统计学意义(均P>0.05);在胎龄、出生体重、不良预后等差异有统计学意义(均P<0.05),说明NEC伴发肠穿孔组的胎龄、出生体重及不良预后比例明显高于对照组,见表1。
2.2 围生期及母孕期因素对 NEC是否伴肠穿孔的影响 两组围生期资料比较发现,剖宫产分娩、胎膜早破、羊水粪染、宫内窘迫、母亲孕龄、孕期合并ICP、糖尿病、高血压等指标在两组中差异无统计学意义(均P>0.05);而围产期窒息在两组中差异有统计学意义(P<0.05),见表1。
2.3 NEC诊断至肠穿孔期间合并症对是否伴发肠穿孔的影响 两组并发症比较发现:NEC并发消化道出血、肝功能损害、高钾血症、低钠血症等差异无统计学意义(均P>0.05);而并发呼吸衰竭、败血症、休克、肾功能损害、凝血功能障碍、低钾血症、低钙血症等差异有统计学意义(均P<0.05),见表2。

表1 两组患儿基本资料、围生期及母孕期资料的对比[x±s,n(%),M(Q1,Q3)]Tab 1 Comparison of basic data,perinatal and maternal pregnancy data between the two groups[x±s,n(%),M(Q1,Q3)]
2.4 NEC伴发肠穿孔的危险因素Logistic回归分析 将以上单因素分析中具有统计学意义指标作为自变量,包括胎龄、出生体重、围产期窒息、NEC诊断后并发症(呼吸衰竭、败血症、休克、肾功能损害、凝血功能障碍、低钾血症、低钙血症),以NEC是否伴发肠穿孔作为因变量(赋值:伴发穿孔=1;未伴发穿孔=0),进行Logistic回归分析。结果显示:NEC并发败血症、凝血功能障碍、低钾血症是NEC伴发肠穿孔的独立危险因素,而高胎龄为其保护因素,见表3。上述4项指标进行共线性诊断,方差膨胀因子分别为1.062、1.312、1.105和1.304,提示4个危险因素不存在多重共线性。
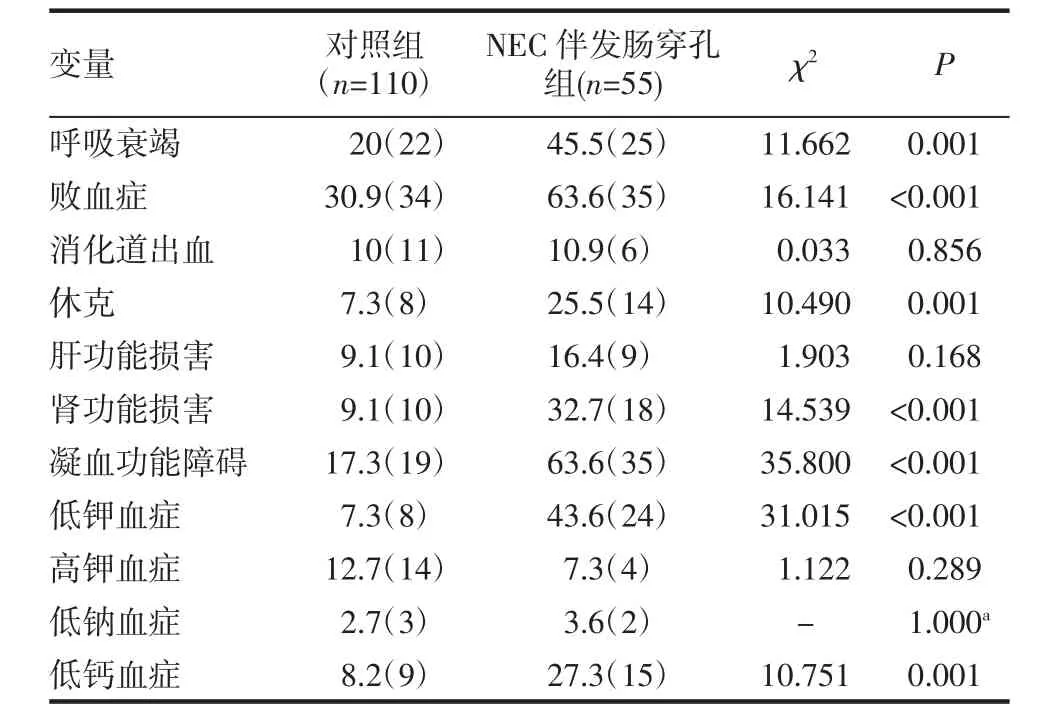
表2 NEC诊断至肠穿孔期间的合并症在两组中的比较[n(%)]Tab 2 Comparison of comorbidities from NEC diagnosis to intestinal perforation in two groups[n(%)]

表3 NEC伴发肠穿孔的多因素Logistic回归分析Tab 3 Multivariate Logistic regression analysis of NEC associated with intestinal perforation
2.5 多种危险因素联合对NEC伴发肠穿孔的预测 将多种危险因素(NEC并发败血症、凝血功能障碍及低钾血症)为检验变量,以NEC伴发肠穿孔为状态变量进行拟合ROC曲线分析显示,败血症联合凝血功能障碍、败血症联合低钾血症、低钾血症联合凝血功能障碍、三者联合对NEC伴发肠穿孔均有一定预测价值(P<0.05),但其中以三者联合预测NEC伴发肠穿孔的曲线下面积最大(ROC曲线下面积为0.875),预测效能最好,见表4,图1。

表4 ROC曲线分析各独立危险因素联合的预测价值Tab 4 ROC curve analysis of the combined predictive value of each independent risk factor
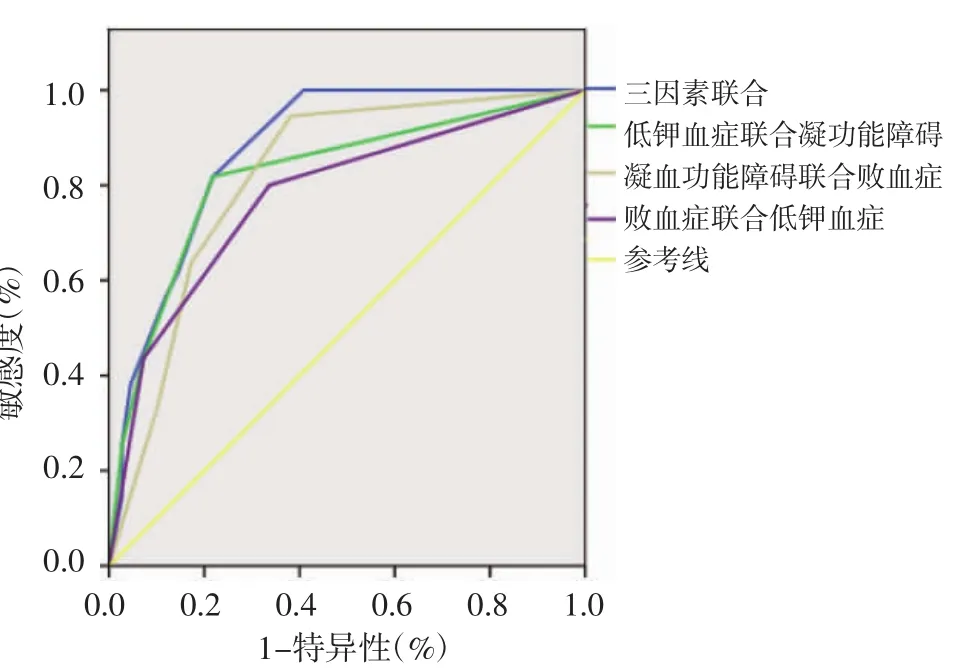
图1 各独立危险因素联合对NEC并发肠穿孔预测的ROC曲线Fig 1 The ROC curve predicted by each independent risk factor combined with NEC complicated intestinal perforation
3 讨论
NEC是一种以肠道组织炎症和坏死为特征的疾病,绝大部分为早产儿发病,中度早产儿(MPT 28~34周)发病率在NICU中占较大比例,但极早产儿(EPT≤28周)的发病率最高[9]。NEC是引起新生儿肠穿孔的最常见原因,相较于足月儿,早产儿NEC伴发肠穿孔风险明显增加。NEC伴发肠穿孔起病急、进展快,容易引起水电解质及酸碱紊乱、感染性休克及DIC等,早期缺乏典型表现,容易延误诊断而危及生命。本研究对NEC是否伴发肠穿孔的危险因素进行分析,为临床诊疗提供重要参考。
本研究发现,NEC伴发肠穿孔组早产儿比例明显高于对照组(87.5%vs.52.1%),且高胎龄是NEC伴发肠穿孔的保护因素。有研究指出,早产是影响NEC预后的危险因素,且会增加发生肠穿孔的风险[10]。Cotten[11]研究指出,NEC发病率与胎龄呈负相关,且胎龄越小,伴发肠穿孔的风险越高。分析原因如下:(1)早产儿尤其是胎龄越小的患儿,出生体重常较低,各器官系统发育均不成熟,尤其肠道消化吸收功能不成熟、肠道屏障功能及局部免疫功能极低或缺陷(如胃酸分泌不足、胃蛋白酶的活性低、上皮内免疫T细胞活性低、分泌型IgA含量低等)。(2)发生NEC时,肠蠕动明显减弱,病原菌容易停留繁殖,产生大量内毒素,侵袭破坏肠壁组织,再结合早产儿自身免疫和肠道菌群尚未建立,可进一步导致肠道炎症更重,发生肠坏死、肠穿孔风险增加[12]。患儿自身免疫系统、肠道消化吸收及屏障免疫功能随着患儿胎龄增大而逐渐成熟,所以高胎龄NEC患儿肠穿孔风险明显降低。临床对于低胎龄的NEC患儿,应特别注意合理喂养、定期监测消化道症状、腹部体征变化,便于早期发现相关并发症,及时给予干预。
败血症是NEC伴发肠穿孔的独立危险因素。Bowker等[13]研究指出,NEC发病后肠黏膜免疫功能受损、肠上皮损伤缺血、肠道微循环障碍、肠道菌群移位等,导致败血症发生率明显增加。当NEC并发败血症时,细菌在血液中繁殖并产生大量毒素,并作用于不成熟且受损的肠上皮细胞,刺激肿瘤坏死因子-α、白细胞介素-8、血小板活化因子等细胞因子大量产生,引起细胞因子介导的炎症级联反应,在原有肠道损伤基础上进一步加重,导致发生肠坏死、肠穿孔、全腹膜炎风险明显增加,甚至发生感染性休克,危及患儿生命[14]。对于NEC患儿,临床护理时注意做好手消毒,避免交叉感染;当并发败血症时,需积极抗感染治疗,注意密切监测患儿炎症指标、腹部影像学表现,尽量降低肠穿孔可能。
凝血功能障碍是NEC伴发肠穿孔的独立危险因素。有研究指出,NEC患儿肠系膜血管内皮损伤、肠道组织炎症和凝血功能三者之间有紧密联系,而在NEC患儿中,凝血功能障碍和肠系膜血栓形成较常见,二者可加重肠组织缺血,肠黏膜上皮坏死脱落,肠壁通透性增加,严重可导致广泛肠坏死、肠穿孔、多器官功能障碍综合征(MODS)等[15-16]。NEC患儿常出现凝血和抗凝蛋白的基因表达异常,使凝血功能加强,纤溶系统受损,使NEC整体处于净促凝状态。其主要机制有[17]:(1)中性粒细胞弹性酶(ELANE)的过度表达:ELANE编码的蛋白产物主要参与凝血途径激活,驱动“免疫血栓形成”级联反应。肠道病原微生物入侵后通过激活ELANE,导致大量血栓的形成和不同程度的肠缺血。ELANE蛋白产物的作用还可以通过抑制组织因子通路抑制剂和抗凝血剂,参与血栓形成,可进一步导致局部损害(肠系膜血栓形成、局部肠壁缺血和肠穿孔)和全身损害(即器官微血栓形成、弥漫性血管内凝血和MODS)。(2)组织纤溶酶原激活物表达下调:尽管凝血和纤溶系统的功能相反,但二者调节平衡对于过量血栓清除至关重要。组织型纤溶酶原激活物表达明显下调,可使纤溶系统受损,导致纤维蛋白过量沉积、微血栓形成、肠灌注减少和肠壁缺血明显加重,发生肠坏死、肠穿孔风险增加。(3)乳脂球表皮生长因子8(MFG-E8)表达下调:MFG-E8主要参与维持肠上皮细胞完整和损伤细胞修复。NEC患儿肠道MFGE8表达明显下调,导致肠道上皮损伤、肠细胞迁移受损、黏膜再生不足,肠组织坏死加重,甚至穿孔。所以,对于NEC患儿应定期复查凝血功能,尤其当合并凝血功能障碍时,同时需监测患儿消化道症状和腹部影像学检查,早期干预纠正凝血功能障碍,尽可能降低发生肠穿孔的风险。
低钾血症是NEC伴发肠穿孔的独立危险因素。新生儿低钾血症指血浆[K+]<3.5 mmol/L,引起低钾血症最主要的原因是胃肠功能紊乱,如呕吐、腹泻、禁食、胃肠减压等引起消化液大量丢失[18]。NEC患儿由于长时间禁食,部分患儿还予以胃肠减压治疗,引起钾离子持续性丢失,容易并发低钾血症[19]。当NEC合并低钾血症时,胃肠道平滑肌兴奋性降低、收缩障碍、肠肌麻痹,导致肠蠕动功能明显减弱甚至消失、腹胀加重,部分患儿还可出现肠梗阻。而腹胀、肠蠕动差、肠梗阻使肠道血液循环障碍、肠壁组织缺血加重、肠黏膜上皮坏死脱落、肠壁通透性明显增加,则更易出现肠坏死和穿孔[20]。对于NEC患儿注意监测血钾指标,肠外营养液中注意补充适量钾,尽量避免低钾血症发生。
研究表明,及时掌握NEC伴发肠穿孔的手术指征,可有效改善患儿的预后[4]。目前对于NEC伴发肠穿孔的判断主要参考临床症状、体征及腹部影像学资料(如腹部平片、B超等),但不同研究中上述依据的诊断价值层次不齐[12,21]。目前对于NEC伴发肠穿孔的诊断,仍面临巨大挑战。本研究将结果所示的独立危险因素(NEC并发败血症、凝血功能障碍及低钾血症)对NEC伴发肠穿孔进行预测分析,发现败血症、低钾血症联合凝血功能障碍对NEC伴发肠穿孔具有较高的预测价值,其特异性和灵敏性分别为79.2%、81.8%。在今后的临床工作中,笔者认为此预测模型可为判断NEC伴发肠穿孔提供参考,从而及时进行相应的手术治疗。
综上所述,NEC并发败血症、凝血功能障碍、低钾血症是NEC伴发肠穿孔的独立危险因素,而高胎龄为其保护性因素。所以临床上对于低胎龄NEC患儿,尤其是合并败血症、凝血功能障碍、低钾血症等情况下,需高度警惕发生肠穿孔可能,早期识别并采取相应干预措施改善患儿预后。但本研究属于儿童专科医院的回顾性研究,且样本量有限,对围产期资料采集有限,故需多中心、大样本、多学科前瞻性的队列研究进一步验证。

