α7nAChR-HDAC6通路在右美托咪啶降低幼鼠七氟烷神经毒性中的作用
朱敏,于洪丽,孙英,杜洪印,喻文立
(南开大学附属天津市第一中心医院麻醉科,天津300192)
婴幼儿接受麻醉,特别是生长发育爆发期(3个月~2岁),神经系统容易遭到外界刺激伤害,导致成年后相关神经系统并发症[1-2]。研究发现,新生大鼠七氟烷暴露可导致幼鼠前额叶皮层NMDA受体亚基组成发生变化,引起神经元退行性变以及成年后学习记忆受损[3]。右美托咪啶作为特异性更强的α2受体激动剂,具有独特镇静、镇痛及“交感切除”特点,广泛应用临床[4]。Dahmani等[5]发现,右美托咪啶减少神经元死亡及凋亡效应器caspase-3表达,可能与激活α2受体,促进灶性黏附激酶表达相关。课题前期发现右美托咪啶能够降低七氟烷麻醉小儿术后谵妄发生率及术后恶心、呕吐,但具体机制并未清楚。Wang等[7]发现幼鼠七氟烷暴露导致血清中炎性因子表达显著增加[6]。α7烟碱型乙酰胆碱受体(α7nicotinic acetylcholine receptor,α7nAChR)为基础的“胆碱能抗炎通路”可作用于免疫细胞,抑制炎症因子释放;Hui等[8]发现右美托咪啶预处理能够增加神经迷走系统活性,而切断迷走神经以及应用α7nAChR受体拮抗剂可降低右美托咪啶抑制炎症反应。因此本研究旨在探讨α7nAChR相关胆碱能通路在右美托咪啶降低小儿七氟烷暴露神经损伤中的作用。
1 材料与方法
1.1 实验动物与分组 7 d龄Sprague-Dawle(SD)幼鼠(中国人民解放军军事医学科学院提供),采取随机数字表法分为5组(n=40):空白对照组(C组),七氟烷麻醉组(S组),右美托咪啶对照组(D组),七氟烷+右美托咪啶组(SD组),七氟烷+右美托咪啶+抑制剂MLA组(M组)。
1.2 动物模型的构建 将幼鼠置于3%七氟烷,以100%氧气为载体,气体流量4 L/min的培养箱2 h,连续3 d构建七氟烷模型。C组幼鼠置入培养箱前腹腔注射等体积生理盐水;D组、SD组和M组腹腔注射25 μg/kg右美托咪啶;M组提前30 min注射3 mg/kg MLA,其余同前。麻醉过程中采用气体监测仪(Drager,Lubeck,Germany)检测麻醉箱内氧气、二氧化碳、以及七氟烷浓度。
1.3 ELISA法检测促炎因子和脑损伤标志物 灌注后断头取脑加入生理盐水,4℃匀浆离心,收取上清液,采用ELISA试剂盒检测脑组织促炎因子TNF-α、IL1β 和 IL-6,脑损伤标志物 S-100β 和NSE水平。具体实验步骤参见说明书,最后计算得出相应因子浓度。
1.4 尼式染色检测神经元存活情况 灌注后断头取脑,制备海马区冠状石蜡切片,厚度约10 μm,加温脱蜡后无水乙醇浸泡,滴加尼式染色液,蒸馏水洗涤后脱水封片。采用BX-51光学显微镜观察并照相,随机选取CA1区连续不重叠视野,Image Pro Plus 6.0图像分析软件对神经元计数,取5个视野的平均值做统计分析。
1.5 Western印迹法检测α7nAChR和HDAC6蛋白表达 断头取脑,游离幼鼠海马组织,预冷组织蛋白裂解液匀浆,4℃ 12 000 r/min离心10 min,取上清为组织蛋白。成功提取蛋白进行定量检测,将等量蛋白煮沸变性,经转膜封闭洗涤等步骤后分别加入一抗α7nAChR和HDAC6抗体和β-actin抗体,4℃过夜清洗,二抗室温孵育,曝光,扫描,采用Gene Tools图像分析软件测定条带灰度值,以目的条带灰度值与β-actin灰度值反映目的蛋白的表达情况。
1.6 Y迷宫实验检测幼鼠认知水平 41 d幼鼠进行Y迷宫实验,Y迷宫随机分为起始臂(S臂),新异臂(N臂)和其他臂(O臂),N臂内壁贴上不同图形以作区别。采用Any-maze视频软件追踪分析系统,记录此时间段内大鼠在各臂的穿梭次数和停留时间,计算大鼠在N臂停留时间的比例,评价幼鼠空间识别记忆能力。
1.7 统计学分析 采用SPSS20.0统计软件包进行数据处理,计量资料以x±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组促炎因子和脑损伤因子表达水平 与C组相比,S组、SD组和M组脑组织促炎因子TNF-α、IL1β、IL-6和脑损伤因子S-100β、NSE表达明显增加(均P<0.05);与S组相比,SD组和M组相关因子表达降低(均P<0.05);与SD组相比,M组相关指标增加(均P<0.05),见表 1。
2.2 各组幼鼠海马CA1区神经元存活情况 与C组相比,S组、SD组和M组幼鼠海马CA1区神经元排列稀疏,存活神经元数目明显降低,差异具有统计学意义(均P<0.05);与S组相比,SD组和M组幼鼠海马CA1区神经元排列稀疏程度改善,存活神经元数目明显增加(均P<0.05);与SD组相比,M组幼鼠海马CA1区神经元排列稀疏程度降低,存活神经元数目明显降低(P<0.05),见图1和表2。

表1 各组幼鼠炎症因子和脑损伤因子表达情况统计(x±s)Tab 1 Expression of inflammatory cytokines and brain injury factors in each group(x±s)
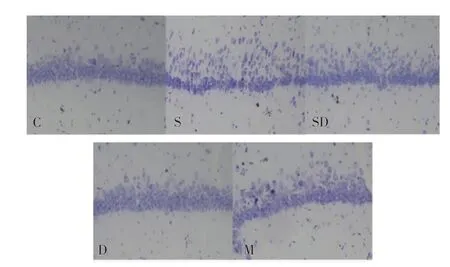
图1 各组幼鼠海马CA1区神经元尼氏染色镜下存活情况(400×)Fig 1 Survival neurons in hippocampal CA1 area with Nissl staining of each group(400×)

表2 各组幼鼠海马CA1区神经元存活情况比较(x±s)Tab 2 Comparison of survival neurons in hippocampal CA1 area of each group(x±s)
2.3 各组幼鼠海马组织α7nAChR和HDAC6蛋白表达情况比较 与C组相比,S组、SD组和M组幼鼠海马组织α7nACh表达降低,HDAC6增加(均P<0.05);与S组相比,SD组和M组α7nAChR表达增加,HDAC6减少(均P<0.05);与SD组相比,M组α7nAChR表达降低,HDAC6增加(均P<0.05),见图2和表3。

图2 各组幼鼠海马组织α 7nAChR和HADC6蛋白表达Fig 2 Expression of α 7nAChR and HDAC6 in hippocampus of each group

表3 各组幼鼠海马组织α7nAChR和HADC6蛋白(%con组)表达统计(x±s)Tab 3 Expression of α7nAChR and HADC6(%con group)in hippocampus of each group(x±s)
2.4 各组幼鼠新异臂停留时间比较 与C组相比,S组、SD组和M组幼鼠新异臂停留时间比例明显降低,差异具有统计学意义(均P<0.05);与S组相比,SD组和M组幼鼠新异臂停留时间比例显著增加(均P<0.05);与D组相比,M组幼鼠新异臂停留时间降低(P<0.05),见表 4。
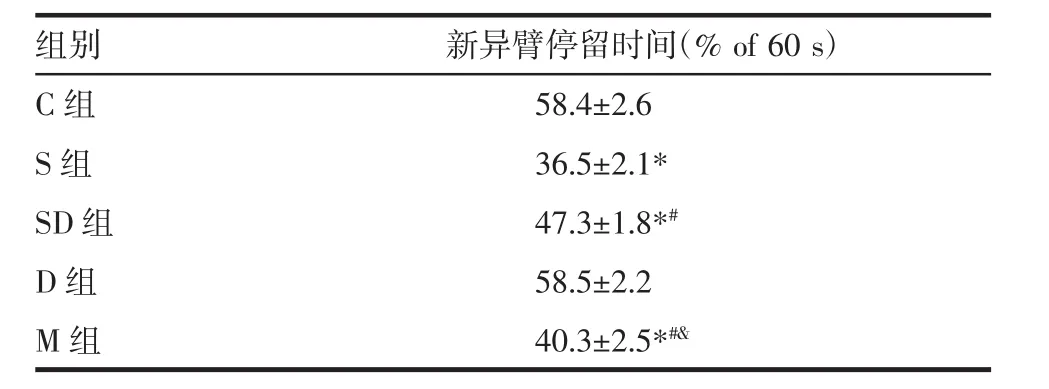
表4 各组幼鼠新异臂停留时间比较(x±s)Tab 4 Comparison of time in N arm(%of 60 s)in each group(x±s)
3 讨论
婴幼儿处于大脑神经网络系统形成的关键时期[1],特别是处于生长发育爆发期时,更容易遭受外界如手术麻醉等刺激伤害,进而导致成年相关神经系统并发症。Wilder等[9]临床研究表明,年龄小于3岁、接受多次麻醉暴露或者麻醉时间超过3 h的患儿,其在成年后学习能力明显低于正常年龄段小儿。七氟烷因其血气分配系数低,呼吸道刺激弱,便于快速诱导和苏醒,广泛应用于小儿临床麻醉[10]。研究发现学龄前儿童实施七氟烷麻醉可显著增加术后谵妄的发生率[11]。动物实验发现七氟烷暴露导致幼鼠神经元细胞发生内质网应激、线粒体功能障碍、神经炎症以及神经突触发生障碍等相关变化,可能导致远期认知障碍,但具体机制并未完全清楚[12]。因此,探究幼鼠七氟烷麻醉暴露所致神经损伤及远期认知功能障碍的机制以及保护措施具有重要的意义。
神经炎症在幼鼠七氟烷麻醉暴露所致神经损伤中扮演着重要作用。Wang等[7]发现幼鼠暴露于4.1%七氟烷6 h可激活NF-κB通路增加血清IL-6和TNF-α表达。C57出生6 d小鼠暴露3%七氟烷2 h,连续3 d导致其远期认知功能水平下降,其机制与神经炎性相关[13]。本研究发现幼鼠七氟烷暴露可导致脑组织促炎因子TNF-α、IL-1β和IL-6和脑损伤因子表达显著增加。研究表明,α7nAChR介导的胆碱能抗炎通路是神经免疫细胞发挥抗炎作用的重要机制[14]。右美托咪啶作为特异性α2受体激动剂能够增加迷走神经活性,改善内毒素动物炎性模型愈后。本研究发现七氟烷暴露导致α7nAChR表达下降,而右美托咪啶处理可显著增加α7nAChR表达,提升迷走神经活性,抑制促炎因子释放,发挥抗炎保护作用。
HDAC6是唯一催化多种胞浆蛋白而非组蛋白的去乙酰化酶,主要表达于神经元胞浆,参与神经系统轴突运输、突触传递、神经炎症等生物学反应[15]。Akimova等[16]发现抑制HDAC6表达可增加Foxp3表达及乙酰化水平,促进Treg细胞抑制炎症反应。神经发育期幼鼠多次七氟烷暴露可导致HDAC6表达及活性增加,并介导神经突触限制性发育及影响成年大鼠认知行为能力[17]。而α7nAChR蛋白激活可显著抑制HDAC6表达及生物活性,有效改善神经突触可塑性及认知水平[18]。本研究结果表明七氟烷暴露可增加幼鼠海马组织HDAC6蛋白表达,而右美托咪啶可以显著降低HDAC6表达;同时α7nAChR受体拮抗剂MLA可有效逆转右美托咪啶介导的HDAC6抑制作用,降低抗炎作用。
综上所述,右美托咪啶降低七氟烷麻醉暴露所致胆碱能抑制作用,增加胆碱能受体α7nAChR表达,抑制组蛋白去乙酰化酶HDAC6表达,进而抑制七氟烷神经炎症毒性反应及神经发育障碍作用,发挥神经保护。

