HP1α(CBX5)对前列腺癌细胞迁移、侵袭和增殖影响的研究
张泗扬,徐勇
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211)
前列腺癌是欧美男性最常见的恶性肿瘤之一,据统计其发病率位居男性恶性肿瘤首位,死亡率仅次于肺癌[1],同时也是最常见的引起男性与癌症相关死亡的主要原因[2]。近年来随着普查手段及健康体检技术的普及,前列腺癌的发病率也呈现上升趋势[3]。据报道,HP1α是一种在细胞核内介导癌症相关过程的蛋白质,它参与基因沉默的表观遗传调控[4]。然而,最近有研究证实,HP1α在细胞分化过程中也能激活基因表达并参与染色质堆积和表观遗传的基因调控[5-6]。HP1蛋白在人类男性前列腺发育过程中存在差异性调节[7]。有研究表明,HP1α是AR共激活因子,在AR信号的反式激活中起关键作用,并能促进前列腺癌细胞的增殖[8]。目前有研究表明,胃癌中HP1α表达上调,且HP1α的表达与miR-758-3p的表达水平呈负相关,体外实验还发现miR-758-3p通过靶向HP1α的表达来调控胃癌细胞的行为[9]。有报道称HP1α和HP1β已被证明与组织特异性转录因子MyoD相互作用,并抑制其转录活性和肌肉末端分化[10]。上皮-间充质转化(EMT)是前列腺癌的侵袭和迁移中的关键环节,是指上皮细胞在特定的生理和病理情况下向间充质细胞转分化的现象,这一概念是Greenberg[11]在1982年提出的,他发现晶状体上皮细胞在胶原凝胶中可以形成伪足,转变为间质细胞样形态。其后陆续有报道很多物种的原肠胚形成、神经嵴细胞迁移形成神经管,心瓣膜、颅面结构以及肌肉骨骼系统的形成都有赖于EMT[12]。近年来,EMT在前列腺癌中的研究越来越多,同时其作为一种新的理念来诠释前列腺癌的侵袭、转移等生物学行为而受到广泛关注。在前列腺癌的发展进程中,通过与周围微环境发生作用,然后经过EMT使细胞极性发生改变,由上皮细胞向间质细胞转化,从而使肿瘤细胞更容易向骨骼、脑等远处器官转移。上皮向间质的转化可以影响肿瘤的性质[13],此外,EMT相关因子还可通过金属蛋白酶破坏基底膜促进细胞的侵袭能力[14]。神经内分泌型前列腺癌(NEPC)是一种目前无法治愈的致死性前列腺癌亚型,可在持续的激素治疗后发展而来。不幸的是,针对NEPC可用的治疗方案很少,迫切需要更有效的治疗方案来应对。前列腺癌转移性疾病是导致患者死亡的主要原因,EMT在转移性去势抵抗性前列腺癌(mCRPC)的发展过程中发挥着关键作用[15]。加拿大英属哥伦比亚大学的温哥华前列腺中心的王玉琢教授所领导的研究团队,开发了最新NEPC临床前期模型(PDX模型)[16],为研究NEPC的进展提供了前所未有的准确性。使用该模型和先进的基因表达分析方法,该团队发现HP1α在NEPC发生、发展的早期就已经稳定表达,且在NEPC发展过程中持续升高。该团队后又证实在NCI-H660 NEPC细胞中沉默HP1α后,可抑制增殖,抑制集落形成,诱导细胞死亡,最终导致肿瘤生长停滞。鉴于HP1α在前列腺癌中鲜有报道,并在前列腺癌进展过程中发挥着关键作用,本研究拟将其作为前列腺癌侵袭转移的进展过程中的关键蛋白进行研究。
1 材料和方法
1.1 细胞培养及组织 人前列腺癌细胞系LNCaP、C4-2、PC3、DU145和良性前列腺增生细胞系BHP-1均由天津市泌尿外科研究所冻存、复苏培养,LNCaP和C4-2为依赖雄激素的前列腺癌细胞系,PC3是不依赖雄激素的前列腺癌骨转移的细胞系,DU145则是不依赖雄激素的前列腺癌脑转移的细胞系,BPH-1是良性前列腺增生细胞。采用含10%的胎牛血清(FBS)的RPMI-1640培养液在37℃ 5%CO2条件下培养各细胞系。征得天津医科大学第二医院伦理委员会的同意后,在医院病理科收集2015—2018年的前列腺癌组织和前列腺增生组织的病例蜡块各38例,将蜡块重新切片后进行免疫组化染色(IHC)处理。病理组织纳入标准:(1)前列腺癌病理蜡块:患者首先行前列腺穿刺活检术,然后确诊前列腺癌,同时术前、术后均未行任何形式的内分泌、放化疗等其他治疗,并且前列腺癌患者自身无其他肿瘤患病史,术后的大病理也同样是前列腺癌。(2)良性前列腺增生病理蜡块:患者首先行经尿道前列腺电切术,术后确诊为良性前列腺增生。病理组织出现以下情况将不会采纳:(1)前列腺癌患者同时患有其他肿瘤。(2)良性前列腺增生的患者同时伴有前列腺上皮内瘤变。
1.2 免疫组织化学法检测 每张切片厚度为4 μm,脱蜡后将切片放于0.01 mol/L的pH为6.0~6.5的枸橼酸盐中,然后将切片放进微波炉中高火加热8 min进行抗原修复。再使用3%H2O2阻断内源性过氧化物酶,使用正常山羊血清工作液封闭非特异性结合位点后,滴加稀释好的HP1α(1:100)抗体,4℃过夜。滴加生物素标记的二抗,室温孵育15 min,用PBS洗后,滴加辣根过氧化物酶标记的链卵白素,室温孵育15 min,DAB显色及苏木素复染,最后脱水封片。
1.3 实时定量PCR(qRT-PCR) 实验首先使用HP1α的特异性siRNA对前列腺癌细胞LNCaP和PC3进行敲低处理,然后使用TRIzol试剂(Invitrogen,Carlsbad,CA)从前列腺癌细胞LNCaP和PC3的si-NC组和si-HP1α组中分别提取总RNA,再使用Hi-FiScript反转录试剂盒将配好的试剂置于反转录机器中,设定参数,进行反转录合成cDNA。将配制好的混合液体,用无酶枪头加入48孔板,再放入已经提前预热好的qPCR机器中,设定参数,观察qPCR的熔解曲线和扩增曲线,计算实验数据,最后用GraphPad软件进行柱状图量化分析结果。
1.4 Western印迹实验 首先使用HP1α的特异性siRNA对前列腺癌细胞LNCaP和PC3进行敲低处理,然后对前列腺癌细胞LNCaP和PC3的si-NC组和si-HP1α组分别进行贴壁细胞总蛋白的提取,通过BCA法测定蛋白质浓度,再进行聚丙烯酰胺凝胶电泳,最后,采用ECL化学发光法对蛋白条带进行成像处理。
1.5 细胞转染 siRNA设计HP1α的特异性siRNA对HP1α进行敲低,首先进行细胞6孔板铺板,次日显微镜下观察6孔板中细胞是否铺匀,细胞量达到50%左右,将罗氏转染试剂与针对HP1α的特异性siRNA以1∶2的比例配比,然后用无菌的Optim转染溶液定容到515 mL,并且加入到一个孔中,并加入无双抗的培养基定容到2 mL。轻轻震荡6孔板并放入细胞培养箱中,6 h后进行换液处理。将混有转染试剂的培养液吸出,并添加新的完全培养基,再将6孔板放入细胞培养箱中进行正常培养即可。待细胞长满48 h,就可以进行转染siRNA后的细胞蛋白以及RNA提取和进行相关的生物学行为验证实验。
1.6 CCK-8增殖实验 细胞增殖采用CCK-8试剂进行检测,首先使用HP1α的特异性siRNA对前列腺癌细胞LNCaP和PC3进行敲低处理,然后将前列腺癌细胞LNCaP和PC3的si-NC组和si-HP1α组细胞分别进行铺板,每组6孔,饥饿过夜,然后采用10%血清培养基在37℃、5%CO2条件下培养,分别于接种24、48、72 h后在450 nm进行吸光度检测,绘制细胞生长曲线。
1.7 集落形成实验 首先使用HP1α的特异性siRNA对前列腺癌细胞LNCaP和PC3进行敲低处理,然后将前列腺癌细胞LNCaP和PC3的si-NC组和si-HP1α组的细胞悬液反复吹打,使细胞充分分散,细胞记数,并用培养基调节细胞浓度,按照每皿含50、100、200个细胞的浓度分别接种5 mL细胞悬液到培养皿中,以十字方向轻轻晃动培养皿,使细胞分散均匀。培养皿置37℃、5%CO2中培养2~3周,中间根据培养液pH变化适时更换新鲜培养液。当培养皿中出现肉眼可见克隆时,终止培养,弃去培养液,PBS液小心浸洗2次。甲醇固定15 min,弃甲醇后用DAPI染液染色10 min,PBS缓慢洗去染液,拍照记录实验结果。
1.8 细胞侵袭及迁移实验 首先使用HP1α的特异性siRNA对前列腺癌细胞LNCaP和PC3进行敲低处理,然后采用孔径为8.0 μm的transwell小室,对前列腺癌细胞LNCaP和PC3的si-NC组和si-HP1α组的细胞分别进行体外迁移和侵袭测定。进行侵袭实验时,将密度为6×104/200 μL的细胞接种在无血清培养基中,在室加入50 μL的基质胶,而600 μL含有10%血清的1640培养基加入下腔室。24 h后,对通过膜的细胞用DAPI染色,并在荧光显微镜下计数细胞数。随机选取5个视野进行计数并做统计分析[17]。对于迁移实验,除了不加入基质胶外,操作流程与侵袭实验相同。
1.9 统计学处理 采用SPSS22用于统计分析。研究中所有实验至少进行3次。所有数据均表示为x±s。选用t检验用于比较两组之间的差异。多组样本均数的比较采用One-way ANOVA(单因素方差分析),P<0.05表示在统计学上具有显著差异。
2 结果
2.1 TCGA数据库显示HP1α在前列腺癌样本中的表达高于正常前列腺 为了明确HP1α是否对前列腺癌的发生或发展产生影响,首先使用TCGA数据库对HP1α在前列腺癌中的表达进行了预测,结果证实HP1α在前列腺癌样本中的表达高于正常前列腺样本(图1A),且HP1α与前列腺癌的无疾病生存期密切相关(图1B),结果显示,HP1α的表达越高,前列腺癌患者的无疾病生存期越短(P<0.05),而HP1α的表达水平与患者总生存期不具有统计学意义(P>0.05,图 1C)。

图1 HP1α的表达在TCGA数据库中的情况Fig 1 Expression of HP1α in the TCGA database

图2 IHC和Western印迹验证HP1α的表达Fig 2 IHC and Western blot verified the expression of HP1α
2.2 IHC验证生物信息学的分析结果 为了检验生物信息学预测结果,对38例前列腺癌和良性前列腺增生的病理组织切片进行IHC染色分析,发现相较于良性前列腺增生组织,前列腺癌病理组织切片中HP1α的表达阳性率显著增加,如图2A所示。然后对前列腺癌和良性前列腺增生组织提取蛋白进行Western印迹实验检测HP1α的表达水平,结果证实在前列腺癌组织中HP1α的表达高于前列腺增生组织(图2B)。
2.3 HP1α在4种前列腺癌细胞系中高表达 为了进一步了解HP1α在前列腺癌中的作用,选用了4种不同的前列腺癌细胞系(LNCaP、DU145、PC3、C4-2)和一种良性前列腺增生细胞系(BPH-1)来验证它的表达水平。结果表明HP1α在C4-2和LNCaP中表达量均较高,PC3和DU145次之,而在良性前列腺增生细胞中表达量最低(图3)。
2.4 验证特异性siRNA对HP1α的敲低效率 由于迁移和侵袭是研究中一项重要的观察指标,考虑到LNCaP是前列腺癌淋巴结转移类型的细胞,PC3是前列腺癌骨转移类型的细胞,且这两种细胞系表达量均较高,故选择LNCaP和PC3作为主要的细胞系进行研究。使用特异性siRNA分别在LNCaP和PC3细胞系中对HP1α进行敲低,并且在蛋白水平及mRNA水平上分别检测敲低效率。结果表明,在LNCaP和PC3这两种细胞系中,HP1α均达到理想的敲低效果(图4)。
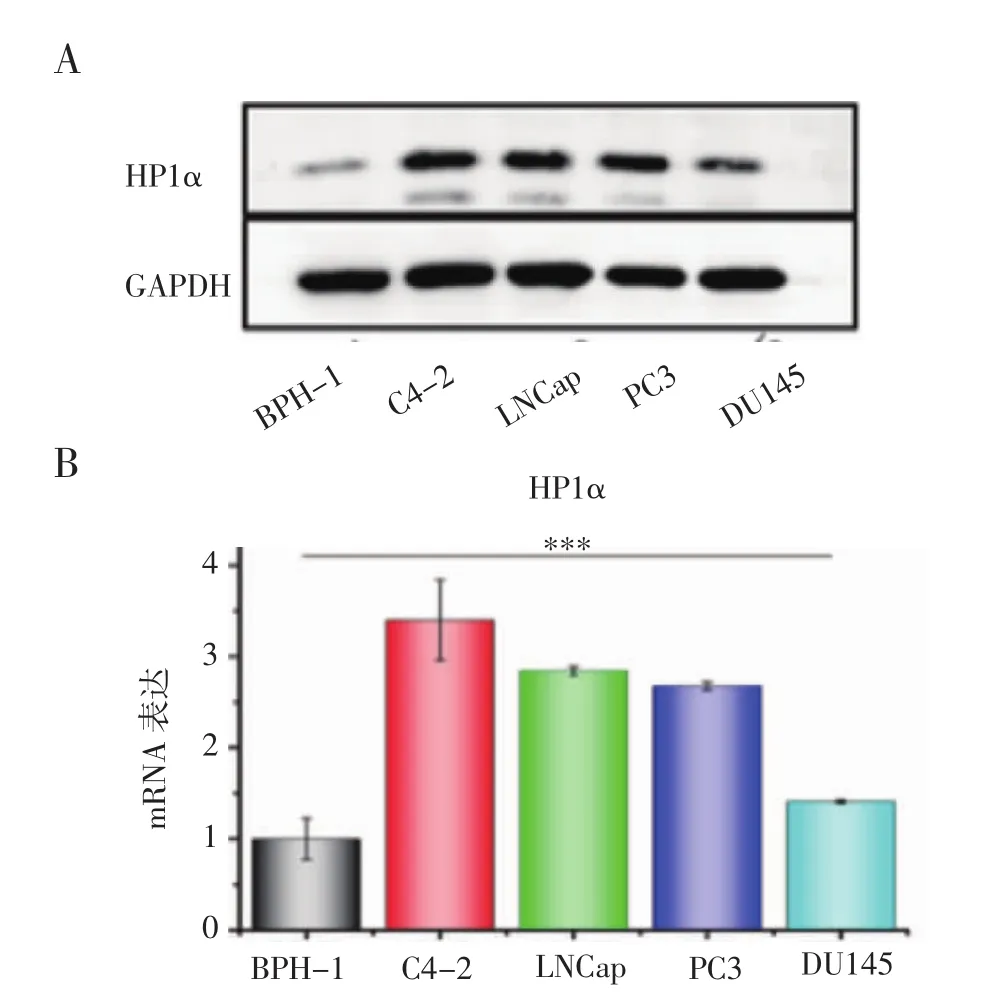
图3 HP1α在4种前列腺癌细胞系和良性前列腺增生细胞系中的表达Fig 3 Expression of HP1α in four prostate cancer cell lines and benign prostatic hyperplasia cell lines

图4 特异性siRNA对HP1α的敲低效率Fig 4 The knockdown efficiency of HP1α siRNA
2.5 敲低HP1α能够有效抑制前列腺癌细胞的迁移和侵袭 选用Transwell实验来观察HP1α被敲低后的前列腺癌细胞的迁移和侵袭能力,从而评价HP1α的生物学功能。Transwell结果表明,HP1α被敲低的LNCaP和PC3细胞均发生了细胞迁移和侵袭能力的降低(图5)。
2.6 敲低HP1α能够有效抑制前列腺癌细胞的增殖 采用CCK-8和集落形成实验来检测细胞的增殖能力,首先选用LNCaP和PC3细胞系敲低HP1α,分别在24、48及72 h通过CCK-8实验对细胞数量进行检测,发现实验组(si-HP1α)细胞的增殖相较于对照组(si-NC)逐渐减弱,实验结果表明LNCaP和PC3细胞系在HP1α敲低后其增殖能力明显减低。之后又采用集落形成实验来再次验证敲低HP1α对细胞增殖的影响,结果显示,敲低HP1α后LNCaP和PC3细胞的增殖能力显著降低(图6)。

图5 敲低HP1α后前列腺癌细胞LNCaP和PC3的迁移和侵袭能力的改变Fig 5 Changes in LNCaP and PC3 cell migration and invasion capacity after knockdown of HP1α

图6 HP1α敲低后前列腺癌细胞增殖能力的改变Fig 6 Changes in cell proliferation after HP1α knockdown
2.7 HP1α促进前列腺癌的EMT能力 EMT在前列腺癌的迁移和侵袭中起到重要的作用,选择E-cadherin、N-cadherin、Vimentin(波形蛋白)、Twist1、Snail1和Zeb1来作为EMT的评价指标。Western印迹结果显示PC3和LNCaP细胞中HP1α被敲低后E-cadherin的表达增加,而其余指标均明显降低(图7)。实验结果表明敲低HP1α能够减弱前列腺癌的EMT能力。

图7 HP1α对前列腺癌的上皮-间充质转化能力的影响Fig 7 Effects of HP1α on the epithelial-mesenchymal transition in prostate cancer
3 讨论
前列腺癌在最初阶段的症状比较隐蔽,随着时间的推移逐渐发展为去势抵抗性前列腺癌并多伴转移癌,此时前列腺癌的治疗手段就相对较少,患者的生存期也会受到极大影响。因此,对于前列腺癌发生、发展机制的研究迫在眉睫,需要全力研究探索,旨在找到前列腺癌的治疗靶点,为前列腺癌的治疗提供新的方向。本研究中HP1α在很多肿瘤中都扮演着很重要的作用,是一种普遍存在的调节细胞周期和增殖[18]、凋亡[19]和兴奋性毒性神经变性[20]等细胞功能的蛋白质。需要指出的是,有研究已表明mH2A1.2能够直接与HP1α相互作用,使前列腺癌细胞中的LTβ基因失活[21]。
基于以上的分析,考察了HP1α对前列腺癌细胞系(C4-2、LNCaP、PC 以及 DU145)增殖的影响。从当前的研究来看,HP1α在前列腺癌细胞系中的表达高于良性前列腺增生细胞系,除此之外,笔者还注意到HP1α在C4-2和LNCaP中高度表达。当在LNCaP和PC3细胞系中敲低HP1α时,发现前列腺癌细胞系的迁移、侵袭和增殖能力均发生降低。而在HP1α被敲低后,E-cadherin的表达增加,其他EMT检测指标N-cadherin、Vimentin(波形蛋白)、Twist1、Snail1和Zeb1均明显降低。然而,关于HP1α具体影响前列腺癌进展的机制尚不清楚,还需要进一步研究。
总体来说,现有的数据证实了HP1α在C4-2、LNCaP、PC3和DU145前列腺癌细胞系中高度表达,在一定程度上可以促进前列腺癌的发生和发展,并能增强前列腺癌的EMT能力,这些实验结果均表明,HP1α可以为提高临床病例诊断水平和为前列腺癌肿瘤靶向治疗提供新思路。

