胰岛素治疗对糖尿病大鼠阴茎组织中miR-126、VEGF、eNOS表达的影响
胡睿,张威,欧宁静,梁震,杨永姣,刘莉,刘晓强
(1.天津医科大学总医院泌尿外科,天津300052;2.天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津 300211)
糖尿病是人类常见的慢性疾病,我国成年人的糖尿病发病率约为10.9%,世界卫生组织预计2025年全世界的糖尿病人数将达到3.0亿左右,国际糖尿病联盟估计2035年全世界的糖尿病人数可能增至5.9亿,2045年约为6.9亿,糖尿病发病率呈逐年上升趋势[1-4]。糖尿病严重影响机体代谢,并导致神经血管功能损害,进而出现多种并发症[5]。糖尿病的血管并发症主要包括糖尿病肾病、糖尿病视网膜病变、糖尿病下肢缺血及糖尿病性心脏病等,血管内皮功能障碍是糖尿病血管并发症治疗和预防的关键[6-7]。糖尿病性勃起功能障碍(DMED)是一种常见的糖尿病并发症,其在30岁男性糖尿病患者中的发病率约为15%,而在60岁男性糖尿病患者中上升至55%,高达75%的男性糖尿病患者受到DMED的影响[8]。多项研究表明,链脲佐菌素(STZ)可用于建立糖尿病大鼠模型,大鼠成模后8周可发生勃起功能障碍(ED),控制血糖可能通过改善血管内皮功能障碍,从而治疗DMED[9-11]。但是,胰岛素改善DMED大鼠血管内皮功能障碍的具体机制尚未阐明,还需要进一步探索。
内皮型一氧化氮合酶(eNOS)是血管内皮细胞内一氧化氮合成的关键酶,后者在维持血管稳态中发挥作用,是调节血管内皮细胞功能的重要因子[12]。eNOS还具有扩张血管、调节血管平滑肌功能及抑制氧化应激等作用[13-14]。血管内皮生长因子(VEGF)对内皮细胞具有特异性,能促进血管内皮细胞增殖、迁移,在组织缺血、缺氧状态下发挥促血管生成作用,是最有效的促血管生成因子之一[15]。Micro RNA(miRNA)是一种由18~22个核苷酸组成的非编码小RNA分子,通过与mRNA的3′-UTR结合,对mRNA进行降解或翻译抑制,在转录后水平参与基因表达调节、细胞生长、迁移、凋亡等过程[16]。miRNA-126(miR-126)在血管内皮细胞中特异性表达,具有调控黏附分子表达、血管炎性反应、新生血管生成及维持血管结构完整的功能[17-18]。本研究采用胰岛素治疗糖尿病大鼠,观察治疗后糖尿病大鼠勃起功能的变化,比较大鼠阴茎海绵体中eNOS、VEGF及miR-126含量的差异,探究胰岛素治疗改善血管内皮细胞功能进而治疗DMED的作用机制。
1 材料与方法
1.1 实验动物 8周龄SD雄性大鼠30只,体重(280±25)g,均购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006,动物批号:1100111911034970。交配实验证实勃起功能正常。所有大鼠在SPF级环境下饲养,室内温度15~25℃,12 h光亮,12 h黑暗,自由进食及饮水。
1.2 主要仪器与试剂 STZ(Sigma),柠檬酸钠(Sigma),柠檬酸(Sigma),血糖试纸及血糖仪(罗氏公司),多聚甲醛(Sigma),兔抗大鼠VEGF抗体(Boster),兔抗大鼠 eNOS 抗体(BIOSS),小鼠单抗β-actin(武汉博士德生物工程有限公司),HRP标记羊抗小鼠二抗(武汉博士德生物工程有限公司),HRP标记羊抗兔二抗(武汉博士德生物工程有限公司),磷酸缓冲盐溶液(PBS,武汉博士德生物工程有限公司),实时荧光定量PCR仪(ABI),电转仪(北京六一仪器厂),酶标仪(Thermo),MedLab多通道生理记录仪(南京美易有限公司)。
1.3 建立糖尿病动物模型 30只大鼠适应性饲养1周后,选取20只建立糖尿病模型,剩余10只作为对照组(NC组)。禁食24 h后,按45 mg/kg左下腹腔单剂量注射STZ,72 h后测定尾静脉血糖,将血糖>16.7 mmol/L的大鼠确定为糖尿病大鼠。一共18只大鼠成模,成模率为90%。NC组同法注射等剂量0.1 mol/L柠檬酸-柠檬酸钠缓冲液,72 h后测血糖均正常。将成模大鼠随机分成糖尿病(DM组,n=9)和胰岛素组(Insulin组,n=9),Insulin组每日皮下注射1次长效胰岛素(诺和诺德公司),剂量为(10~20)U/kg,每日测量血糖,DM组同法注射等剂量PBS。NC组和DM组每周测1次血糖,所有大鼠每周测1次体重。
1.4 测定阴茎海绵体内压(ICP)与平均颈动脉压(MAP) 各组大鼠在胰岛素治疗8周后进行勃起功能检测,将大鼠腹腔注射戊巴比妥(30 mg/kg)麻醉并固定。作腹部正中切口,显露前列腺,于前列腺背外侧找到盆神经节后,将盆神经及阴茎海绵体神经分离出来。切开阴茎皮肤,暴露阴茎脚,同时充分暴露阴茎海绵体;于阴茎海绵体中部置入一枚充满肝素溶液的23G静脉输液针进行穿刺,输液针导管有回血,证明穿刺成功,固定输液针,另一端通过压力换能器连接MedLab多通道生理记录仪,准备测量ICP。然后游离并暴露右侧颈总动脉,结扎远心端并夹闭近心端后,并将充满肝素溶液的PE-50导管置入颈总动脉中,另一侧通过压力换能器连接MedLab多通道生理记录仪,以监测MAP。双极不锈钢电极勾住阴茎海绵体神经,将刺激参数设置为5 V,25 Hz,5 ms脉冲宽度和 60 s持续时间,进行电刺激,同时记录ICP和MAP,并在每只大鼠中记录最大ICP与MAP的比值(ICP/MAP)。
1.5 Western印迹检测大鼠阴茎海绵体组织中eNOS、VEGF的含量 将阴茎组织尽量剪碎,组织块置于匀浆器中,加入裂解液进行匀浆,裂解30 min后,将裂解液移至1.5 mL离心管中,离心取上清分装。BSA法进行蛋白浓度测定。将提取的蛋白上清与5×蛋白上样缓冲液进行沸水浴。配分离胶、浓缩胶,恒压120 V电泳分离后转膜(eNOS:200 mA、60 min;VEGF:200 mA、70 min),用含 5%脱脂奶粉的 TBST封闭,加入一抗(eNOS 1:1 000;VEGF 1:500;β-actin 1:500),4℃孵育过夜。洗去一抗,加入二抗后孵育2 h,洗去多余二抗,显色曝光,扫描胶片,用BandScan(Glyko公司)分析胶片灰度值,结果以 eNOS/β-actin、VEGF/β-actin 进行分析。
1.6 RT-PCR法检测大鼠阴茎海绵体组织中eNOS、VEGF、miR-126的表达 所有引物均由Invierogen公司设计合成。取-80℃冰箱中保存的阴茎海绵体组织研磨至粉末后,使用TRIzoI试剂提取总 RNA,以 Oligo(dT)18 为引物,逆转录 mRNA为cDNA。取逆转录产物4 μL加入实时荧光定量PCR反应体系。PCR反应条件:50℃ 2 min,95℃10 min;95℃ 30 s,60℃ 30 s,40 个循环。eNOS、VEGF以GAPDH作为内参校准基因,miR-126以U6作为内参校准基因。采用ABI公司的实时荧光定量PCR仪对扩增后的PCR产物进行荧光定量检测,绘制溶解曲线,最终数据以2-△△Ct进行分析,见表1。
1.7免疫组化检测阴茎组织中eNOS、VEGF的表达 新鲜阴茎海绵体组织经固定、包埋,石蜡块连续切片,常规脱蜡,电陶炉加热对切片进行抗原修复,3%过氧化氢去离子水孵育15 min,PBS冲洗3次,山羊血清室温封闭30 min。加一抗(1:100)后于4℃湿盒中孵育过夜(15 h);PBS冲洗切片3次,每次3 min,加二抗后室温孵育20 min;PBS冲洗切片4次,每次3 min,加显色剂;Harris苏木素复染30 s~1 min,水洗后用1%的盐酸酒精分化,再用自来水水洗返蓝;脱水,封片;显微镜下观察 eNOS、VEGF的表达分布,棕黄色染色为阳性。
1.8 统计学处理 计量资料数据以x±s表示,使用SPSS17.0统计软件对所有的实验数据进行统计学分析。计量资料采用两独立样本t检验,计数资料采用字2检验,P<0.05表示差异有统计学意义。

表1 引物序列Tab 1 Primer sequence

表2 各组大鼠血糖及体重测定结果(x±s)Tab 2 Blood glucose and body weight of rats in different groups(x±s)
2 结果
2.1 大鼠的血糖及体重变化 造模前,各组间血糖及体重无明显差异(P>0.05)。造模成功后(0周),DM组的血糖水平明显高于NC组(t=-10.924,P<0.001),Insulin组的血糖水平也明显高于NC组(t=-21.829,P<0.001);DM 组的体重较 NC 组显著降低(t=5.032,P<0.001),Insulin 组的体重也显著低于NC组(t=5.381,P<0.001)。胰岛素治疗8周后,Insulin组的血糖水平明显低于DM组(t=4.356,P<0.001),但较 NC 组高(t=-51.207,P<0.001);而Insulin组的体重较DM组显著增加(t=-10.481,P<0.001),但远未达到 NC 组水平(t=7.301,P<0.001),见表 2,图 1。
2.2 ICP/MAP评价勃起功能恢复 胰岛素治疗8周后,DM组的ICP[(38.44±3.58)mmHg]与NC组[(84.10±3.84)mmHg]相比,显著降低(t=26.826,P<0.001),Insulin组的ICP[(62.78±3.63)mmHg]较DM 组显著增加(t=-14.324,P<0.001),但不及 NC 组(t=12.391,P<0.001)。Insulin组的ICP/MAP[(0.523 1±0.030 3)]明显高于DM组[(0.320 4±0.029 6),t=-14.349,P<0.001],但未达到NC组水平[(0.700 8±0.032 1),t=12.364,P<0.001],见图 2。

图1 各组大鼠血糖及体重水平Fig 1 Bloodglucoseandbodyweightoftheratsindifferentgroups
2.3 Western印迹检测阴茎组织中eNOS、VEGF的蛋白表达量 胰岛素治疗8周后,DM组eNOS蛋白表达量(0.253 0±0.028 9)与 NC组(0.8535±0.062 5)相比,显著降低(t=6.629,P<0.001),DM 组VEGF蛋白表达量(0.248 4±0.005 0) 较 NC组(0.398 8±0.007 3)显著减少(t=52.055,P<0.001);Insulin组 eNOS蛋白表达量(0.323 8±0.012 0)与DM 组相比,显著升高(t=-6.786,P<0.001),VEGF 蛋白表达量也较 DM 组显著增加(t=-21.177,P<0.001),但均未达到NC组水平,见图3。
2.4 RT-PCR 检测阴茎组织中eNOS、VEGF、miR-126 mRNA的表达量 胰岛素治疗8周后,与NC组相比,DM 组 eNOS mRNA 表达量(0.697 8±0.029 7)、VEGF mRNA 表达量(0.532 7±0.032 6)、miR-126mRNA(0.507 2±0.064 2)表达量显著降低(t=30.513、43.057、23.030,均P<0.001);与 DM 组相比,Insulin 组eNOS mRNA 表达量(0.812 0±0.039 0)、VEGF mRNA表达量(0.653 3±0.029 5)、miR-126 mRNA 表达量(0.760 3±0.030 8)均显著升高(t=-6.994、-8.238、-10.665,均P<0.001),但均未达到 NC 组水平(均P<0.001),见图 4。
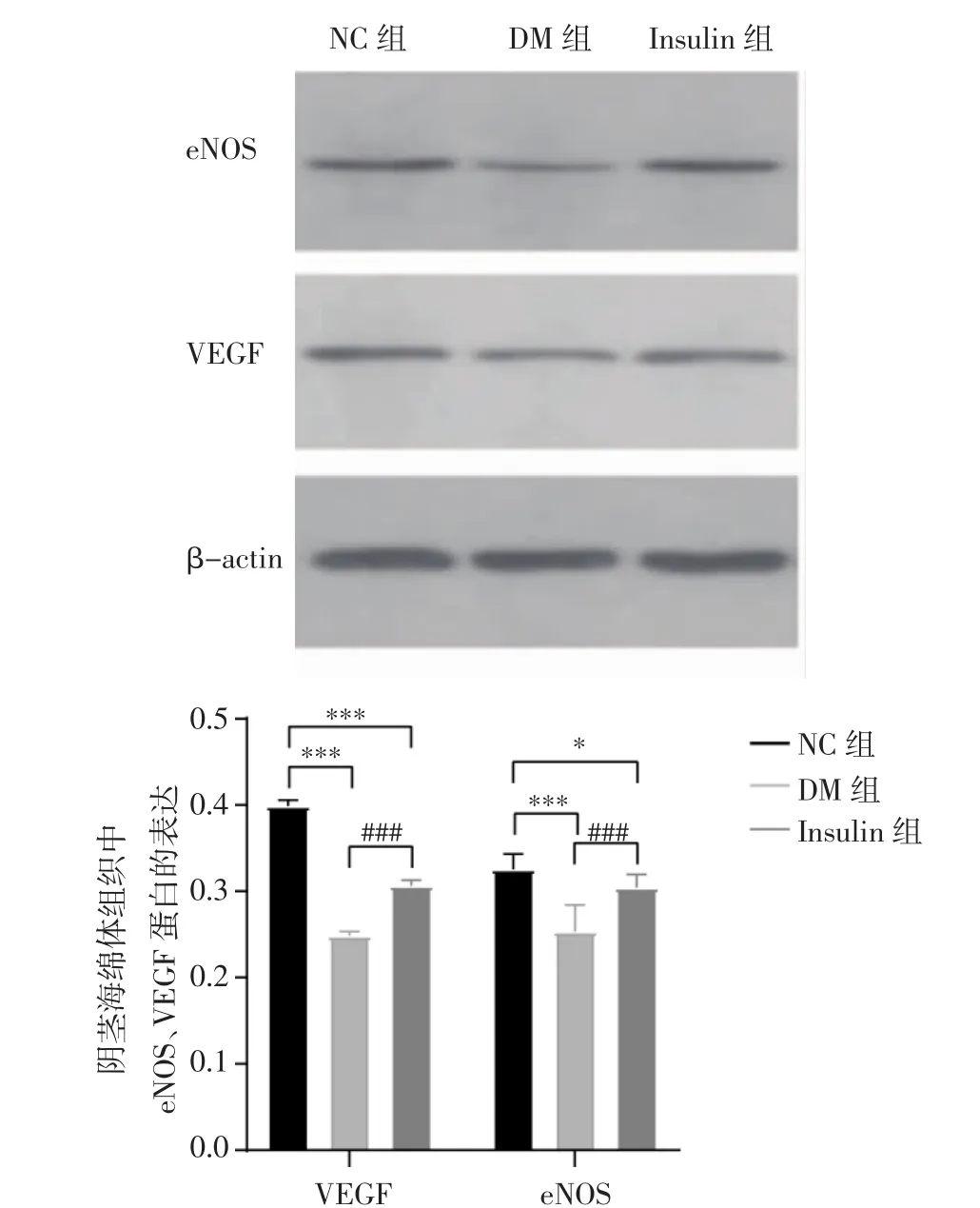
图3 各组大鼠阴茎海绵体组织中eNOS、VEGF蛋白的表达Fig 3 The protein expressions of eNOS and VEGF in the corpus cavernosal tissue of different groups of rats
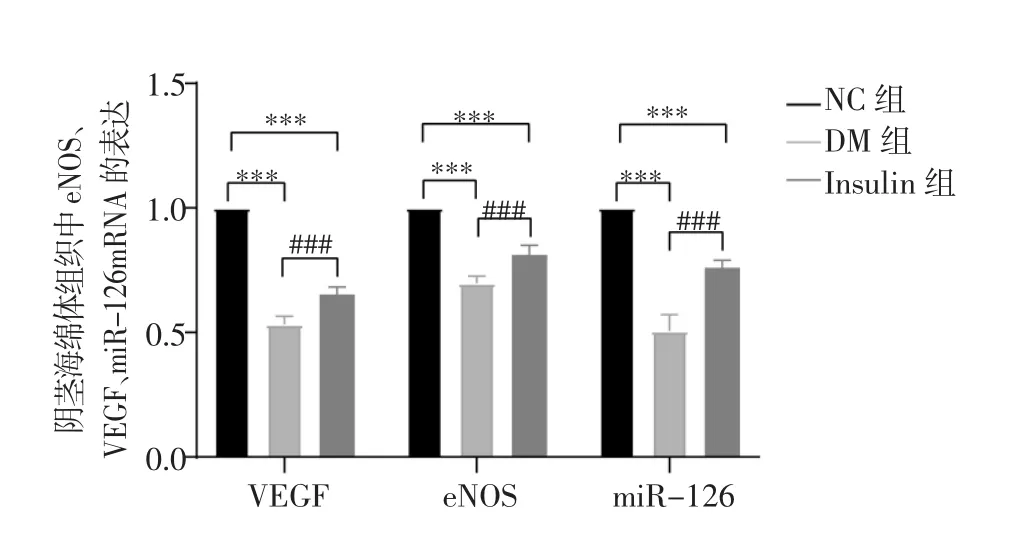
图4 各组大鼠阴茎海绵体组织中eNOS、VEGF、miR-126 mRNA的表达Fig 4 The mRNA expressions of eNOS,VEGF and miR-126 in the corpus cavernosal tissue of different groups of rats
2.5 免疫组化检测eNOS、VEGF的表达 eNOS、VEGF的表达位置主要在阴茎海绵体的海绵窦血管内皮细胞的细胞膜上(棕黄色即为阳性表达)。eNOS、VEGF在DM组、Insulin组阴茎海绵体组织中表达水平与NC组相比均减少,而在Insulin组阴茎海绵体组织中表达水平与DM组相比增加,见图5。

图5 eNOS、VEGF在各组大鼠阴茎海绵体组织中的表达(免疫组织化学染色,400×)Fig 5 Expressions of eNOS and VEGF in the corpus cavernosal tissue of different groups of rats(Immunohistochemical staining,400×)
3 讨论
阴茎勃起过程依赖于各种信号通路,其中,一氧化氮/cGMP通路是目前最为经典、研究最为深入的分子信号通路。一氧化氮合酶(NOS)对一氧化氮的合成在阴茎勃起中起到重要作用。目前研究发现,NOS 有 3 种亚型:eNOS、神经型 NOS(nNOS)、诱导型NOS(iNOS),其中eNOS和 nNOS在勃起中起主要作用[19-20]。ED是指男性不能持续获得和维持足够的阴茎勃起以完成满意的性生活[21]。糖尿病患者的ED发病率高达30%~70%,比非糖尿病患者高2~5倍[22]。随着糖尿病患者年龄增长和病程的延长,ED发生率会明显增加[23]。DMED的发病机制较复杂,包括神经血管等多方面的因素。糖尿病会引起晚期糖基化终末产物(AGEs)在阴茎海绵体中积聚,AGEs与细胞内的eNOS结合并且抑制其功能,从而使一氧化氮的合成下降,还会造成游离一氧化氮的灭活,导致阴茎勃起过程中主要神经递质的缺失[24]。此外,AGEs还可沉积在阴茎海绵窦血管内皮细胞中,增加血管通透性,损伤血管内皮,诱导细胞内的氧化应激反应,产生大量氧自由基,抑制VEGF等促血管再生因子的合成及功能[25-26]。Wang等[27]研究表明,糖尿病大鼠的ICP/MAP比正常大鼠显著降低,阴茎组织中AGEs沉积明显增加,但eNOS的合成显著减少,胰岛素干预能降低阴茎组织中AGEs沉积,增加eNOS的合成,改善血管内皮功能,从而治疗DMED。本研究采用注射STZ成功建立糖尿病模型,与NC组相比,DM组大鼠的血糖明显升高,体重及ICP/MAP显著降低,阴茎组织中eNOS的表达水平明显减少;而胰岛素治疗8周后,Insulin组大鼠的上述指标得到明显改善,但低于NC组正常水平。说明糖尿病可引起阴茎组织中eNOS合成减少,进而影响一氧化氮的合成,导致大鼠发生DMED;胰岛素治疗可增加eNOS表达量,从而治疗DMED,却不能恢复大鼠的勃起功能至正常水平。
微小RNA(microRNA)是一类内源性,长度约为20个核苷酸的单链非编码RNA,其在转录水平调节基因表达、RNA加工、翻译,并可以引导DNA合成或基因组重排[28-29]。microRNA可通过对部分基因表达调控,作用于阴茎勃起过程中一氧化氮/cGMP、RhoA/Rho激酶等通路,参与ED的病理生理机制,microRNA的潜在作用已成为DMED的研究热点[30]。miR-126在内皮细胞中大量表达,通过调节血管内皮生长因子途径的几个组成部分来维持内皮细胞的稳态和血管完整性[31]。本研究通过比较各组大鼠阴茎海绵体组织中VEGF、miR-126的表达水平,发现DM组的miR-126表达水平显著低于正常对照组,胰岛素治疗组明显高于DM组,miR-126可能参与调控VEGF在大鼠阴茎组织中的表达,在一氧化氮/cGMP信号转导通路中具有重要作用。因此,miR-126与VEGF之间是否具有调控关系,该调控关系与糖尿病大鼠勃起功能、阴茎血管内皮细胞功能之间,及与一氧化氮/cGMP通路之间的关系同样需要进一步研究。
综上所述,本研究发现糖尿病可导致大鼠发生ED,胰岛素治疗通过增加ICP/MAP,增加阴茎组织中miR-126、VEGF及eNOS的表达水平,改善血管内皮细胞功能,治疗DMED。进一步拟研究严格控制大鼠血糖及延长胰岛素治疗时间对预防和治疗DMED的作用,以及探讨miR-126与eNOS、VEGF之间的关系,及其在DMED发生、发展和胰岛素治疗中的作用,为研究DMED防治新策略提供更加深入的分子研究基础。

